睪丸混合性生殖細胞腫瘤臨床分析
張忠云 孫忠全 汪東亞 葉茂飛 魏 民 張正望 錢偉慶
復旦大學附屬華東醫院泌尿外科(上海 200040)
睪丸腫瘤較少見,僅占男性腫瘤的1%~1.5%,占泌尿系腫瘤的5%,但在15~34歲年輕男性中其發病率列所有腫瘤之首。睪丸腫瘤大部分(90%-95%)為生殖細胞腫瘤,后者的病理類型有精原細胞瘤、胚胎癌、卵黃囊瘤、絨毛膜上皮癌和畸胎瘤等,含有2種或以上成分的即為睪丸混合性生殖細胞腫瘤 (testicular mixed germ cell tumors,TMGCT),國內外報道不多[1],本文回顧性分析我院10余年來的病例,并結合相關文獻來介紹TMGCT的診治經驗。
資料與方法
一、臨床資料
收集我院2003年1月至2016年12月收治的睪丸混合性生殖細胞腫瘤患者,本組15例(同期生殖細胞腫瘤患者共48例),發病年齡15~40歲,平均 (27.6±7.3)歲,左側睪丸腫瘤8例,右側7例;睪丸或同時存在的腹膜后腫瘤切除標本病理至少含有2種上述腫瘤成分;睪丸切除術前瘤標,甲胎蛋白(AFP)4.7~37 316(中位數 161)ng/mL,β-人絨 毛膜促性腺激素(β-HCG)15~200 000(中位數 508)mIU/L。 根據術前檢查分期,Ⅰ期8例,Ⅱ期2例,Ⅲ期5例(見表1)。根據國際生殖細胞癌協作組預后因素分期系統,2例Ⅱ期腫瘤均為預后良好,5例Ⅲ期腫瘤中,3例預后不良,2例預后良好。詳見表1。

表1 患者分期及基本情況表
二、治療方法
完善術前檢查(腫瘤標志物、后腹膜CT、肺部CT等)后,行根治性睪丸切除術,根據手術病理、術前影像檢查結果及術后瘤標確定患者腫瘤分期,轉移性腫瘤患者確定預后分期。基本依據當時權威參考書建議的規范治療(以《坎貝爾泌尿外科學第8版》為主,2002年出版,以下稱“規范”)及《睪丸腫瘤診斷治療指南》[2](以下稱“指南”,2014年出版)進行輔助治療。
對于Ⅰ期非精原細胞瘤患者,其預后危險因素為血管/淋巴管是否浸潤,存在血管/淋巴管浸潤的患者復發風險達50%,而無血管/淋巴管浸潤的患者為15%~20%。結合患者意愿選擇合適的輔助治療手段,包括:(1)睪丸腫瘤病理含有畸胎瘤和卵黃囊瘤成分的患者行腹膜后淋巴結清掃術(RPLND);(2)存在血管/淋巴管浸潤的患者,行 2 周期輔助化療(BEP/EP 方案);(3)無血管/淋巴管浸潤的患者或者拒絕RPLND及化療的予以密切隨訪。
對于轉移性病例,Ⅱ期患者在睪丸切除術后,如瘤標不高,直接行腹膜后淋巴結清掃術,如瘤標高,行3個周期的BEP方案或4個周期的EP方案,之后如有殘留腫瘤(>1cm),行腹膜后淋巴結清掃術,如無腫瘤殘留,則可不清掃,如患者不愿實施基礎化療,可行淋巴結清掃術后實施2個周期的BEP輔助化療。
Ⅲ期患者預后良好組3個周期BEP方案化療或4個周期EP方案化療,預后中等及預后不良組行4個周期的BEP方案化療。化療2周期后重新評估,如瘤標降低或穩定、腫瘤縮小,則繼續化療;如瘤標降低,但腫瘤增大,則誘導化療結束后行局部治療。2個療程以后如果瘤標不降反升,則采用新的化療方案 (大劑量化療等)。化療過程中如有肝功能異常、粒細胞減少等不良反應,予以對癥處理。
三、具體化療方案
BEP方案:順鉑20mg/m2,第1~5天靜脈滴注,鬼臼乙叉甙100mg/m2,第1~5天靜脈滴注,博來霉素30mg,第2、9、16天肌肉注射,每3周重復一次。EP方案:順鉑20mg/m2,第 1~5 天靜脈滴注,鬼臼乙叉甙 100mg/m2,第1~5天靜脈滴注,每3周重復一次。
四、隨訪方案
Ⅰ期腫瘤患者前1~2年內每3個月隨訪一次,3~5年每6個月隨訪一次,之后每年隨訪一次。轉移患者化療1~3年內每3個月隨訪一次,化療后4~5年每6個月隨訪一次,化療6年以上者,每年隨訪一次。內容包括體檢、腫瘤標志物、胸片(或胸部CT,對于胸部轉移灶患者)、盆腔及腹部CT。
結 果
15例TMGCT患者中,同時含有2種病理成分的10例,3種病理成分的5例。各種腫瘤成分組成及出現頻次:卵黃囊瘤 9次(60%),精原細胞瘤 9次(60%),胚胎癌 9次(60%),畸胎瘤 6次(40%),絨癌 2次(13.3%)。這些病理成分中,畸胎瘤對放、化療不敏感,只能手術切除[3],而其他成分一般對于化療敏感,故畸胎瘤成分是否存在是選擇治療方案時必須考慮的因素。以下部分內容將根據是否含有畸胎瘤成分分類。
8例Ⅰ期患者,1例含畸胎瘤成分的患者行RPLND,7例不含畸胎瘤成分的患者中3例行RPLND,不行輔助化療,其余4例患者僅密切隨訪,Ⅰ期患者現隨訪2~8年,平均4.1年,均存活,無復發。
2例Ⅱ期病例睪丸病理均含畸胎瘤成分,預后分期良好,1例RPLND后行2周期BEP方案化療,1例3周期BEP方案化療后腹膜后淋巴結消失,未行RPLND,2例均存活,未復發,RPLND者已隨訪15年,化療者已隨訪4年。
5例Ⅲ期患者中,含有畸胎瘤成分的3例,預后分期不良,其中2例為肺、腹膜后淋巴結、腹股溝淋巴結轉移,第1例行BEP方案化療效果不佳,行大劑量化療(卡鉑、依托泊苷、環磷酰胺),效果不佳,睪丸切除后20個月死亡。第2例行4周期BEP方案,肺轉移灶縮小,但出現鎖骨上淋巴結轉移,后行局部治療(HIFU),效果不佳,睪丸切除術后6年死亡。第3例為肺轉移、腹膜后淋巴結轉移及肝轉移,4周期BEP方案后瘤標下降但未完全正常,行大劑量化療(卡鉑、依托泊苷、環磷酰胺)后瘤標正常,隨訪6年,存活未復發;不含畸胎瘤成分的2例,預后分期良好,1例為肺轉移,3周期BEP方案后轉移灶消失,隨訪15年存活未復發,另1例為腹膜后淋巴結轉移及肺轉移,3周期BEP化療后腹膜后淋巴結仍有1.7cm,行RPLND,病理為膠原組織,隨訪8年,存活未復發(見表1)。
15例 TMGCT 患者,隨訪 2~15年(平均 6.5年),死亡2例,其余13例均存活,未復發,無進展生存率76.7%。
BEP方案化療不良反應:在總療程中,4例患者出現Ⅰ~Ⅱ度的白細胞減少,3例患者出現Ⅰ~Ⅱ度谷丙轉氨酶ALT升高,予以集落細胞刺激因子及護肝治療后均可緩解,未見其他嚴重不良反應。
討 論
睪丸腫瘤雖少見,但全球范圍內睪丸腫瘤發病率有逐漸增加趨勢,我國的睪丸腫瘤年發病率在1/10萬左右,大部分為睪丸生殖細胞腫瘤,混合性生殖細胞腫瘤是其中的一種,含有多種病理成分,在治療時按非精原細胞瘤治療[4]。
TMGCT在生殖細胞腫瘤中的比例并不低,國外有報道,30%~50%的生殖細胞腫瘤為TMGCT,甚至有更高比例的報道(68.2%,1765/2589)[5];國內的報道不多,多為個案報道,在相對病例多的報道中,比例為16%(22/133)[6]和 24.1%(13/54)[1]。本組病例 TMGCT 占生殖細胞腫瘤的比例為31.3%,可見TMGCT在臨床上并不罕見。
TMGCT與單一生殖細胞腫瘤(包括精原細胞瘤和非精原細胞瘤)均起源于不能分類的生精小管內生殖細胞腫瘤 (intratubular germ cell neoplasia of the unclassified type,IGCNU,既往稱為原位癌)。染色體12p改變是IGCNU進展成侵襲性腫瘤的標志,IGCUN可進展為精原細胞瘤,再進展為胚胎癌,也有作者認為IGCUN可獨立進展為胚胎癌,而不需先進展為精原細胞瘤。與此相反,卵黃囊瘤、畸胎瘤、絨癌好似均從胚胎癌的基礎上進展而來[7]。這一點可部分解釋為何各個腫瘤成分中胚胎癌出現的頻次最多。
本組病例及有限的國內外報道的腫瘤成分及頻次見表2,從中可以看出,胚胎癌是各組報道中腫瘤出現頻次最多的腫瘤,絨癌是各組中頻次最少的腫瘤,而精原細胞瘤、畸胎瘤、卵黃囊瘤出現次數居中,各家報道不一。有報道,在TMGCT中胚胎癌和畸胎瘤的組合、胚胎癌和卵黃囊瘤的組合是最常見的混合方式,但是各個腫瘤成分中,相關性最強的卻是畸胎瘤和卵黃囊瘤(OR 2.58,P<0.001),而這兩種成分又是睪丸癌遠期復發時最常見的成分[8]。
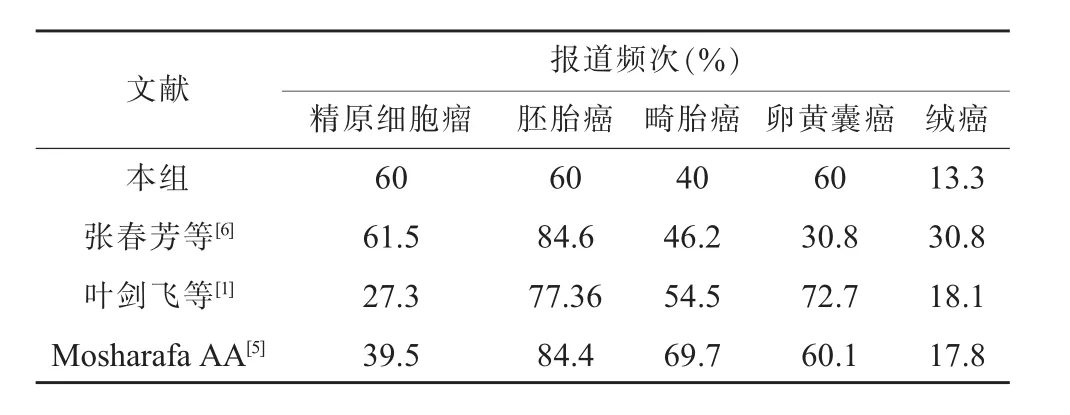
表2 國內外文獻報道的腫瘤成分及頻次
本組中有一例睪丸病理標本為畸胎瘤,腹膜后淋巴結清掃標本病理卻是畸胎瘤及卵黃囊瘤,這反映了睪丸腫瘤區別于其他腫瘤的特點:轉移腫瘤和原發腫瘤的成分可以不一致。有人認為,生殖細胞的多潛能分化可能是新生成分出現的原因[9]。這有重要的臨床意義:因為畸胎瘤對于放、化療不敏感,適合手術切除,如能根據睪丸腫瘤病理成分預測腹膜后轉移灶中是否有畸胎瘤成分,對于治療方案的選擇有重要參考價值。有研究比較了睪丸內腫瘤的不同成分與腹膜后畸胎瘤成分的相關性,其OR值,睪丸內畸胎瘤為3.07(P<0.001),睪丸內卵黃囊瘤為 1.48(P<0.001),絨癌為 1.33(P>0.05),胚胎癌為1.25(P>0.05),說明睪丸內腫瘤如含有畸胎瘤和卵黃囊瘤,腹膜后腫塊內含有畸胎瘤的可能性相對較大。此時,治療方案的選擇,對于Ⅰ期的患者,傾向于RPLND。
治療方面,TMGCT應按照非精原細胞瘤治療。需強調的是,對于行標準化療后腹膜后淋巴結仍大于1cm的,即應懷疑有畸胎瘤成分,應及時行腹膜后淋巴結清掃術。本組按規范及指南治療,有較好的療效,15例TMGCT患者,共隨訪2~15年(平均6.5年),無進展生存率76.7%。
綜上所述,TMGCT在睪丸生殖細胞腫瘤中占一定比例,可能出現轉移腫瘤和原發腫瘤的成分不一致的情況,按規范及指南治療并注意畸胎瘤的特殊性,TMGCT可得到較好療效。

