以代謝因子為抑郁癥治療靶點在中藥抗抑郁單體開發中的應用*
高充,沈劍剛
(香港大學李嘉誠醫學院中醫藥學院,香港)
現代社會的生活與工作節奏日益加快,以抑郁癥為代表的神經精神類疾病發病率呈逐年上升趨勢。統計顯示,我國重度抑郁癥發病率約為3.5%[1]。抑郁癥也是目前致死致殘的主要疾病之一。所以,針對抑郁癥治療及預防的藥物開發是目前我國乃至整個世界神經科學界急需解決的關鍵問題。
由于抑郁癥的相關發病機制尚不清楚,故目前所采取的治療策略均以緩解患者臨床癥狀為主。抗抑郁藥物主要通過影響腦內神經遞質含量從而緩解抑郁焦慮癥狀[2]。而常規抗抑郁藥物常會引起各類不良反應,如藥物依賴、停藥后癥狀復發及睡眠障礙等[3]。所以,尋找抗抑郁靶點及其神經生物學機制能夠為開發新型抗抑郁藥物提供新的思路。
海馬神經新生(hippocampal neurogenesis)的失調是抑郁癥相關的主要特征之一。海馬神經新生是一種存在于成年海馬內的神經組織可塑性。在海馬顆粒細胞區 (dentate gyrus,DG)中,神經干細胞(neural stem cell,NSCs)通過增殖與分化產生新的神經元及神經膠質細胞。在神經新生過程中,NSCs分化成為中間態神經前體細胞 (intermediate progenitor cells,IPCs),隨后分化成為成神經細胞 (neuroblasts,NBs)并最終成熟形成成熟神經元。這種神經細胞數目的增加是一種重要的神經組織結構可塑性 (structural plasticity),神經新生在很大程度上影響了哺乳動物對環境與心理壓力的適應能力[4]。由于長期過度的壓力應激,抑郁癥的發病過程往往伴隨海馬神經新生的降低[5]。研究顯示,多數抗抑郁藥物均能夠逆轉抑郁癥導致的神經新生異常[6]。因此,研究調控海馬神經新生的分子靶點并開發針對該靶點的活性藥物有助于開發新的抗抑郁藥物。
神經新生在抑郁癥發病過程中的作用是多方面的。其中,代謝性疾病如糖尿病和肥胖等能夠導致腦內神經新生異常,并能夠增加患者神經精神類疾病發病的危險[7-8]。諸多代謝因子也早已被證明是調節海馬神經新生的關鍵因子,同時也是抑郁癥治療的潛在靶點[9]。多種經典的代謝因子包括胰島素生長因子、腸促胰島素、多種脂代謝因子等在海馬神經新生及相關行為的調控均扮演著至關重要的角色[10-12]。隨著實驗室證據的積累,各類信號分子也已被陸續證明能夠在代謝調控中起著關鍵作用。而這些代謝因子是否能夠調控神經新生也值得進一步研究。APPL2是一種廣泛存在于細胞內的銜接蛋白,并且在葡萄糖轉運等過程中扮演了關鍵角色[13]。筆者[14]等研究發現,APPL2能夠調節海馬神經新生并影響動物情緒行為。進一步研究提示,APPL2可以作為中藥單體黃芩苷的靶點從而在其促進海馬神經新生及抗抑郁過程中起關鍵作用[15]。通過調控APPL2水平,黃芩苷緩解了抑郁癥小鼠模型的行為學異常并促進了海馬及其他腦區的神經新生。因此,筆者將重點探討代謝因子作為抗抑郁治療靶點的應用,并以APPL2作為實例展望中藥單體對代謝因子的調控及在抗抑郁或神經修復中的應用。筆者將逐一簡介經典的代謝因子及其在神經新生和行為學調控中的作用。同時,介紹筆者對APPL2神經新生調控及作為抗抑郁靶點方面的研究工作,為中醫藥在通過代謝調節從而促進神經新生并治療抑郁癥方面提供新的理論依據與參考。
1 海馬神經新生與抑郁癥治療
海馬體作為大腦邊緣系統中的關鍵腦區,其高度的神經可塑性使其在調控動物的認知功能及情緒等行為中扮演關鍵的角色[16-17]。神經新生是一種在組織層面調節神經元數目的結構可塑性。成年海馬內NSCs中有一定數量始終保持增殖分化狀態,隨著細胞增殖,NSC的子代細胞會出現形態改變,形成IPCs,而IPCs則將進一步形成神經前體細胞 (neuroblast,NB),并逐步分化為成熟神經元直至成熟態,并整合進入海馬神經網絡 (圖1)。海馬神經新生的異常參與了多種神經精神類疾病的發生發展。例如,在神經退行性疾病及卒中導致的神經損傷中,大腦的自我修復機制能夠一定程度上促進海馬神經新生,神經新生的功能異常則加重神經退行性疾病或卒中導致的腦功能損傷[18-19]。在抑郁癥的發病過程中,患者心理壓力過大將導致外周糖皮質激素失衡,嚴重影響NSCs的增殖分化,從而使海馬神經新生減弱[20]。減弱后的海馬神經新生被認為是導致大腦無法正確處理心理壓力的主要原因。因此,大腦對外界刺激的過度反應導致了丘腦-垂體-腎上腺軸興奮性增加,進一步加重了壓力激素如糖皮質激素的釋放,這一過程加速了海馬神經新生的抑制,并形成惡性循環從而導致了抑郁癥的發生(圖2)。因此,促進神經新生是治療抑郁癥的關鍵。報道顯示,通過轉基因手段增加海馬神經新生足以緩解抑郁癥導致的抑郁焦慮情緒[21]。多種抗抑郁藥物如氟西汀等均能夠促進海馬神經新生[22-23]。
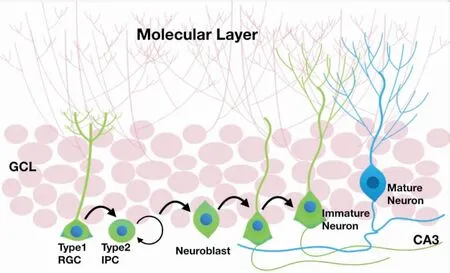
圖1 成年海馬神經新生過程示意圖Fig.1 Schematic diagram of adult hippocampal neurogenesis
除海馬外,神經新生同樣存在于其他特定腦區如側腦室和嗅球。NSCs在側腦室下區(sub-ventricular zone,SVZ)增殖并逐漸成熟形成NBs。這部分NBs通過嘴側遷移流(rostral migration stream,RMS)逐漸遷移至嗅球區并整合進入嗅覺神經網絡[24]。在抑郁癥過程中,由于糖皮質激素的過度增加,SVZ區的神經新生也被同時影響并因此影響了動物的嗅覺行為[25]。而嗅覺行為異常則能夠增加患者精神壓力從而加重抑郁癥癥狀。因此,促進神經新生是抑郁癥治療中緩解抑郁焦慮行為并改善嗅覺功能的關鍵因素。

圖2 海馬神經新生在抑郁癥發病中的關鍵作用Fig.2 Key role of hippocampal neurogenesis in the pathogenesis of depression
2 代謝因子與神經新生
神經新生在多種內源性與外源性因素相互作用下收到嚴格調控。研究影響神經新生的關鍵調控因子是尋找抑郁癥治療靶點的有效手段。經典的調控神經新生的內源性分子包括Wnt、Notch、HIF1、NRF2等[26-27]。外源性的信號包括鈣離子、神經遞質、內皮細胞分泌的血管內皮生長因子等同樣能夠調控海馬神經新生進程[28-29]。大量研究證明,代謝性疾病尤其是糖尿病是導致各類神經精神類疾病的危險因素[30-31]。糖尿病動物模型會出現明顯的神經新生水平的降低[32]。與糖尿病發生發展相關的代謝因子如GSK3,胰島素生長因子1 (insulin-growth factor-1,IGF-1)及胰高血糖素樣肽-1(glucagon-like peptide 1,GLP-1)等,均參與了神經可塑性調控并在神經退行性疾病及神經精神類疾病發病過程中起關鍵作用[33-35]。很多經典的代謝信號分子均已經證實能夠調控神經新生并可能是神經精神類疾病治療的關鍵靶點。
2.1IGF-1 IGF-1是參與胰島素信號通路的關鍵分子。重組性IGF-1能降低糖尿病模型中的血糖水平[36]。IGF-1在神經系統中具有廣泛的分布[37]。IGF-1參與了多種細胞功能的調節包括細胞生長,能量代謝以及干細胞的分化[36,38]。研究顯示,外周注射IGF-1能夠顯著促進大鼠海馬神經元的產生[39]。而側腦室注射IGF-1能夠明顯緩解衰老導致海馬神經新生的降低[40]。IGF-1同時參與了其他類型神經可塑性的調控,IGF-1高表達轉基因小鼠表現出了海馬突觸新生的顯著增加[41]。IGF-1同樣是一種抑郁癥治療的關鍵靶點。有報道顯示,抑郁癥小鼠模型會表現出外周及海馬組織IGF-1水平的降低[42]。而外源性給予IGF-1能夠逆轉抑郁癥模型動物的行為學異常并促進海馬區NSC的增殖[43]。
2.2腸促胰島素(incretins)腸促胰島素是一種腸道分泌的代謝調節因子,通過激活胰島素分泌、抑制胰高血糖素產生等起到抑制空腹、降低食欲及進食的作用[44]。大量研究已經證明腸促胰島素能夠作為一種治療神經精神類疾病的關鍵靶點。例如,GLP-1和腸抑胃肽 (gastric inhibitory polypeptide,GIP)能夠對阿爾茲海默病小鼠模型起到顯著的神經保護效應[45-46]。有研究顯示GIP是維持海馬內一定密度的神經前體細胞、突觸前及突觸后可塑性的關鍵分子[47]。而增加血液中GLP-1水平能夠顯著促進海馬神經新生水平[48]。而GLP-1敲除或抑制能夠導致小鼠突觸可塑性,海馬神經新生的顯著下降[49-50]。大量研究證明GLP-1類似物及激動劑能夠在神經退行性疾病中發揮保護效應[51-54]。而GLP-1激動劑已被證明能夠緩解糖尿病并發的抑郁癥癥狀[34]。
2.3脂代謝因子 脂代謝因子的失調參與肥胖、糖尿病等諸多代謝疾病的發病進程[55]。多數脂代謝因子已被證實在神經新生過程的調控中扮演關鍵角色[56]。研究顯示,經典的脂代謝因子如瘦素(leptin)、脂聯素(adiponection)等參與了海馬神經新生的調控,并能夠作為抗抑郁治療的靶點。
瘦素是脂肪細胞分泌的參與能量代謝與進食抑制的關鍵脂代謝因子[57]。瘦素在糖尿病發展中起著關鍵作用,瘦素及其受體敲除的ob/ob和db/db轉基因小鼠能夠作為理想的糖尿病動物模型[58]。瘦素也參與海馬神經新生的調控,報道顯示,瘦素能夠通過GSK3信號通路逆轉糖皮質激素引起的海馬神經新生降低并緩解抑郁焦慮行為[59]。給予瘦素3個月能夠顯著逆轉阿爾茲海默病小鼠模型海馬神經新生的減少[60]。
脂聯素同樣參與了海馬神經新生的調節。1型和2型脂聯素受體均在神經系統中廣泛表達[61]。而抑郁癥模型中,脂聯素水平的降低往往伴隨著抑郁、社交障礙等癥狀的加劇[62]。在海馬NSCs中特異性敲除脂聯素會顯著抑制導致運動調節的抗抑郁行為[63]。不僅如此,脂聯素通路中的調控信號同樣在細胞生長,代謝及分化等過程中起到了關鍵的調控作用。
APPL(adaptor protein,phosphotyrosine interacting with PH domain)蛋白是一種重要的代謝調控因子。從細胞信號通路作用角度出發,APPL蛋白是一種銜接蛋白,其包含pleckstrin同源結構域(PH domain)、磷酸酪氨酸結合域(PTB)以及BAR(Bin-Amphiphysin-Rvs)結構域。APPL蛋白已知有APPL1和APPL2兩種形式。APPL1被證明參與了包括細胞增殖、代謝調控、癌細胞轉移等一系列過程[64-66]。APPL2被證明參與了葡萄糖轉運等過程,并且是脂聯素通路上的關鍵調控分子[13]。同時,APPL2還參與了PI3K/Akt的活性調節[67]。這些研究表明APPL2參與了多種生理功能的調節。作為關鍵的代謝因子,APPL2可能在神經干細胞的調控及其在抑郁癥發病中扮演關鍵角色。筆者的研究首次確認了APPL2對海馬其他腦區神經新生的調控,并證明了APPL2能夠作為一種促進神經新生和抗抑郁的治療靶點。
APPL2可能是參與海馬神經新生及動物抗抑郁行為的關鍵因子,為驗證該假說,筆者構建了APPL2高表達轉基因小鼠。在行為學測試中,APPL2轉基因小鼠表現出了顯著的抑郁與焦慮行為。同時,在APPL2轉基因小鼠的海馬組織中,新生神經元的數目、NSCs的增殖和分化,以及新生成神經細胞的成熟均出現了明顯抑制[14]。從APPL2轉基因小鼠表現的抑郁焦慮行為及顯著抑制的神經新生方面,筆者推測APPL2的功能可能與抑郁癥導致的海馬神經新生降低有密切關聯。糖皮質激素受體 (glucocorticoid receptor,GR)是一種廣泛表達在神經系統中的、參與調控動物應激行為的關鍵蛋白。同時,GR的過度活化是連接抑郁癥中抑郁焦慮行為與神經新生損傷的關鍵因素[68]。因此,筆者檢測了APPL2轉基因小鼠海馬中GR的磷酸化水平以探究是否APPL2參與了GR活性的調控[14],結果表明,在基礎狀態下APPL2轉基因小鼠海馬中GR磷酸化水平顯著高于野生型;并且,不論在基礎與應激狀態下,APPL2轉基因小鼠海馬GR活性并未如野生型小鼠一樣隨著短暫應激出現GR活性的升高。這一結果提示,APPL2過度表達在基礎狀態下上調了GR的活性并且影響了其對外界應激因素的應答,這種持續性的中樞神經系統GR的過度活化極有可能導致神經新生的抑制。筆者進一步研究發現,GR的特異性抑制劑米非司酮(RU486)能夠逆轉APPL2過度表達導致的神經新生抑制以及抑郁行為。因此,APPL2是調控GR活性的關鍵因素[14]。
在成年腦內除海馬外,神經新生同樣是嗅覺系統即SVZ區及嗅球區的重要特征之一。并且,嗅覺系統的神經新生是調控動物嗅覺功能的重要因素[69]。在抑郁癥狀態下,過度升高的糖皮質激素能夠導致嗅覺系統神經新生的抑制并引起抑郁癥相關的嗅覺障礙[25]。而嗅覺障礙也是導致并加重抑郁癥癥狀的關鍵危險因素[70-71]。筆者的研究進一步證明,APPL2過度表達同樣抑制了嗅覺系統的神經新生,并且降低了動物的嗅覺敏感度[15]。同時,筆者在APPL2轉基因小鼠的嗅球區檢測到了GR的過度活化,證明APPL2在中樞神經系統對GR的調控不僅僅存在于海馬組織。傳統中藥能夠為促進海馬神經新生及抗抑郁治療提供豐富的藥物資源。同時,多種傳統中藥單體能夠表現出調節代謝功能的作用。而通過明確這些單體的藥物機制,能夠為進一步拓展其抗抑郁或促進神經再生效果提供理論支持[72]。黃芩是一種能夠調節情志并用于抑郁癥治療的藥物[73]。作為黃芩中的關鍵組分,黃芩苷的抗抑郁效應及促神經新生效應已被廣泛證實[74-75]。前期研究證明,黃芩苷能夠作為一種抗高血糖藥物作用于鏈脲佐菌素誘導的糖尿病模型[76]。黃芩苷同時還具備調節GR活性并緩解抑郁癥癥狀及促進神經新生的效應[75]。然而,APPL2是否為黃芩苷抗抑郁及促進神經新生的關鍵環節尚未可知。筆者發現,將黃芩苷處理后的APPL2轉基因小鼠海馬及嗅球區的GR活性顯著降低。并且,黃芩苷處理能夠逆轉APPL2過度表達導致的海馬及嗅覺系統的神經新生損傷以及相關的抗抑郁行為及嗅覺敏感性的降低。同時,使用黃芩苷飼處理野生型糖皮質激素誘導的小鼠抑郁癥模型則能夠降低嗅球與海馬組織中APPL2的表達水平[15]。這些結果證明,APPL2是黃芩苷調節抗抑郁行為及嗅覺行為的關鍵因素。這些結果提示,黃芩苷能夠通過調控神經新生同時緩解抑郁癥導致的神經精神癥狀及嗅覺障礙。為證明這一假說,筆者構建了糖皮質激素誘導的野生型抑郁癥模型,并利用長期黃芩苷處理以觀察抑郁癥相關的行為學異常及神經新生變化,結果發現,黃芩苷顯著上調了抑郁癥模型中海馬、嗅球,以及SVZ區中NSC的增殖及分化。并且,行為學測試證明黃芩苷能夠緩解抑郁癥模型下的抑郁焦慮行為以及抑郁癥并發的嗅覺障礙[15]。
綜上所述,APPL2作為調控神經新生及動物相關抗抑郁及嗅覺行為的關鍵因子,其對中樞神經系統GR水平的調控是黃芩苷治療抑郁癥及相關嗅覺障礙并促進海馬和嗅覺系統神經新生的重要機制(圖3)。
除了直接作用于APPL2外,其他中藥單體也已被證明能夠作用于APPL2通路相關信號分子。如姜黃素已被證實能夠調節體內脂聯素信號通路,而脂聯素信號同時是APPL2的上游調控信號之一[77-79]。人參皂苷Rg1也以被證實能夠調控糖皮質激素受體[80]。其他證據則表明人參皂苷Rg1能夠調控PI3K參與的信號通路[81],而PI3K信號也已被證明與APPL2信號密切相關[66-67,82]。這些證據均證實了中藥單體在調控APPL2及其相關信號通路中的關鍵作用,并且這種效應提示了多種中藥單體能夠通過調控代謝因子從而促進神經新生并緩解抑郁癥相關的神經功能紊亂。

圖3 APPL2在抑郁癥發病中的關鍵作用Fig.3 Key role of APPL2 in the pathogenesis of depression
3 結束語
抑郁癥是一種復雜的神經精神類疾病,其發生與發展涉及不同類型的神經功能失調,例如神經遞質代謝水平的改變、突觸可塑性損傷、海馬神經新生降低、神經環路調控改變等[23,83-85]。其中,海馬神經新生的壓抑是抑郁癥的主要特征之一,并且多數藥物的抗抑郁療效均不同程度地依賴于其對海馬神經新生的改善[86]。代謝性疾病如糖尿病和肥胖等是多種神經精神類疾病如卒中、阿爾茲海默病、抑郁癥甚至躁郁癥的危險因素[87-90]。這些聯系提示代謝因子參與了與動物行為密切相關的神經功能尤其是海馬神經新生。通過調控代謝因子的活性與功能同樣能夠達到治療這些疾病的效應。所以,研究新的、能夠參與調控海馬神經的代謝因子有助于新的抗抑郁藥物或抑郁癥預防方法的開發。
多種代謝因子在神經精神疾病發病中的作用已被廣泛研究。筆者的研究首次確定了代謝因子APPL2在神經新生及動物抗抑郁行為中的關鍵調控作用。不僅如此,筆者同時確認了APPL2可以作為一種抗抑郁及緩解抑郁癥導致的嗅覺障礙的藥物治療靶點,并且進一步提出中藥單體黃芩苷可以通過作用于APPL2以緩解抑郁焦慮情緒及嗅覺障礙,并促進海馬及嗅覺系統的神經新生[14-15]。因此,APPL2是黃芩苷抗抑郁并促進神經新生的關鍵靶點。值得注意的是,APPL2并非是調節神經再生及緩解抑郁癥相關癥狀的唯一靶點。結合筆者的前期研究及其他實驗室證據,APPL2參與了多種信號途徑的調控,并且與除抑郁癥或代謝性疾病外的多種生理病理過程密切相關[82,91-92]。通過代謝調控的方式,利用中藥多途徑多靶點的特點則有望通過調控APPL2及相關的信號分子從而起到對神經新生及精神行為持續系統的控制。類似的實驗室研究能夠為中藥復方、提取物及單體在未來疾病治療應用中提供可靠的證據與指導。
神經干細胞研究是再生醫學中的重要領域。藥物治療是臨床上治療神經精神疾病的主要手段,通過結合中藥資源尋找調控神經新生的靶點從而完成對成年腦內源性神經干細胞的調控正是一種藥物促進神經再生的有效方法。神經新生的調控機制及藥物干預的研究不僅能夠為抗抑郁藥物的開發提供新的思路,同時還能夠為治療神經退行性疾病及卒中后神經修復提供新的靶點和治療策略。因此,通過研究神經新生的調控靶點,并結合中藥單體尋找作用于該靶點的藥物,將為再生醫學的臨床實踐提供新的治療策略和思路。

