3,3′-二吲哚甲烷對新生大鼠炎癥損傷心肌細胞的保護作用
楊文健,焦蓉,劉月,孫曉東,桑明
(湖北醫藥學院附屬襄陽市第一人民醫院兒科,襄陽 441000)
膿毒癥是由多種炎癥因子過量產生并介導的全身性炎癥反應的一類疾病[1]。嚴重的膿毒癥與感染性休克、全身炎癥反應綜合征(systemic inflammatory response syndrome,SIRS)、多器官功能障礙綜合征(multiple organ dysfunction syndrome,MODS)密切相關,更重要的是,心臟功能受損最為常見[1]。然而,膿毒癥病理生理學尚不完全清楚,治療方法有限。目前已知炎癥反應參與膿毒癥心功能障礙的發生發展[2-3]。因此,找到有效的治療干預措施以抑制炎癥信號傳導,從而中斷細胞因子合成的惡性循環,可以最終抑制病情惡化。
脂多糖(lipopolysaccharide,LPS)作為革蘭陰性細菌細胞壁的一種成分,可在被細菌感染的宿主中引起局部或全身炎癥反應。Toll樣受體-4(Toll like receptor-4,TLR-4)是一種LPS受體,可以識別病原體相關的分子模式,對細胞信號傳導有著至關重要的作用[4]。雖然心肌細胞不是參與先天免疫的特異性細胞,但TLR-4可在心肌細胞中表達。TLRs在膿毒癥介導的心肌損傷中發揮重要作用,但是其機制尚不清楚。據報道,激活TLR-4導致MyD88(myeloid differentiation primary-response gene 88)募集,隨后激活下游絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)途徑[4]。MAPKs途徑的激活誘導促炎基因表達上調,并促進多器官功能障礙和SIRS的進展。因此,在心血管疾病中,MAPK信號通路可能是一個新的治療方向。
3,3′-二吲哚基甲烷(3,3′-diindolylmethane,DIM),屬于吲哚-3-甲醇(indole-3-carbinol,I3C)的衍生產物,可從十字花科植物中提取,已證實具有抗血管生成、抗癌和抗肥大等作用[5-7]。此外,吲哚化合物在某些炎癥性疾病中具有抗炎作用[7]。然而,關于DIM對新生大鼠心肌細胞中LPS誘導的炎性損傷的作用知之甚少。因此,在本研究中,筆者首先觀察DIM是否具有抑制LPS誘導的新生大鼠心肌細胞炎癥反應的作用,并進一步探討了DIM對新生大鼠心肌細胞損傷保護作用的分子機制。
1 材料與方法
1.1藥品與試劑 DMEM/F12培養基(GIBCO公司),四季青胎牛血清(浙江天杭生物科技有限公司,批號:18040502),CCK-8試劑盒(Dojindo,Kumamoto,Japan),TRIzol試劑(Invitrogen,11667-165),LPS(Sigma,L2630)。一抗包括ERK1/2(Cell Signaling Technology,4370),p-ERK1/2(Cell Signaling Technology,4695),P38(Cell Signaling Technology,9212),p-P38(Cell Signaling Technology,4511),T-JNK(Cell Signaling Technology,9258),p-JNK(Cell Signaling Technology,4668),TLR-4(Santa Cru Biotechnology,30002)和GAPDH(Santa Cru Biotechnology,25778)。二抗來自LI-COR Biosciences的山羊抗兔抗體(Lincoln,NE,USA)。DIM(通過高效液相色譜法分析測定含量為98%)購自上海醫療科技發展有限公司。
1.2設備 低溫離心機(Eppendorf Centrifuge 5804 德國),電泳轉膜裝置(Bio-RAD,美國);數顯恒溫水浴鍋(泰州市華普達教學儀器有限公司),Model 550 酶標儀(Bio-Rad,美國);Bio Sen SC300 凝膠圖象分析系統(上海山富科學儀器有限公司);Heal Force 生物安全柜(力康生物公司);倒置熒光顯微鏡(Olympus 公司),共聚焦顯微鏡(LEICA,SP5),Smartspec Plus分光光度計(Bio-Rad),ABI 7500儀器(Life Technologies,USA)。
1.3心肌細胞的分離和分組 新生大鼠心肌細胞獲自出生3 d內的SD大鼠[8]。吸入二氧化碳(CO2)法處死新生大鼠。首先,將心臟置于冷DMEM/F12的直徑100 mm培養皿中,剪碎組織。心臟組織在于34 ℃、0.125%tryspin中消化15 min,輕輕搖動,重復消化5次,獲得單個細胞。收集所有消化液并以1000 r·min-1(r=42 cm)離心8 min。將這些細胞重新懸浮并通過直徑75 μm細胞過濾器濾過。最后將分離的細胞用含有15%FBS、1%青霉素(100 U·mL-1)和鏈霉素(100 mg·mL-1)的DMEM/F1培養基置于培養箱培養。細胞實驗分為4組:對照組、LPS組、DIM組和LPS+DIM組。細胞饑餓處理8 h后,再給予LPS和(或)DIM。
1.4CCK-8 通過CCK-8實驗檢測DIM對心肌細胞活性的影響。細胞(1×105·mL-1)接種在96孔中并培養48 h,每個濃度6個副孔。細胞饑餓處理8 h后,給予不同濃度的DIM(5,10,20和60 μmol·L-1)處理24 h。每孔加入CCK-8試劑10 μL孵育4 h,并用酶標儀(Bio-Tek,Synergy HT)在450 nm(吸收波長)和630 nm(參比波長)檢測吸光度。
1.5免疫熒光染色 本實驗通過標記α-肌動蛋白染色心肌細胞來觀察大鼠新生心肌細胞的形態。用溫磷酸鹽緩沖液(PBS)洗滌3次,4%多聚甲醛(Sinopharm Chemical Reagent Co.,Ltd)固定15 min,0.2%Triton X-100(Amresco)透化后,用8%山羊血清封閉。然后用1%抗-α-肌動蛋白抗體(Millipore)1:100的稀釋液孵育過夜,再與山羊抗小鼠IgG二抗(Alexa Fluor 488)共孵育1 h,用含有DAPI的Slow Fade Gold抗褪色試劑固定在載玻片上。用定量數字圖像分析系統(Image Pro-Plus,6.0版)測量陽性細胞的數量。
1.6實時-熒光定量聚合酶鏈免疫反應(RT-PCR)通過RT-PCR檢測細胞內促炎遞質的mRNA表達水平。向各組大鼠心肌細胞中加入適當體積的TRIzol,提取RNA。根據說明書,通過分光光度計檢測RNA濃度,并使用Smartspec Plus分光光度計(Bio-Rad)使用A260/A280估算純度。使用oligo(dT)引物和Tran-scrptor First Strand cDNA合成試劑盒(Takara,047A)在20 μL反應體積中用96孔熱循環儀(Applied Biosystems)將RNA(每個樣品2 μg)逆轉錄成cDNA。使用SYBR Green PCR Master Mix(Takara,04897030001)用ABI 7500儀器(Life Technologies,USA)定量PCR擴增,并檢測白細胞介素(IL)-6、腫瘤壞死因子(TNF)-α和HMGB1相對mRNA表達水平。以下是PCR引物:IL-6正義鏈:5'-GTTGCCTTCT TGGGACTGATG-3',反義鏈:5'-ATACTGGTCTGTTGTG GGTGGT-3';TNF-α正義鏈:5'-AGCATGATCCGAGTG-TGGAA-3',反義鏈:5'-TAGACAGAAGAGCGTGGTGGC-3';HMGB1正義鏈:5'-TGCT GCATATCGAGC-TAAAGG-3'和反義鏈:5'-CCATACTGTACC AGG-CAAGGT-3';GAPDH:正義鏈:5'-GACATGCC-GCCTGGAGAA AC-3',反義鏈:5'-AGCCCAGG-ATGCCCTTTAGT-3'。反應在95 ℃下進行30 s,然后進行40個循環,在95 ℃下10 s,在60 ℃下34 s。
1.7Western blotting法檢測相關蛋白表達水平 利用蛋白質印跡評估TLR-4、P38、p-P38、ERK、p-ERK、JNK、p-JNK等相關蛋白質的表達水平。向各組新生大鼠心肌細胞加入蛋白裂解液,提取蛋白質,并用BCA蛋白質測定試劑(Thermo,23225)檢測蛋白質濃度。在還原條件下,在10%SDS/PAGE上分離凝膠中的蛋白質樣品(30 μg),然后使用凝膠轉移裝置(invitrogen)轉移到聚偏二氟乙烯(PVDF)膜上。為了避免非特異性抗體結合的干擾,在室溫下用5%脫脂乳將PVDF膜封閉1.5 h。PVDF膜與TLR-4、P38、p-P38、ERK、p-ERK、JNK、p-JNK及GAPDH的一抗在4 ℃孵育過夜,TBS洗脫后敷二抗。洗脫后采用電化學發光顯色,再進行定量分析。
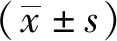
2 結果
2.1DIM對新生大鼠心肌細胞活性的影響 利用CCK8實驗檢測不同濃度DIM(5,10,20和60 μmol·L-1)對新生大鼠心肌細胞活性的影響。結果見圖1。5,10,20 μmol·L-1DIM對新生大鼠心肌細胞沒有顯著的細胞毒性。然而,與對照組比較,大劑量DIM(60 μmol·L-1)作用的細胞活性顯著降低。提示60 μmol·L-1DIM對新生大鼠心肌細胞具有明顯的細胞毒性。為了減少DIM的非特異性細胞毒性,觀察了DIM對LPS誘導的炎癥損傷的影響。用LPS(10 mg·L-1)和不同濃度(5,10,20和60 μmol·L-1)的DIM共同與心肌細胞培養24 h。結果見圖1。LPS+DIM組(LPS+DIM 5,10,20 μmol·L-1)細胞活性高于LPS組。60 μmol·L-1DIM 組細胞存活率明顯降低。綜上,DIM作用濃度以20 μmol·L-1為宜。
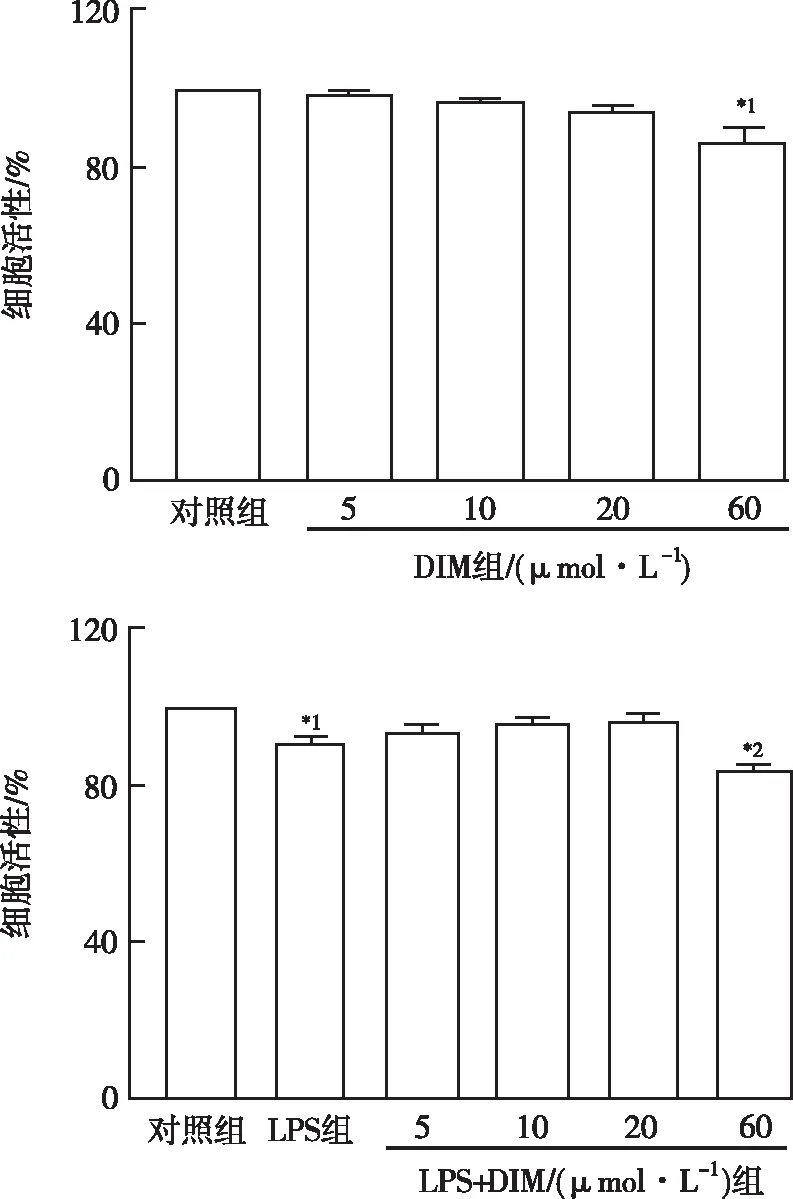
2.2DIM對LPS誘導的新生大鼠心肌細胞形態學改變的影響 利用免疫熒光顯微鏡觀察心肌細胞的形態學變化,鑒別DIM對LPS誘導的新生大鼠心肌細胞形態學變化的影響。將心肌細胞與LPS(10 mg·L-1)和(或)DIM(20 μmol·L-1)共孵育24 h。對照組可觀察到正常心肌細胞呈梭形或不規則扁平狀,逐漸形成不規則星狀,利于與其他細胞形成交織。經LPS處理后,心肌細胞體積變大,肌絲紊亂。經過DIM治療后,LPS誘導的肌絲損傷得到改善。形態學觀察結果表明DIM可以改善LPS誘導的形態學變化,見圖2。
與對照組比較,*1P<0.05,*2P<0.01。圖1 各組新生大鼠心肌細胞活性比較Compared with control group,*1P<0.05,*2P<0.01.Fig.1 Comparison of cell viability of cultured neonatal rat cardiomyocytes in all groups
2.3DIM顯著降低炎癥因子的mRNA水平 IL-6、TNF-α與LPS誘導的炎癥反應密切相關[9-10]。研究證實,晚期促炎因子HMGB1亦與膿毒癥臨床結果密切相關,并且發現干擾HMGB1表達相對于干擾IL-6和TNF-α更有效。因此,檢測早期和晚期炎癥因子的mRNA表達水平,以觀察LPS誘導的新生大鼠心肌細胞的炎癥損傷程度。見圖3,12 h后,LPS組早期促炎細胞因子的mRNA表達水平明顯增加。而LPS+DIM組IL-6和TNF-α的mRNA表達水平明顯低于LPS組。此外,與12 h比較,24 h細胞內IL-6、TNF-α的表達水平明顯降低,而HMGB1的表達水平顯著增加。LPS+DIM組可降低晚期炎癥細胞因子HMGB1的基因水平。另外,與對照組比較,DIM組新生大鼠心肌細胞mRNA表達水平差異無統計學意義。
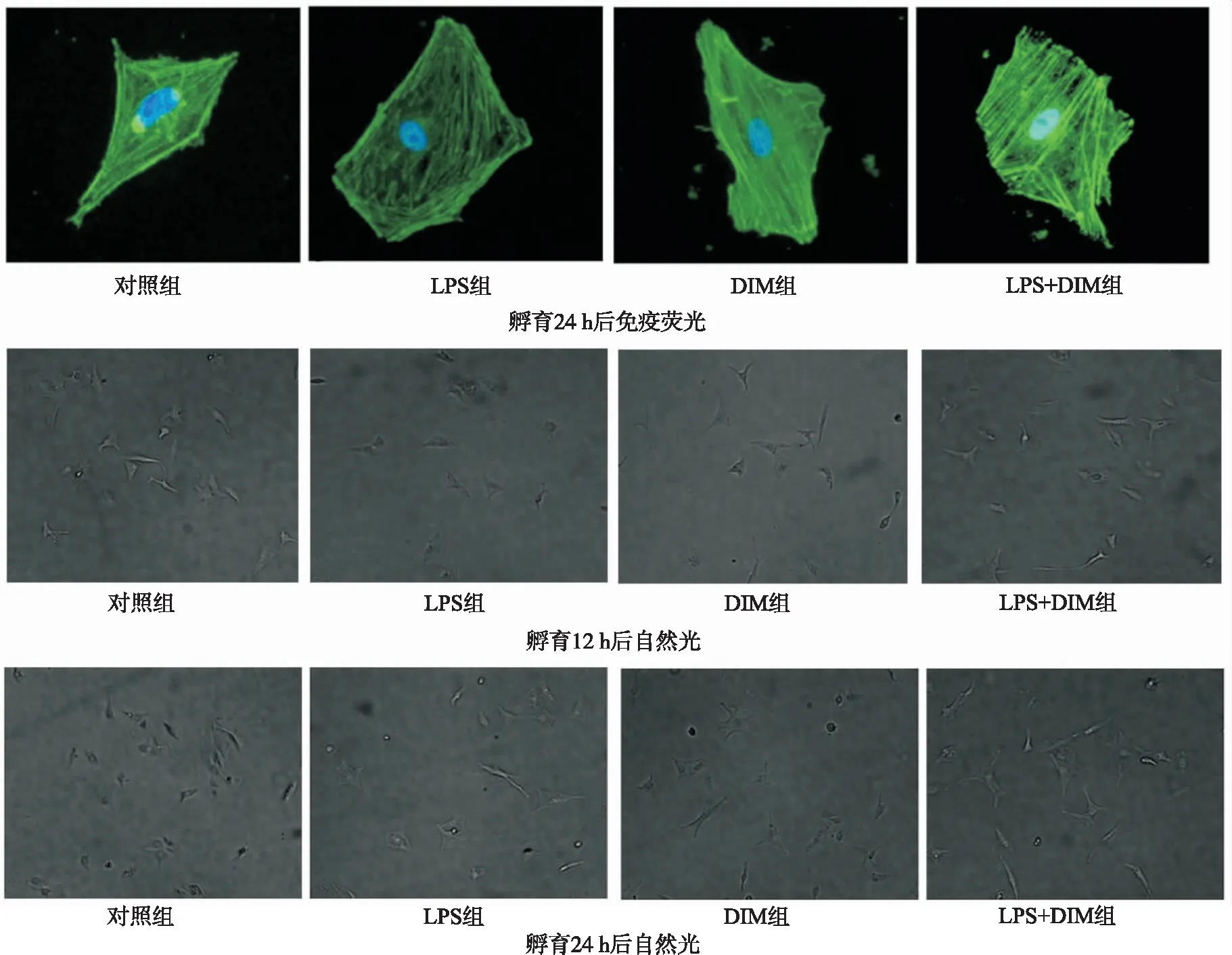
圖2 各組新生大鼠心肌細胞的體外形態學變化(×200)Fig.2 In vitro morphological changes of cultured neonatal rat cardiomyocytes in all groups(×200)
2.4DIM通過TLR-4/MAPKs途徑發揮作用 TLR-4參與LPS激活的炎癥信號通路傳導[3]。研究表明,TLR-4可以激活下游MAPK通路,MAPK是驅動膿毒癥期間炎癥因子產生的關鍵遞質[11-12]。MAPK由ERK1/2、P38和JNK組成。因此,在本研究中,探究TLR-4/MAPKs途徑是否參與DIM對LPS誘導的新生大鼠心肌細胞炎癥損傷保護作用。利用Western blotting檢測TLR-4、ERK1/2、P38和JNK相關蛋白質的表達水平。如圖4所示,膿毒癥組細胞TLR-4、p-ERK1/2、p-P38和p-JNK蛋白表達水平明顯升高。與LPS組比較,LPS+DIM組上述蛋白表達明顯減少。此外,對照組和DIM組之間的TLR-4、p-ERK1/2、p-P38和p-JNK水平沒有顯著差異。
3 討論
強大的炎癥反應被視為膿毒癥重要的病理生理過程。LPS可與心肌細胞表面TLRs受體結合,激活體內NF-κB信號通路,促使炎癥因子TNF-α、IL-6的表達,均可直接或間接抑制心肌細胞,導致細胞功能障礙;另一方面,炎癥因子進一步促進NF-κB信號通路激活,形成惡性循環,引發炎癥“風暴”,導致細胞氧化應激和細胞凋亡,導致多器官功能障礙甚至死亡[13-14]。LPS可導致早期促炎細胞因子的過量產生,包括IL-6和TNF-α[13]。IL-6被認為是膿毒癥和膿毒性休克的重要標志物,可預測疾病的發展及其嚴重程度。由心肌細胞分泌的TNF-α可誘導多種補體因子、一氧化氮合酶、細胞黏附分子、血小板活化因子和多種白細胞介素的產生,與心肌細胞表面相應受體結合,啟動心肌線粒體凋亡通路,在發病早期中起關鍵作用[1,15-16]。早期促炎癥因子(TNF-α和IL-1β)在早期收縮功能下降中起關鍵作用,但不能解釋膿毒癥的長期心肌功能障礙的原因[13]。膿毒癥的臨床結果與晚期HMGB1遞質的水平變化密切相關,而不是LPS誘導的TNF-α和IL-6等早期炎癥遞質。因此,HMGB1是治療敗血癥的更有效靶點。本研究結果顯示,DIM可以降低LPS誘導的IL-6、TNF-α和HMGB1的mRNA水平,提示DIM可顯著抑制LPS誘導的促炎因子的產生。
TLR-4在心肌細胞表面表達,在LPS誘導的炎癥損傷中起重要作用。TLR4可識別LPS,通過MYD88依賴性途徑引起NF-κB入核,啟動炎癥因子轉錄[17],亦可激活下游MAPKs途徑[18]。因此,本實驗觀察了TLR-4/MAPKs信號通路是否參與了DIM對新生大鼠心肌細胞炎癥損傷的保護作用,結果顯示DIM顯著抑制TLR-4、p-ERK1/2、p-P38和p-JNK等蛋白水平。因此,TLR-4/MAPKs信號通路參與DIM對新生大鼠心肌細胞炎癥損傷的保護作用,進而抑制促炎細胞因子IL-6,TNF-α和HMGB1的過量產生。
與對照組比較,*1P<0.05;與LPS組比較,*2P<0.05。圖3 各組心肌IL-6、TNF-α和HMGB1的mRNA表達水平Compared with control group,*1P<0.05;compared with LPS group,*2P<0.05.Fig.3 The mRNA expression levels of IL-6,TNF-α and HMGB1 of cardiomyocytes in all groups
本研究結果為治療膿毒癥提供了新的治療靶點,但本實驗只檢測了炎癥指標,未檢測氧化應激水平,沒有體現心功能的變化及DIM對膿毒癥動物模型生存率的影響,因此存在一定的局限性,需進一步進行動物實驗驗證細胞實驗所得結論。
綜上所述,DIM可以通過抑制TLR-4/MPAKs信號通路降低心肌細胞內炎癥因子水平,對LPS誘導的新生大鼠炎癥損傷心肌細胞具有保護作用。今后將進一步完善相關實驗,探討DIM對膿毒癥的更多作用及其機制,為DIM預防膿毒癥展示更廣闊的前景。
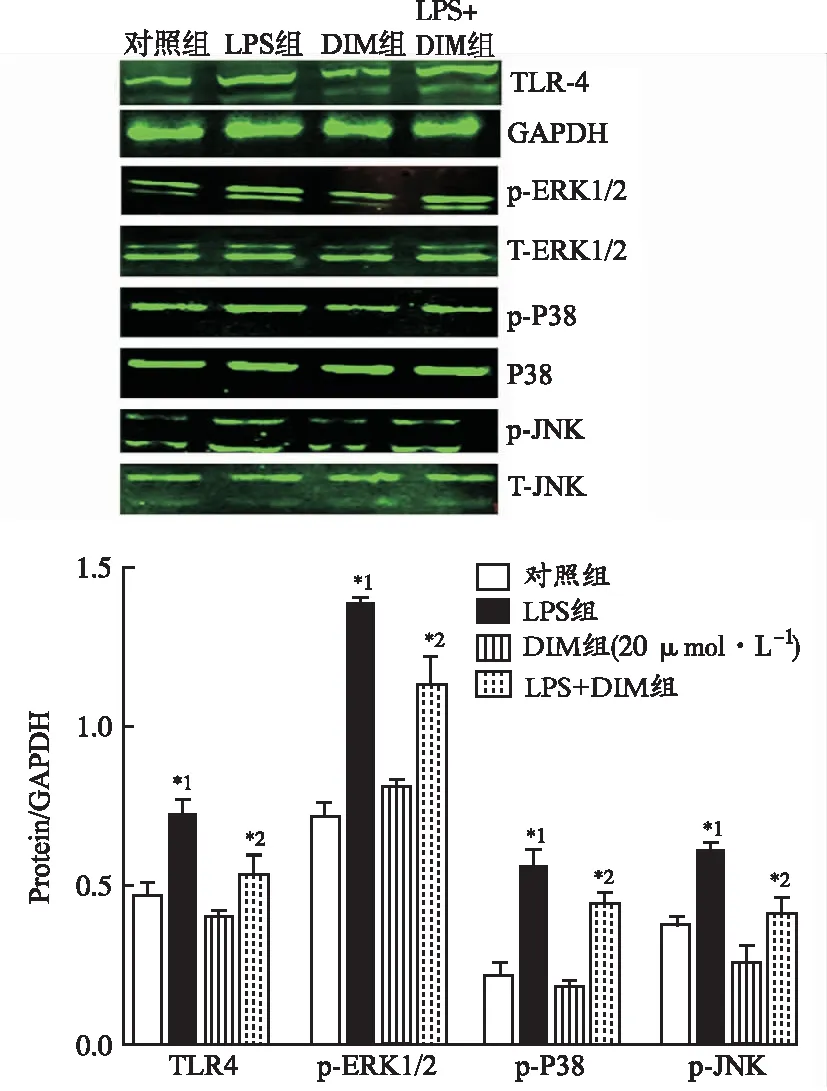
與對照組比較,*1P<0.05;與LPS組比較,*2P<0.05。圖4 DIM抑制LPS激活的TLR-4 /MAPKs信號通路Compared with control group,*1P<0.05;compared with LPS group,*2P<0.05.Fig.4 Inhibition of DIM on LPS-induced TLR-4/MAPKs signaling pathways

