氯諾昔康超前鎮痛對下肢骨折患者術后疼痛介質及血糖波動的影響
王 飛,陳秀卿,曹 煜,葉軍青
0 引言
下肢骨折是骨科多發性疾病,主要是因直接或者間接暴力所致,局部腫脹、疼痛及畸形較為明顯。臨床多需通過外科手術達到解剖復位,但手術創傷較大,能夠引起神經內分泌改變,刺激疼痛介質的釋放,影響術后患者恢復[1]。同時術后疼痛又可刺激機體多種激素級聯釋放,形成高代謝狀態,導致血糖波動,增加術后并發癥[2]。術后疼痛的管理在麻醉學及外科學領域中備受關注,有報道,積極有效的術后鎮痛能夠減輕機體不良應激反應,減少圍手術期并發癥[3-4]。超前鎮痛為圍手術期鎮痛的新理念,是在傷害性刺激發生前采取干預措施,避免中樞及外周神經敏化,起到消除或者減少傷害性刺激所致疼痛的作用[5-7]。氯諾昔康是昔康類非甾體抗炎鎮痛藥[8],主要通過抑制環氧化酶(COX)的活性抑制前列腺類物質的合成起到鎮痛作用,由于其對COX-2的控制作用更強,因此不良反應較小[7]。本研究旨在分析氯諾昔康超前鎮痛對下肢骨折患者術后疼痛介質及血糖波動的影響,為骨折患者圍手術期的疼痛處理提供可靠依據。
1 資料與方法
1.1 一般資料 選擇我院2017年1月至2018年6月收治的151例下肢骨折患者。
納入標準[9]:肢體伴疼痛、畸形、骨擦音和功能障礙,并經X線檢查確診為下肢骨折;明確外傷史;既往無骨折史;凝血功能無異常;無藥物使用禁忌證;ASA分級為Ⅰ~Ⅱ級。排除標準:開放性或者多發性骨折;大血管及神經明顯受損;糖尿病和其他內分泌疾病;長期服用鎮痛藥史或者慢性疼痛病史;心、肝、腎等器官顯著病變;中重度骨質疏松。按隨機數字表法分為對照組和研究組,兩組一般資料比較差異無統計學意義(P>0.05),見表1。本研究家屬及患者均簽署知情同意書,經過醫院倫理委員會許可。
1.2 方法 兩組患者入室后均持續監測心率、無創血壓、心電圖、呼吸頻率、血氧飽和度,給予1~2 L/min低流量面罩吸氧,建議上肢靜脈通路。研究組在手術切皮前30 min靜脈注射8 mg氯諾昔康(生產廠家:湖北邦盛化工有限公司,規格:8 mg/瓶,批號:20160518),對照組在手術切皮前30 min注射同等劑量的生理鹽水。所有患者均接受腰硬聯合麻醉,于L2~3或者L3~4間隙穿刺成功后,在蛛網膜下腔注入2.5~3.0 ml 0.5%羅哌卡因重比重液,硬膜外置管3~4 cm,術中根據患者實際情況(出現疼痛、躁動)適當追加0.75%羅哌卡因(生產廠家:常州凱喬生物科技有限公司,規格:10 ml,批號:20160410),術中均保持患者生命體征平穩、心率及血壓波動低于基礎值20%,必要時加用血管活性藥物維持。術后均采用靜脈自控鎮痛,藥物配比:0.15 mg/kg托烷司瓊(生產廠家:瑞陽制藥有限公司,規格:5 ml∶5 mg,批號:20160814)+0.25 mg/kg地佐辛(生產廠家:揚子江藥業集團有限公司,規格:1 ml∶5 mg,批號:20160319)+2 μg/kg舒芬太尼(生產廠家:宜昌人福藥業有限責任公司,規格:1 ml∶50 μg,批號:20160520),背景量為1.5~2.0 ml/h,自控量為1.5~2.0 ml/h,自控間隔時間為10~15 min。記錄患者術畢至蘇醒時間、拔管時間、意識恢復時間,以及術后不良反應發生情況。
1.3 觀察指標
1.3.1 血液指標 于術前及術后24 h抽取患者外周靜脈血2 ml,常規處理后保存待檢。以酶聯免疫法測定血清前列腺素E2(PGE2)、P物質(SP)、β-內啡肽(β-EP)水平。采用血糖儀測定患者術前及術后24 h血糖水平,計算血糖水平平均值(MBG)。
1.3.2 視覺模擬評分(VAS) 于術前及術后24 h進行評分,總分為10分,分數越高提示疼痛程度越明顯。
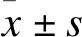
2 結果
2.1 兩組蘇醒時間、拔管時間、意識恢復時間比較 兩組蘇醒時間、拔管時間、意識恢復時間比較差異無統計學意義(P>0.05),見表2。

表1 兩組患者一般資料比較(例,%)
2.2 兩組手術前后血糖變化情況比較 術前,兩組血糖值比較差異無統計學意義(P>0.05);術后,兩組血糖值均上升,且研究組低于對照組(P<0.05),見表3。

表2 兩組患者蘇醒時間、拔管時間、意識恢復時間比較

表3 兩組患者手術前后血糖變化情況比較
2.3 兩組疼痛介質及VAS比較 術前,兩組疼痛介質及VAS比較差異無統計學意義(P>0.05);術后,研究組PGE2、SP及VAS低于對照組(P<0.05),β-EP高于對照組(P<0.05),見表4。
2.4 兩組不良反應比較 兩組均有頭暈、惡心嘔吐及瘙癢發生,組間不良反應發生率比較差異無統計學意義(P>0.05),見表5。
3 討論
下肢骨折為骨折的常見類型,近年來其發生率呈上升趨勢,常規保守治療需長時間制動,可影響局部組織腫脹的消退,降低骨折愈合能力,引起畸形愈合,影響肢體功能。切開復位內固定是下肢骨折的主要治療方式,可恢復骨折端的解剖關系,但疼痛較為強烈。超前鎮痛可起到痛覺傳導通路的超前保護作用,可有效減輕術后急性疼痛,減少術后鎮痛藥物的需求,預防慢性疼痛的產生[10-12]。阿片類藥物為既往超前鎮痛首選藥物,具有起效快、鎮痛時間長等特點,但其大劑量應用可出現多種不良反應,甚至導致藥物依賴[13]。
非甾體抗炎鎮痛藥在治療疼痛劑量范圍內無欣快感,不影響腦部覺醒機制及視覺,目前已廣泛應用于圍手術期疼痛治療中。氯諾昔康作為一種非甾體抗炎鎮痛藥,通過降低外周環氧合酶及前列腺素合成酶活性,抑制內源性炎性因子對痛覺神經的刺激,減少外周敏感化,起到鎮痛作用[14-15]。氯諾昔康能夠激活內源性阿片神經內啡肽系統,發揮中樞性鎮痛效應,且可避免出現阿片類藥物的鎮靜、呼吸抑制、依賴性等不良反應[16]。盡管氯諾昔康靜脈給藥后可起到穩定快速的鎮痛作用,但其起效前有一定潛伏期,無法拮抗已產生的前列腺素樣致痛物質,因此對于即時鎮痛的效果較弱[17]。手術刺激前給予氯諾昔康可減輕手術刺激的劇烈反應,降低中樞神經元興奮性,起到超前鎮痛作用[18]。本研究結果顯示,兩組蘇醒時間、拔管時間及意識恢復時間相似,說明其未影響患者蘇醒期質量。
骨折創傷及手術刺激能夠誘導多種疼痛介質的釋放,增加痛覺感受器敏感性,降低神經末梢痛閾,形成創傷后疼痛的高敏狀態[19]。PGE2是介導疼痛的重要物質,可誘導炎癥,促進局部血管擴張,增加毛細血管通透性,引起紅腫熱痛等表現[20]。其含量增加能夠直接導致疼痛或者增加神經根對緩激肽等物質的敏感性,降低神經根痛閾,從而導致疼痛[21]。PGE2可引起血管痙攣及組織水腫,刺激SP釋放。SP通過多種途徑參與疼痛及痛覺過敏的生成,是評估疼痛程度的客觀依據[22]。SP可刺激組胺及5-羥色胺釋放,促進神經纖維末梢釋放更多的SP,啟動惡性循環;SP又可擴張血管,增加血管通透性,產生強烈持久的通透反應及組織損傷。β-EP作為一種類阿片肽神經遞質,多來源于腎上腺、垂體、丘腦等組織,能夠調節傷害性感受器,其鎮痛作用較強,可抑制疼痛傳遞,避免PGE2、SP等疼痛介質的釋放[23]。本研究發現,術前兩組PGE2、SP及β-EP比較差異無統計學意義,術后患者PGE2、SP均上升,β-EP均下降,說明其發生了明顯的應激反應,但研究組變化幅度較小,分析原因可能為氯諾昔康可抑制COX-2表達,從而改善感覺神經纖維所致的傷害性刺激,減輕應激反應,起到抗炎鎮痛作用。

表4 兩組患者手術前后疼痛介質及VAS比較

表5 兩組患者不良反應比較(例,%)
創傷后,機體應激反應可促進生長激素及胰高血糖素分泌,導致胰島素分泌相對不足,增加糖異生,加大糖生成量,另一方面,胰島素作用又可出現胰島素抵抗,引起糖利用受損,從而形成高血糖[24]。機體血糖波動明顯時可加速細胞功能及形態的損傷,影響創傷修復。本研究結果顯示,術后兩組血糖均上升,但研究組血糖波動較小,可能因為氯諾昔康的鎮痛效果較好,降低了機體血糖波動幅度。頭暈、惡心嘔吐、皮膚瘙癢為臨床麻醉的常見不良反應,本結果顯示,兩組不良反應發生率比較差異無統計學意義,說明氯諾昔康超前鎮痛的安全性較高,未增加術后不良反應。
綜上所述,氯諾昔康超前鎮痛是一種安全有效的鎮痛方式,可降低術后疼痛介質及血糖的變化幅度,減輕下肢骨折患者術后疼痛。

