昆明山海棠-雞血藤藥對治療類風濕關節炎作用機制的網絡藥理學研究
劉丹凱 王強 魏賑權 劉小寶 鄭雪霞 錢凱 曾麗盈 許舒迪 林昌松

摘 要 目的:研究昆明山海棠-雞血藤藥對治療類風濕關節炎的作用機制。方法:通過檢索治療靶點數據庫(TTD)、藥物銀行(DrugBank)和DisGeNET數據庫獲取類風濕關節炎靶點,并構建靶點互作(PPI)網絡篩選關鍵靶點。以口服生物利用度(OB)≥30%、類藥性(DL)≥0.18、半衰期(HL)≥4 h為指標,借助中藥系統藥理學數據庫及分析平臺(TCMSP)和中藥綜合數據庫(TCMID)獲取昆明山海棠-雞血藤藥對的活性成分,并預測其靶點,構建昆明山海棠-雞血藤藥對活性成分-靶點網絡;借助Systems Dock Web Site在線平臺、Genomics平臺篩選昆明山海棠-雞血藤藥對的活性成分和類風濕關節炎的共有靶點,然后利用Cytoscape 3.2.1軟件中Cluego插件分析共有靶點的京都基因與基因組百科全書(KEGG)信號通路。結果:共檢索到類風濕關節炎靶點1 956個,其中關鍵靶點11個[包括白細胞介素6(IL-6)、腫瘤壞死因子(TNF)、血管內皮生長因子A(VEGFA)等];昆明山海棠-雞血藤藥對共篩選出30種活性成分(包括木犀草素、芒柄花黃素、β-谷甾醇、雷公藤甲素等)和229個靶點。昆明山海棠-雞血藤藥對和類風濕關節炎的共有靶點有37個[包括基質金屬蛋白2(MMP2)、 TNF、VEGFA等];參與的KEGG信號通路有細胞凋亡、IL-17信號通路、Th17細胞分化信號通路、TNF信號通路等。結論:昆明山海棠-雞血藤藥對可能通過MMP2、TNF、VEGFA等靶點作用于細胞凋亡、IL-17信號通路等多條信號通路發揮治療類風濕關節炎的作用,本研究結果可為進一步研究昆明山海棠-雞血藤藥對治療類風濕關節炎的作用機制提供參考。
關鍵詞 類風濕關節炎;昆明山海棠-雞血藤藥對;網絡藥理學;作用機制;信號通路
ABSTRACT OBJECTIVE: To study the mechanism of couplet medicine of Tripterygium hypoglaucum-Spatholobus suberectus in the treatment of rheumatoid arthritis (RA). METHODS: The RA targets were retrieved and obtained by therapeutic target database (TTD), DrugBank and DisGeNET databases, and the protein protein interaction (PPI) network was constructed to screen its key targets. Using oral bioavailability(OB)≥30%, drug like(DL)≥0.18 and drug half-life (HL) ≥4 h as index, active components were obtained from couplet medicine of T. hypoglaucum-S. suberectus by using TCM systematic pharmacological analysis platform (TCMSP) and TCM integrated database (TCMID), and the targets were predicted. The active component-target network of couplet medicine of T. hypoglaucum-S. suberectus was constructed. Systems Dock Web Site online platform and Genomics platform were used to screen the active component and common targets of RA of couplet medicine of T. hypoglaucum-S. suberectus; KEGG signaling pathways of common targets were analyzed by using Cluego plug-in unit of Cytoscape 3.2.1 software. RESULTS: Totally 1 956 RA targets were retrieved, involving 11 key targets [such as IL-6, TNF, VEGFA]. The couplet medicine contained 30 active components (including luteolin, erythroxanthin, β-sitosterol and triptolide) and 229 targets. There were 37 common targets for couplet medicine of T. hypoglaucum-S. suberectus and RA (including MMP2, TNF, VEGFA). KEGG signaling way involved cell apoptosis, IL-17 signaling pathway, Th17 cell differentiation pathway and TNF signaling pathway. CONCLUSIONS: The couplet medicine of T. hypoglaucum-S. suberectus may play a role in the treatment of RA by acting on cell apoptosis, IL-17 signaling pathway and other signaling pathways through MMP2, TNF, and VEGFA target. The results of this study can provide a reference for further study on the mechanism of the effects of couplet medicine of T. hypoglaucum-S. suberectus on RA.
KEYWORDS Rheumatoid arthritis; Couplet medicine of Tripterygium hypoglaucum-Spatholobus suberectus; Network pharmacology; Mechanism; Signaling pathways
類風濕關節炎(Rheumatoid arthritis,RA)是以侵蝕性、對稱性多關節炎為主要臨床表現的慢性、全身性自身免疫性疾病,基本病理改變是滑膜炎和血管炎,滑膜炎是關節表現的基礎,血管炎是關節外表現的基礎,可逐漸出現關節軟骨和骨破壞,最終導致關節畸形和功能喪失,其發病機制目前尚不明確;目前RA不能根治,其常用治療藥物可分為非甾體抗炎藥、抗風濕藥、糖皮質激素、植物藥和生物制劑等五大類[1]。其中,以中藥為主的植物藥不僅來源廣泛、種類豐富,而且具有多靶點、多途徑、多環節以及整體調節的特點,在治療RA方面有獨特的優勢[2-3]。
昆明山海棠為衛矛科雷公藤屬植物,具有祛風除濕、舒筋活絡、清熱解毒的作用[4]。現代藥理研究表明,昆明山海棠具有抗炎、免疫抑制、抗腫瘤、抗病毒等作用[5]。雞血藤為豆科植物密花豆的干燥藤莖,具有活血補血、調經止痛、舒筋活絡之功效[4]。現代藥理研究表明,雞血藤具有免疫調節、抗炎、抗氧化、促進造血、抗腫瘤、抗病毒等作用[6]。
我院風濕病科常用院內制劑昆藤通痹合劑(批準文號:粵藥制字Z20071157,舊名為二藤通痹合劑,主要成分為昆明山海棠和雞血藤)治療RA,臨床療效明顯。本課題組前期在觀察162例RA患者服用二藤通痹合劑后,發現其能有效改善患者的的晨僵時間、休息痛和壓痛關節數等臨床癥狀[7]。其聯合正清風痛寧緩釋片能有效改善活動期RA患者關節疼痛腫脹的癥狀,增強抗炎鎮痛的作用[8]。由于中藥及其復方具有“多成分、多途徑、多靶點”的特點,療效通常取決于其中有效成分群的綜合作用。網絡藥理學是基于“疾病-基因-靶點-藥物”相互作用網絡,系統綜合評價藥物對疾病網絡的干預,這與中藥及其方劑的多成分、多途徑、多靶點協同作用的原理相一致[9],故利用網絡藥理學有助于進一步探討昆明山海棠-雞血藤藥對治療RA的作用機制。
因此,本研究擬通過網絡藥理學對昆明山海棠-雞血藤藥對治療RA的活性成分、作用靶點、作用通路等進行研究,為其臨床應用及深入研究提供依據。
1 方法
1.1 RA靶點獲取及靶點蛋白互作(PPI)網絡構建
1.1.1 RA靶點獲取 以“Rheumatoid arthritis”為關鍵詞,通過檢索治療靶點數據庫(TTD)數據庫(網址為https://db.idrblab.org/ttd/)、藥物銀行(DrugBank)數據庫(網址為https://www.drugbank.ca/)、DisGeNET數據庫(網址為http://www.disgenet.org/)查詢RA相關靶點。由于靶點命名存在不規范及信息來源不同等現象,本研究使用Uniprot數據庫(網址為https://www.uniprot.org/)對靶點進行校正,并篩除重復項。
1.1.2 RA靶點PPI網絡構建 將RA靶點導入STRING 平臺(網址為https://string-db.org/)構建PPI網絡,將物種設置為“Homo sapiens”,其他參數保持默認設置,并使用Cytoscape 3.2.1軟件(網址為http://cytoscapeweb.cytoscape.org/)對PPI網絡進行分析,利用Network Analyzer分析節點度值和介度中心性。其中,度值反映與節點直接相連的節點數目,度值高的節點可能在網絡中起到橋梁的作用;介度中心性是網絡中經過某一節點的最短路徑數,介度中心性越大,該節點影響力越大[10]。本研究選取度值、介度中心性同時滿足排名前15的節點作為其關鍵靶點。
1.2 昆明山海棠-雞血藤藥對活性成分-靶點網絡的構建
1.2.1 昆明山海棠-雞血藤藥對活性成分和靶點獲取 以“昆明山海棠”為關鍵詞,通過檢索中藥綜合數據庫(TCMID,網址為http://183.129.215.33/tcmid/)獲取昆明山海棠的活性成分(由于TCMID數據庫檢索到的成分較少,故本研究將所有成分都納入分析);以“雞血藤”為關鍵詞,通過檢索中藥系統藥理學數據庫及分析平臺(TCMSP)數據庫(網址為http://lsp.nwsuaf.edu.cn/tcmsp.php) 獲取雞血藤的活性成分。根據藥動學特性(ADME)參數,利用口服生物利用度(OB)與類藥性(DL)及半衰期(HL)進行篩選,篩選標準是OB≥30%、DL≥0.18、HL≥4 h[11]。將獲得的活性成分通過DrugBank數據庫提取靶點,并在Uniprot數據庫進行靶點校正。為方便作圖,本研究將篩選出的成分以中藥名單詞首字母和兩個數字進行組合編碼。
1.2.2 昆明山海棠-雞血藤藥對的活性成分-靶點網絡 將昆明山海棠-雞血藤藥對的活性成分和靶點導入Cytoscape 3.2.1軟件構建昆明山海棠-雞血藤活性成分-靶點網絡,分析節點的度值和介度中心性,用于評價昆明山海棠-雞血藤藥對中活性成分的重要程度,本研究選取兩者同時滿足排名前10的節點作為昆明山海棠-雞血藤藥對的重要成分。
1.3 昆明山海棠-雞血藤藥對的重要成分-RA關鍵靶點的分子對接
將昆明山海棠-雞血藤藥對中的重要成分和RA關鍵靶點通過Systems Dock WebSite在線平臺(網址為http://systemsdock.unit.oist.jp/iddp/home/index)進行分子對接評估其結合活性,使用Docking Score評價中藥與靶點之間的結合活性,當Docking Score值>4.25表示分子與靶標具有一定的結合能力,>5.00表示結合能力較強,>7.00表示結合能力很強[12]。
1.4 昆明山海棠-雞血藤藥對與RA共有靶點篩選
將昆明山海棠-雞血藤藥對與RA靶點導入Genomics平臺(網址為http://bioinformatics.psb.ugent.be/webtools/Venn/)進行映射構建韋恩圖,取三者交集得到昆明山海棠-雞血藤藥對和RA的共有靶點。
1.5 共有靶點通路富集分析及昆明山海棠-雞血藤藥對的活性成分-靶點-KEGG通路網絡構建
將共有靶點導入Cytoscape 3.2.1軟件中的Clugo插件進行京都基因與基因組百科全書(KEGG)通路富集(P<0.05),結合相關文獻篩選與RA相關的通路,并將與RA相關的通路、活性成分和靶點導入Cytoscape 3.2.1軟件構建昆明山海棠-雞血藤藥對的活性成分-靶點- KEGG通路網絡進行可視化處理,從而更直觀地反映昆明山海棠-雞血藤的活性成分、靶點與通路之間的關系。
2 結果
2.1 RA靶點獲取與PPI網絡構建結果
本研究共篩選到1 956個RA靶點。通過STRING 平臺構建PPI網絡,并使用Cytoscape 3.2.1軟件進行分析。PPI網絡包含1 807個節點,61 986條邊,平均度值68.61,平均介度中心性0.52(本網絡介度中心性數值較小,結果是取lg對數后的值,下同)。選取度值、介度中心性同時滿足排名前15的節點作為其關鍵靶點,包括白細胞介素6(IL-6)、腫瘤壞死因子(TNF)、蘇氨酸激酶1(AKT1)、胰島素(INS)、甘油醛-3-磷酸脫氫酶(GAPDH)、細胞腫瘤抗原p53(TP53)、血清白蛋白(ALB)、血管內皮生長因子A(VEGFA)、信號轉導和轉錄激活因子3(STAT3)、表皮生長因子受體(EGFR)、絲裂原活化蛋白激酶3 (MAPK3)。RA的關鍵靶點見表1。
2.2 昆明山海棠-雞血藤藥對的活性成分-靶點網絡的構建結果
2.2.1 昆明山海棠-雞血藤藥對的活性成分和靶點的獲取 通過TCMSP和TCMID數據庫,昆明山海棠共納入10個成分;雞血藤共納入20個活性成分。將成分通過DrugBank數據庫預測靶點,并通過Uniprot數據庫校正并刪除重復項后,昆明山海棠納入93個靶點,雞血藤納入136個靶點。昆明山海棠-雞血藤藥對的活性成分見表2。
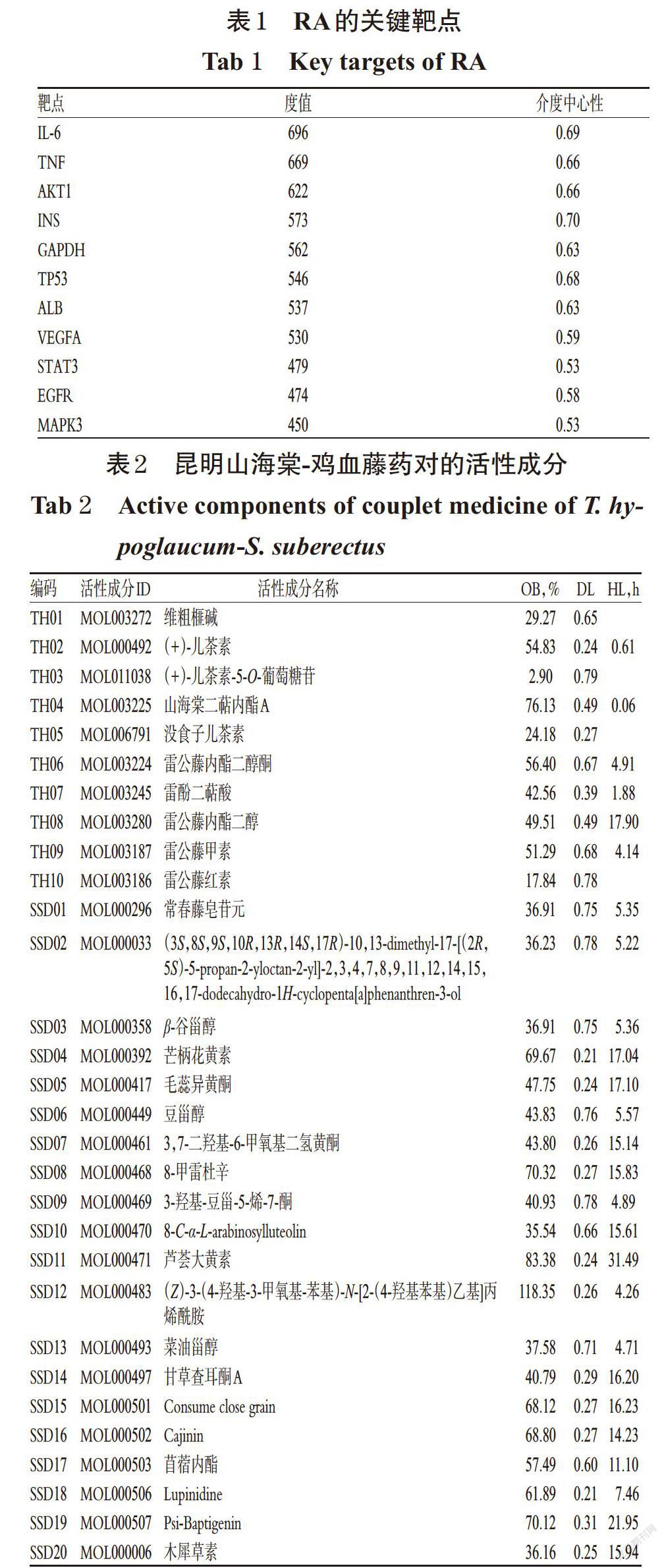
2.2.2 昆明山海棠-雞血藤藥對的活性成分-靶點網絡的構建 將昆明山海棠-雞血藤藥對的活性成分和靶點導入Cytoscape 3.2.1軟件構建昆明山海棠-雞血藤藥對活性成分-靶點網絡,詳見圖1。結果,昆明山海棠-雞血藤藥對活性成分-靶點網絡中共202個節點,503條邊,平均度值為4.91,平均介度中心性為0.01。其中,節點代表成分和靶點,邊代表節點之間的作用關系;度值越大,相應節點越大。選取度值、介度中心性同時滿足排名前10的節點作為昆明山海棠-雞血藤藥對的重要活性成分,其重要活性成分有木犀草素、芒柄花黃素、β-谷甾醇、雷公藤甲素,詳見表3。
2.3 昆明山海棠-雞血藤藥對的重要活性成分-RA關鍵靶點的分子對接結果
將昆明山海棠-雞血藤藥對的重要活性成分-RA關鍵靶點通過Systems Dock WebSite在線平臺進行分子對接,結果:昆明山海棠-雞血藤藥對中的雷公藤甲素、木犀草素和β-谷甾醇與RA關鍵靶點具有較強的結合能力。昆明山海棠-雞血藤藥對的重要活性成分-關鍵靶點的分子對接結果見表4。
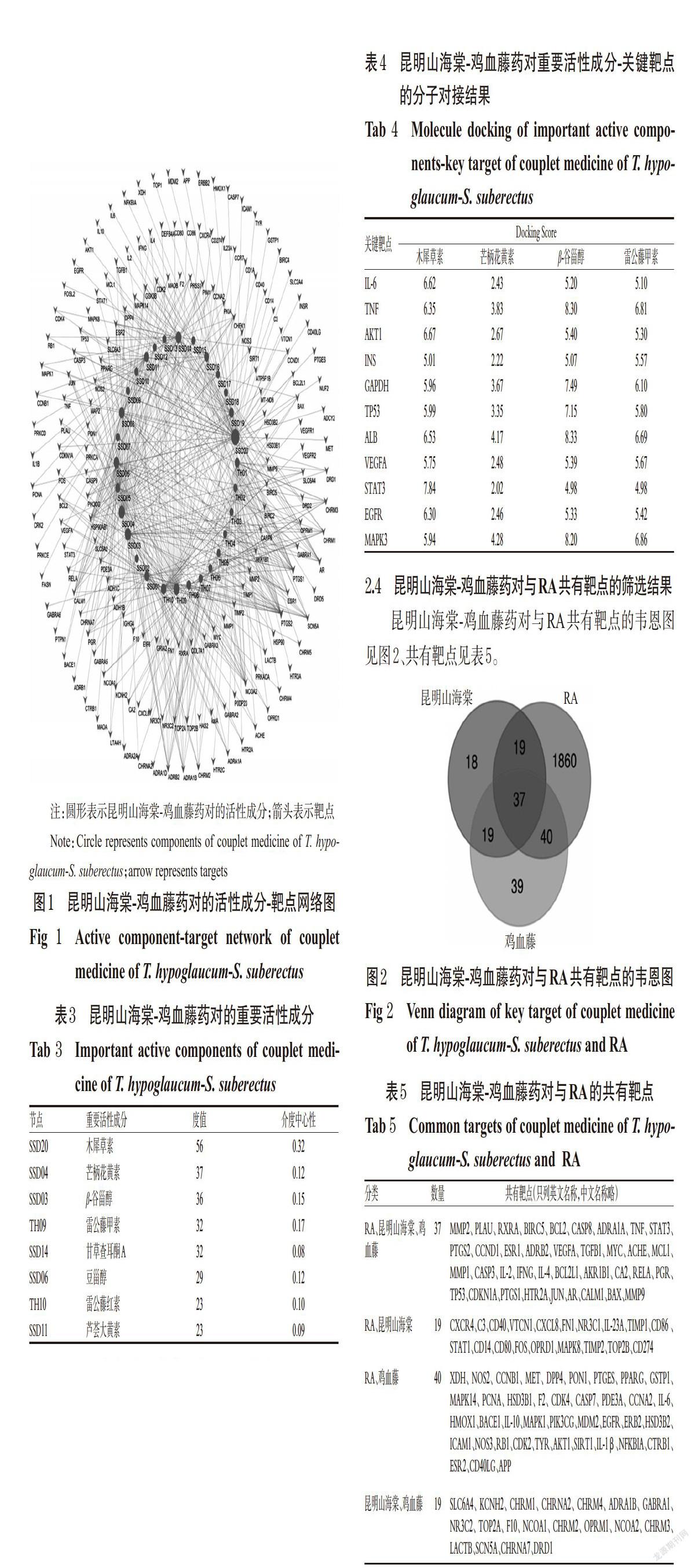
2.4 昆明山海棠-雞血藤藥對與RA共有靶點的篩選結果
昆明山海棠-雞血藤藥對與RA共有靶點的韋恩圖見圖2、共有靶點見表5。
2.5 共有靶點通路富集分析及昆明山海棠-雞血藤藥對的活性成分-靶點-KEGG通路網絡的構建結果
2.5.1 共有靶點通路富集結果 將37個共有靶點通過Cytoscape 3.2.1軟件中的Clugo插件進行KEGG通路富集,結果顯示,與RA相關的信號通路有細胞凋亡(Apoptosis)、IL-17信號通路(IL-17 signaling pathway)、Th17細胞分化(Th17 cell differentiation)、TNF信號通路(TNF signaling pathway)、p53信號通路(p53 signaling pathway)、類風濕關節炎相關通路(Rheumatoid arthritis related pathway)、核轉錄因子κB(NF-κB)信號通路(NF-kappa B signaling pathway)、T細胞受體信號通路(T cell receptor signaling pathway)、Th1和Th2細胞分化(Th1 and Th2 cell differentiation)、TGF-β信號通路(TGF-beta signaling pathway)。昆明山海棠-雞血藤藥對治療RA的KEGG信號通路見圖3。
2.5.2 昆明山海棠-雞血藤藥對的活性成分-靶點-KEGG通路網絡圖的構建結果 為了直觀地反映昆明山海棠-雞血藤藥對的活性成分、靶點與KEGG通路之間的關系,本研究將相關數據導入Cytoscape 3.2.1軟件構建昆明山海棠-雞血藤藥對的活性成分-靶點-KEGG通路網絡,詳見圖4。
由圖4可知,昆明山海棠-雞血藤藥對中分別有23、7、12和23種活性成分作用于IL-17信號通路、細胞凋亡通路、Th17細胞分化通路和TNF信號通路(即P值最小和靶點數量最多的前4條通路)。其中作用于IL-17信號通路和TNF信號通路的活性成分最多且成分一致。表明,昆明山海棠-雞血藤藥對的活性成分很可能通過作用于多條信號通路尤其是IL-17信號通路和TNF信號通路發揮治療RA的作用。
3 討論
根據分子對接結果可知,昆明山海棠-雞血藤藥對發揮作用的主要成分可能為雷公藤甲素、木犀草素和β-谷甾醇。相關研究發現,雷公藤甲素對RA患者體外培養的成纖維滑膜細胞具有一定的增殖抑制并能誘導其凋亡的作用[13];木犀草素具有抗炎、抗氧化、抗腫瘤和免疫雙向調節等作用[14];β-谷甾醇是植物甾醇的重要組成成分,具有抗炎、調節人體甾體激素、抗氧化、抗腫瘤等作用[15]。因此,雷公藤甲素、木犀草素和β-谷甾醇很可能是該藥對治療RA的有效成分。
根據RA關鍵靶點和共有靶點分析,昆明山海棠-雞血藤藥對作用的關鍵靶點可能為TNF、TP53、VEGFA、STAT3。相關研究表明,TNF-α通過抑制骨膠原合成、刺激成纖維細胞和軟骨細胞產生前列腺素和膠原酶、刺激軟骨細胞分泌金屬蛋白酶、誘導外周血單核細胞分化為破骨細胞等途徑,促進軟骨破壞,加重炎性反應[16]。另有研究發現,RA滑膜襯里層VEGF蛋白表達與血管形態、彎曲血管走行方式及血管密度均呈正相關[17]。STAT3可誘導基質細胞RANKL表達的能力,加劇RA骨侵蝕,而沉默STAT3能明顯抑制成纖維樣滑膜細胞的增殖[18-19]。TP53在腫瘤的發生、增殖與轉移有一定的作用[20]。故昆明山海棠-雞血藤藥對很可能通過調節TNF、VEGFA和STAT3靶點治療RA。
KEGG通路富集分析結果顯示,昆明山海棠-雞血藤藥對可能通過作用于細胞凋亡、IL-17信號通路、Th17細胞分化和TNF信號通路等通路發揮治療作用。相關研究表明,IL-17信號通路可通過誘導滑膜細胞、軟骨和骨細胞分泌的促炎癥細胞因子,促進成纖維細胞、內皮細胞等分泌IL-6、IL-8[21-22]。Th17細胞介導炎癥反應并在自身免疫性疾病中發揮重要的作用,IL-17為Th17細胞的主要效應因子[23]。RA患者外周血CD4+T淋巴細胞凋亡減少,CD4+T淋巴細胞作為效應T淋巴細胞的重要成分,可參與免疫應答過程中的各個階段,是RA浸潤的炎細胞[24]。因此,細胞凋亡、IL-17信號通路、Th17細胞分化和TNF信號通路等通路很可能是昆明山海棠-雞血藤藥對治療RA的潛在信號通路。
綜上所述,本研究采用網絡藥理學對昆明山海棠-雞血藤藥對活性成分、作用靶點、作用通路進一步探討,發現昆明山海棠和雞血藤藥對中的雷公藤甲素、木犀草素和β-谷甾醇等成分很可能通過TNF、VEGFA和STAT3等靶點作用于細胞凋亡、IL-17信號通路、Th17細胞分化和TNF信號通路等多條信號通路發揮作用。因此,昆明山海棠-雞血藤藥對治療RA的藥理學機制很可能是通過多組分、多靶點、多通路實現的。但由于數據庫中納入的信息可能來源于不同的試驗條件,偏向于對熱點領域的研究等局限性,且中藥在煎煮過程中可能生成或破壞某些成分,故納入分析的成分不一定能反映其實際作用于人體的成分。因此,本研究可為下一步研究提供參考,但昆明山海棠-雞血藤藥對治療RA復雜的機制還有待進一步試驗驗證。
參考文獻
[ 1 ] 葛均波,徐永健.內科學[M]. 8版.北京:人民衛生出版社,2013:808.
[ 2 ] 胡長玲,林兵,鄭承劍,等.抗類風濕關節炎的天然藥物及其作用機制研究進展[J].中草藥,2011,42(7):1435- 1440.
[ 3 ] 張靖,周彬,王彥麗,等.抗類風濕關節炎中藥的研究進展[J].中草藥,2013,44(15):2189-2194.
[ 4 ] 國家藥典委員會.中華人民共和國藥典:一部[S]. 2015年版.北京:中國醫藥科技出版社,2015:194,1056.
[ 5 ] 謝晨瓊,周萍,李祥,等.昆明山海棠化學成分及藥理作用和臨床應用研究進展[J].中草藥,2015,46(13):1996- 2010.
[ 6 ] 秦建鮮,黃鎖義.雞血藤藥理作用的研究進展[J].時珍國醫國藥,2014,25(1):180-183.
[ 7 ] 劉曉玲,陳紀藩,鄧健,等.二藤通痹合劑治療類風濕關節炎162例療效觀察[J].中藥新藥與臨床藥理,2005,16(4):294-295.
[ 8 ] 林昌松,姬森國,徐強,等.二藤通痹合劑聯合正清風痛寧緩釋片治療類風濕關節炎療效觀察[J].遼寧中醫雜志,2010,37(12):2308-2310.
[ 9 ] 張彥瓊,李梢.網絡藥理學與中醫藥現代研究的若干進展[J].中國藥理學與毒理學雜志,2015,29(6):883-892.
[10] 周文霞,王同興,程肖蕊,等.網絡藥理學研究中的網絡分析技術[J].國際藥學研究雜志,2016,43(3):399-409.
[11] 陳娟,顧俊菲,汪春飛,等.組分結構中藥與網絡藥理學:病理機制網絡的系統整體調控[J].中國中藥雜志,2015,40(4):758-764.
[12] HSIN KY,GHOSH S,KITANO H. Combining machine learning systems and multiple docking simulation packages to improve docking predictionreliability for network pharmacology[J]. PLoS One,2013,8(12):e83922.
[13] 葉蕾,賈霜,潘文萍.雷公藤甲素對類風濕關節炎患者滑膜成纖維樣細胞增殖的體外抑制作用研究[J].中國藥房,2015,26(31):4357-4359.
[14] 楊穎,宋曙輝,徐桂花.黃酮類化合物木犀草素研究進展[J].糧食與油脂,2009(9):45-47.
[15] 任建敏.食物中植物甾醇生理活性及藥理作用研究進展[J].食品工業科技,2015,36(22):389-393,399.
[16] 石慧,王丹彤,烏日嘎,等. TNF-α介導的NF-κB信號通路在類風濕關節炎血管形成中的作用[J].醫學綜述,2012,18(15):2397-2400.
[17] 趙綿松,夏蓉暉,王玉華,等.骨關節炎與類風濕關節炎患者膝關節滑膜中血管內皮生長因子及血管形態的特征[J].北京大學學報(醫學版),2012,44(6):927-931.
[18] BISHOP KA,MEYER MB. A novel distal enhancer mediates cytokine induction of mouse RANKl gene expression[J]. Mol Endocrinol,2009,23(12):2095-2110.
[19] GAO W,MCCORMICK J,CONNOLLY M,et al. Hypoxia and STAT3 signalling interactions regulate pro-inflammatory pathways in rheumatoid arthritis[J]. Ann Rheum Dis,2015,74(6):1275-1283.
[20] 張騰, 袁梅, 俞同福.腫瘤中TP53誘導的糖酵解和凋亡調節因子及其靶向治療研究進展[J].腫瘤,2016,36(12):1383-1388.
[21] KOTAKE S, YAGO T, KAWAMOTO M, et al. Role of osteoclasts and interleukin-17 in the pathogenesis of rheumatoid arthritis crucial human osteoclastology[J]. J Bone Miner Metab,2012,30(2):125-135.
[22] 余黃合,魏艷霞,林也,等. IL-23/IL-17炎癥軸在類風濕關節炎發病機制中的研究進展[J].中國醫藥導報,2016,13(31):37-41.
[23] 王晨宇,王星,王琳,等. Th17細胞分化調節機制及與自身免疫性疾病關系研究進展[J].細胞與分子免疫學雜志,2014,30(6):660-662.
[24] 曹永賀,劉健.類風濕關節炎患者外周血CD4+T細胞存在凋亡缺陷[J].細胞與分子免疫學雜志,2015,31(5):682- 685,688.
(收稿日期:2019-04-20 修回日期:2019-07-10)
(編輯:唐曉蓮)

