NSCLC腫瘤及癌旁組織CD4+和CD8+T細胞PD- 1的表達及意義
袁 飛,王新樂,張 燦,吳顯寧,徐美青
程序性死亡分子- 1(programmed death- 1,PD- 1)為B7家族新成員[1- 2],常表達于活化的T細胞、B細胞等表面。PD- L1為其配體之一,是由CD274基因編碼的CD28/CTLA4家族的免疫抑制蛋白。PD- 1與腫瘤表面的PD- L1結合后,既可抑制T細胞活化信號,也可向激活的T細胞傳導抑制信號,達到抑制T細胞殺傷功能的目的,從而在腫瘤的免疫逃逸中發揮重要作用[3- 4]。腫瘤抗原特異性T細胞無反應性及誘導凋亡是腫瘤免疫逃逸的主要機制,促進腫瘤的發生發展[5]。阻斷PD- 1和PD- L1的結合可部分恢復T細胞功能,抗PD- 1/PD- L1單克隆抗體在多種腫瘤的治療中也已顯示出巨大優勢,這使PD- 1/PD- L1信號通路的研究成為近年熱點。該研究采用流式細胞技術分析檢測79例非小細胞肺癌(non- small cell lung cancer,NSCLC)患者腫瘤組織和癌旁組織CD4+T細胞及CD8+T細胞表面PD- 1的表達水平,并分析其與患者臨床病理特征的相關性,以期為肺癌的研究提供一定的參考依據。
1 材料與方法
1.1 病例資料選取2017年8月~2018年6月在安徽省立醫院接受手術的NSCLC患者79例,其中男56例,女23例,年齡38~82(66.01±9.72)歲。均經術后病理檢查證實。病理類型腺癌46例,鱗癌33例;腫瘤直徑≤3 cm患者42例,>3 cm患者37例;病理分期I/II期56例,III期23例;有淋巴結轉移29例,無淋巴結轉移50例。患者均接受標準肺癌根治性手術;有完整臨床資料;術前均未進行抗腫瘤治療。取79例患者的肺癌腫瘤組織及對應的78例患者的腫瘤遠端2 cm以上癌旁組織(其中1例癌旁組織標本損壞)待測。
1.2 儀器和試劑Attune NxT 流式細胞儀購自美國ThermoFisher公司;腫瘤消化儀、腫瘤消化試劑盒(貨號:130- 095- 929)購自德國Milteny公司;紅細胞裂解液(貨號:R7757)購自美國Sigma公司;死活細胞鑒定染料(Fixable Viability Stain 780,FVS780,貨號:565388)、Fc受體阻斷劑(Human BD Fc Block,貨號:564219)、流式緩沖液(Brilliant stain buffer,貨號:563794)、轉錄因子和核蛋白試劑(Transcription Factor Buffer Set,貨號:562574)購自美國BD公司。
1.3 方法
1.3.1腫瘤樣本的處理 ① 手術采集的腫瘤樣本稱重、記錄;② 根據腫瘤消化試劑盒的說明書操作,將腫瘤組織消化分解成單個細胞懸液;細胞懸液用70 μm濾網過濾后洗滌,1 400 r/min離心10 min,棄上清液;③ 加入紅細胞裂解液(5 ml/g腫瘤)室溫裂解紅細胞3~5 min,用含血清培養基終止裂解紅細胞;加入PBS充分洗滌及離心,棄上清液。
1.3.2流式染色 ① 加入培養基重懸細胞后用臺盼藍染色計數,記錄細胞密度與活力;② 根據染色方案,每孔轉移1×106個細胞入96孔V底板;③ 加入PBS充分洗滌及離心,棄上清液;④ 死活染料FVS780用PBS 1 ∶1 000稀釋后每孔加入100 μl,室溫避光放置10~15 min;加入PBS充分洗滌2次,4 ℃、1 400 r/min離心5 min,棄上清液;⑤ Fc受體阻斷劑用流式緩沖液1 ∶200稀釋后每孔加入100 μl,4 ℃避光孵育20 min;加入流式緩沖液充分洗滌及離心,棄上清液;⑥ 每孔100 μl加入對應的抗體混合物進行細胞膜染,4 ℃避光孵育40 min;加入流式緩沖液充分洗滌及離心,棄上清液;⑦ 根據染色方案,需要核內染色的樣品孔用轉錄因子和核蛋白試劑進行固定、破膜與染色。加入破膜緩沖液充分洗滌及離心,棄上清液。最后加入流式緩沖液充分洗滌及離心,棄上清液;⑧ 細胞用4%多聚甲醛固定,4 ℃避光孵育30 min;加入流式緩沖液充分洗滌及離心,棄上清液;⑨ 每孔細胞加入200 μl流式緩沖液重懸,4 ℃避光儲存,上流式機檢測。

2 結果
2.1 NSCLC患者腫瘤組織與癌旁組織PD- 1+細胞及CD4+T細胞、CD8+T細胞表達水平比較腫瘤組織PD- 1+細胞占所有細胞百分比顯著高于癌旁組織(P<0.01)。腫瘤組織CD4+T細胞、CD8+T細胞占腫瘤浸潤淋巴細胞百分比均顯著高于癌旁組織(P<0.01),見表1。


項目腫瘤組織癌旁組織t值P值PD-1+細胞(%)4.80±4.101.47±2.036.463<0.01CD4+T細胞(%)24.13±11.8711.94±8.137.514<0.01CD8+T細胞(%)15.25±8.9710.98±7.493.236<0.01
2.2 NSCLC患者腫瘤組織與癌旁組織CD4+和CD8+T細胞上PD- 1表達水平的比較腫瘤組織CD4+T細胞PD- 1表達水平顯著高于癌旁組織(P<0.01)。腫瘤組織CD8+T細胞PD- 1表達水平較癌旁組織也顯著增高(P<0.01),見表2、圖1、2。

表2 PD- 1在腫瘤及癌旁組織T細胞表達水平比較
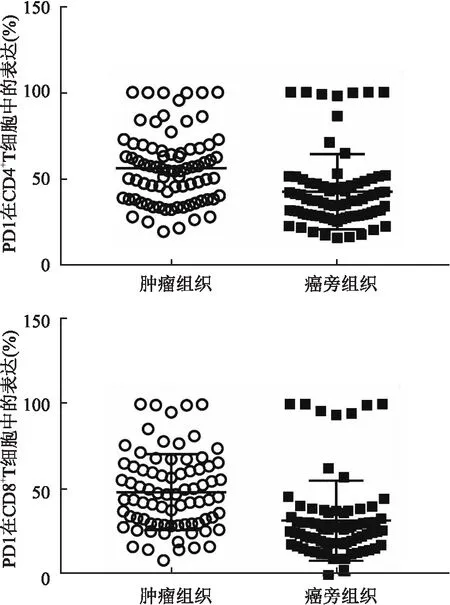
圖1 PD- 1在腫瘤及癌旁組織T細胞表達水平散點圖
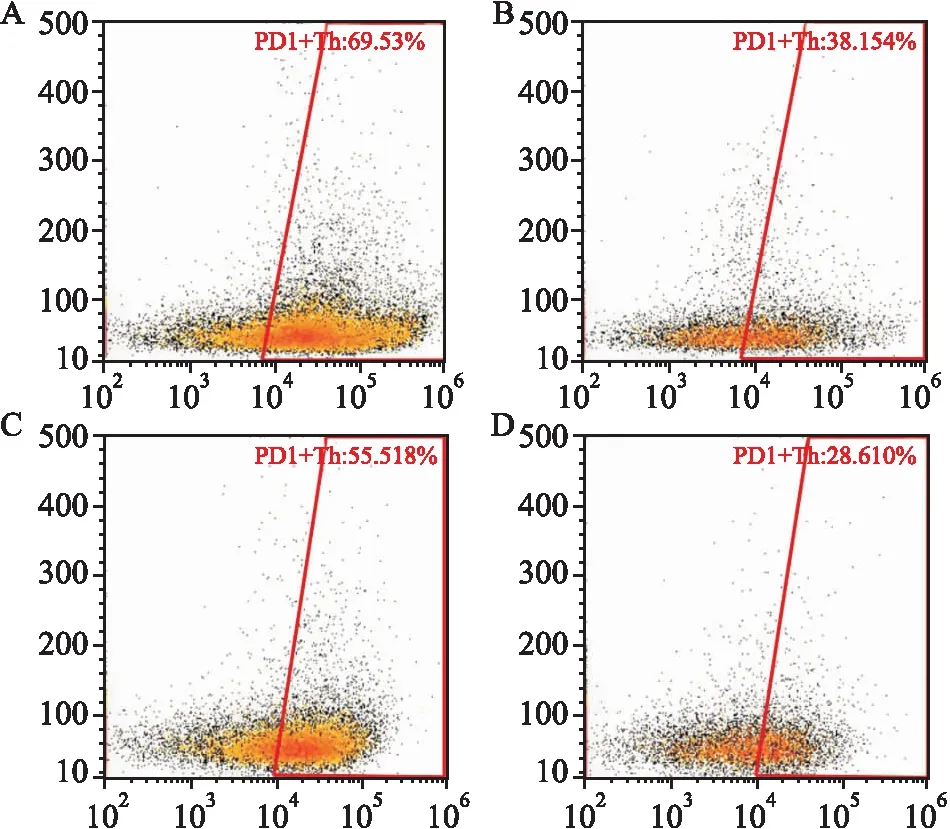
圖2 PD- 1在腫瘤及癌旁組織T細胞表達水平流式細胞檢測圖
A:腫瘤組織CD4+T細胞中PD- 1表達情況;B:癌旁組織CD4+T細胞中PD- 1表達情況;C:腫瘤組織CD8+T細胞中PD- 1表達情況;D:癌旁組織CD8+T細胞中PD- 1表達情況
2.3 不同臨床病理特征的NSCLC患者腫瘤組織CD4+和CD8+T細胞表面PD- 1表達水平的比較PD- 1在腫瘤組織中CD4+和CD8+T細胞的表達與性別、年齡、分期、有無淋巴結轉移無關,差異無統計學意義(P>0.05)。PD- 1在腫瘤組織CD4+T細胞表達與肺癌病理類型無關,差異無統計學意義(P>0.05),PD- 1在腫瘤組織CD8+T細胞表達與病理類型有關,差異有統計學意義(P<0.05)。PD- 1在腫瘤組織中CD4+和CD8+T細胞的表達與腫瘤大小有關,差異有統計學意義(P<0.05),見表3。

表3 腫瘤組織PD- 1表達水平與臨床病理參數關系
3 討論
NSCLC占原發性肺癌的85%以上[6],且發病率逐年上升,其發病原因與吸煙、環境污染、遺傳等因素有關,但肺癌發生發展的機制目前仍不十分清楚。
惡性腫瘤的發生發展是多因素參與的復雜過程,腫瘤免疫抑制是其中重要一環,PD- 1與配體的結合在正常情況下可抑制自身免疫應答從而避免自身免疫性疾病的發生,當惡性腫瘤患者PD- 1表達水平升高并與其配體結合后可營造高度免疫抑制的腫瘤微環境,削弱機體的免疫應答,并可分泌抑制性分子,同時介導負性共刺激信號達到免疫逃逸目的[7],從而促進腫瘤的發生發展。近年來有研究顯示,在一些惡性腫瘤組織中,PD- 1表達明顯高于相對應的癌旁組織,惡性腫瘤患者外周血PD- 1較健康人表達也明顯升高,提示了PD- 1在惡性腫瘤的發生發展中可能起重要作用。呂淑貞 等[8]對93例乳腺癌腫瘤組織標本PD- 1的表達進行檢測,并對生存期進行隨訪,結果表明,PD- 1在癌組織中表達陽性率明顯高于癌旁組織,且PD- 1陽性表達患者術后生存時間低于PD- 1陰性患者,表明PD- 1高表達可能與乳腺癌的發生發展及不良預后有關。張峰 等[9]報道食管癌組織中PD- 1陽性表達率高于癌旁組織,PD- 1陽性表達率與腫瘤大小、淋巴轉移有關。針對于NSCLC,采取外周血并應用免疫組化法檢測患者CD4+和CD8+T細胞PD- 1表達水平的研究有相關文獻報道,其結果與乳腺癌、食管癌等研究結果基本一致[10],但應用流式細胞術直接檢測肺癌腫瘤標本的研究較少,相對于外周血檢測,本研究能夠更加直接的反映腫瘤微環境中的狀態,結果顯示,NSCLC患者腫瘤組織CD4+T細胞和CD8+T細胞上PD- 1表達水平顯著高于癌旁組織,表明腫瘤可能通過誘導PD- 1高表達抑制腫瘤組織的CD4+T細胞和CD8+T細胞的功能,營造低免疫狀態的腫瘤微環境,從而有利于腫瘤的發生發展。本研究同時發現腫瘤>3 cm患者PD- 1表達水平顯著高于腫瘤≤3 cm患者,關于腫瘤大小與PD- 1的關系,Huang et al[11]相關研究表明,盡管PD- 1療法在人類黑色素瘤中取得了成功,但是部分患者沒有明顯獲益,這些患者的治療失敗不僅僅是不能誘導免疫恢復,而是由于T細胞恢復和腫瘤負擔之間的不平衡。與治療前腫瘤負擔相關的循環CD8+T細胞再生程度與臨床反應相關,結合本研究表明,腫瘤大小影響PD- 1表達水平,同時亦是影響PD- 1抗體免疫治療效果的因素之一。另外,本研究發現肺鱗癌CD8+T細胞表面PD- 1表達高于肺腺癌,而在CD4+T細胞上的表達與病理類型無關,提示肺鱗癌細胞對于直接殺傷腫瘤的細胞毒性T細胞即CD8+T細胞的抑制強于肺腺癌,目前,相關研究報道不多,進一步的探索或許對于免疫治療有一定參考價值。PD- 1表達水平與性別、年齡、分期及淋巴結轉移無關。
綜上所述,PD- 1在NSCLC患者腫瘤組織T細胞表面高表達,參與腫瘤的免疫逃逸,促進腫瘤的發生發展,其與腫瘤大小等臨床因素有關,這些可能為肺癌的研究提供一定的參考依據。

