腎透明細胞癌胰腺轉移2例報道并文獻復習
張子敏,王耀申,楊 孟,彭衛軍
復旦大學附屬腫瘤醫院放射診斷科,復旦大學上海醫學院腫瘤學系,上海 200032
1 資 料
患者1:患者,女性,63歲,2016年3月因體檢時CT檢查發現胰腺占位性病變于復旦大學附屬腫瘤醫院就診。患者無異常癥狀,體格檢查無特殊所見。2001年6月患者因右腎惡性腫瘤行右腎切除術,具體病理學檢查結果不明。實驗室檢查:CA15-3為30.31 U/mL(正常范圍0~25 U/mL)。影像學檢查:胰頭和尾部多發稍低密度圓形或卵圓形結節、腫塊;動脈期病灶實性部分呈明顯強化,靜脈期強化減低;較大的兩枚病灶內可見囊變壞死區,最小者無明顯囊變壞死,病灶邊界尚清晰,邊緣尚光整,大小分別約51 mm×31 mm、27 mm×27 mm、15 mm×14 mm;胰管稍擴張(圖1)。手術及病理學檢查結果:患者于2017年3月行胰腺全切術、膽囊管肝總管成形術、脾臟切除術及后腹膜淋巴結清掃術,所掃除淋巴結無轉移,組織學類型為腎透明細胞癌(clear cell renal cell carcinoma,ccRCC)。免疫組織化學:CA9(+),CD10(+),Ki-67(+,10%),PAX8(+),Vimentin(+),p504s(-),CK(-)。結合病史、組織學及免疫組織化學結果,該患者考慮為腎透明細胞癌胰腺轉移瘤(pancreatic metastases from clear cell renal carcinoma,PM-ccRCC)。
患者2:患者,男性,60歲,2016年6月因體檢時CT檢查發現胰腺占位性病變于復旦大學附屬腫瘤醫院就診。患者未見異常癥狀,體格檢查無特殊所見。2004年8月因左腎惡性腫瘤行手術治療,手術病理學檢查結果為ccRCC。實驗室檢查:未見異常腫瘤標志物。影像學檢查:胰腺體部見稍低密度卵圓形結節;動脈期病灶實性部分呈明顯強化,靜脈期強化減低;內可見囊變壞死區,邊界清晰,邊緣光整,大小約21 mm×15 mm;胰管未見擴張(圖2)。手術及病理學檢查結果:患者于2016年6月行腹腔鏡胰體尾切除術、脾切除術、后腹膜淋巴結清掃術及胰腺修補術,組織學類型為ccRCC,所掃除淋巴結無轉移。免疫組織化學:AE1/AE3(+),CA9(+),CD10(+),CHROMOGRANIN A(-),PA X 8(欠佳),PA X 2(+),HMB45(-),S-100(單抗)(-),SSRT2(+),SYNAPTOPHYSIN(-),Vimentin(+),p504s(-),CK(-),Ki-67(+,5%~10%)。結合病史、組織學及免疫組織化學結果,該患者考慮為PM-ccRCC。
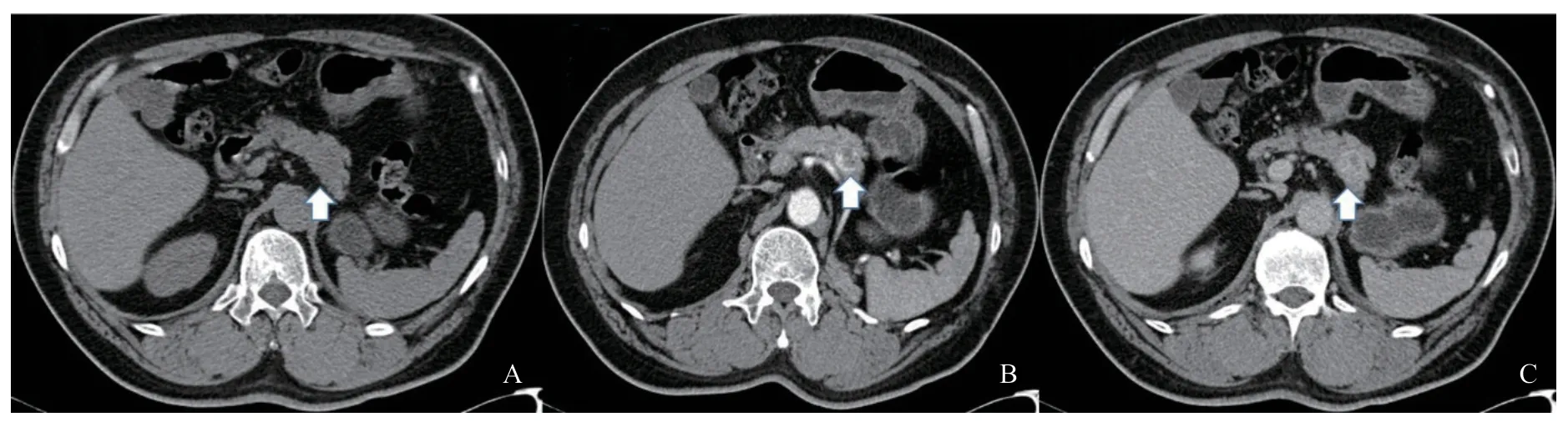
圖 2 患者2影像學檢查圖像
2 討 論
胰腺轉移性腫瘤比較罕見,僅占胰腺腫瘤的2%~5%[1],其中以腎細胞癌來源較為多見,約占胰腺轉移性腫瘤的一半[2-3]。腎細胞癌轉移部位主要為淋巴結、肺、骨及肝等,僅1%~2%轉移至胰腺,并且以ccRCC為主[1-4]。本文報道的2例患者均為ccRCC轉移至胰腺。約50%的PMccRCC患者就診時無明顯不適癥狀[5],與本研究相符。少部分患者可出現一些不典型癥狀,如上腹部不適、腹痛及食欲減退等。極少部分患者因病灶累及到十二指腸、膽總管而出現上消化道出血、阻塞性黃疸。若病灶阻塞胰管,可出現胰腺炎癥狀。因此,腎細胞癌胰腺轉移病灶往往因體檢發現,且大多發生在腎癌治療數年之后,腎細胞癌術后至胰腺發現腎細胞癌轉移灶的中位間隔時間為93.6個月[3],有文獻[6]報道,PM-ccRCC可以發生在腎細胞癌切除術后的32.7年。腎細胞癌轉移至胰腺的機制尚不明確,有文獻[7]報道可能為兩種途徑:① 血行轉移,腎靜脈瘤栓經過引流靜脈轉移至胰腺;② 淋巴轉移,腫瘤侵犯腹膜后淋巴結,然后經淋巴系統逆行轉移至胰腺。腎細胞癌胰腺轉移的具體機制仍需進一步研究。另外,PM-ccRCC患者并無特異性的實驗室檢查指標[5]。
影像學檢查對PM-ccRCC有一定的提示價值。病灶可位于胰腺任何部位,可單發、多發[5]。在超聲圖像上主要表現為胰腺探及低回聲腫塊,邊界清晰,形態規則,邊緣光整,彩色多普勒血流顯像顯示腫塊內血流信號豐富,病灶主體部位通常位于胰腺輪廓之內。在CT圖像上病灶主要表現為圓形、卵圓形腫塊影[8-10],大多數病灶在平掃CT圖像上呈稍低密度影,動脈期呈明顯強化,靜脈期強化減退,強化模式與ccRCC相似。有文獻[11]報道,一些PM-ccRCC患者在動脈期呈相對明顯的強化,病灶內可見囊變壞死區,密度較實性部分更低,且主體部位位于胰腺輪廓之內,有少部分患者胰管可稍擴張。在磁共振(magnetic resonance,MR)掃描上,PM-ccRCC表現為T1低信號、T2高信號,病灶較大時,內部可出現囊變壞死區,實性部分的強化模式與CT相同,呈“快進快出”表現[12]。另外,在MR化學移位成像上,因成熟脂肪的存在,PM-ccRCC在反相位上可出現信號減低。在擴散加權成像(diffusion weighted imaging,DWI)上,PM-ccRCC因病灶內水分子擴散受限而表現出高信號。DWI及化學移位成像上PMccRCC的表現可能具有一定的特征性。
腎細胞癌切除多年后,胰腺可以作為腎細胞癌唯一的轉移點,并且呈富血供表現,因此影像學上PM-ccRCC需要與胰腺神經內分泌腫瘤(pancreatic neuroendocrine tumour,PNET)[10,13-15]相簽到。在平掃CT圖像上,大多數的PNET表現為稍低密度、邊緣清晰的腫塊,增強后腫塊呈明顯強化。PNET可分為功能性與非功能性兩種,功能性PNET較小,且臨床上往往有激素相關性的癥狀,而非功能性PNET病灶較大,多在5 cm以上,內部可出現囊變壞死區,臨床上并無此激素相關性癥狀。在MR圖像上,PNET實性部分在TIWI上呈低或稍低信號,在T2WI上大部分呈高信號,少部分可呈稍低信號,強化模式與CT相同。對于分化低的PNET來說,DWI表現為高信號。因此,PNET與PMccRCC難以鑒別。然而,有研究表明二者之間影像上仍然存在一些差異,與PM-ccRCC相比,PNET相對較大、實性部分比例更高、內可見鈣化、胰管擴張更多見[9]。另外,采用MR化學移位成像方法掃描,PM-ccRCC在反相位上可出現信號減低,而PNEN信號減低并不明顯[14]。
PM-ccRCC確診依賴于病理學檢查,因此超聲引導下的穿刺是較為準確的診斷手段。但穿刺所取的組織有限,有出現誤診的可能。診斷的金標準依然是手術后病理學檢查結果,對于難以確定的病灶,需要加做免疫組織化學檢查。在顯微鏡下,PM-ccRCC表現為透明的嗜酸性胞質為特征的腫瘤細胞,伴有質脆的腫瘤血管網和多發的出血點,這與ccRCC顯微鏡下的表現相似。免疫組織化學以PAX8(+)、SYNAPTOPHYSIN(-)、CK(-)等為特征[16]。
對于PM-ccRCC來說,目前尚無標準的治療方案。有研究推薦手術切除方案[2],但Santoni等[17]的研究表明,手術治療與采用酪氨酸激酶抑制劑行靶向治療的方案相比,患者的預后無明顯的差異性。Mekhail等[18]推薦使用Memorial Sloan-Kettering預測因素模型來指導腎細胞癌轉移的治療,但尚需更多的研究來證實。相比于其他來源的胰腺轉移瘤,腎細胞癌來源的患者具有更好的預后[3]。
綜上,PM-ccRCC是一種預后較好的疾病,對于可手術的患者來說,推薦采用手術治療,對于無法手術或不接受手術的患者,靶向治療也是一種合理有效的治療手段。在得知ccRCC病史的情況下,影像學檢查對其有一定的提示價值,確診仍然依賴于手術切除標本的病理學檢查。

