臍帶間充質干細胞對急性卵巢缺血再灌注損傷小鼠卵巢組織內血管內皮生長因子及腫瘤壞死因子-α的影響
鄒曉萍,葉豪奕,回月彤,商崇智,董化江,王 磊,徐 健※
(1.中國人民武裝警察部隊特色醫學中心 a.婦產科,b.神經外科,天津 300161; 2.中國人民武裝警察部隊后勤學院,天津 300189;3.中國醫學科學院 北京協和醫學院生物醫學工程研究所,天津 300192)
卵巢扭轉為女性臨床的常見病癥,如處理不及時可出現卵巢梗死或卵巢破裂,臨床可見于劇烈運動后、血管外腫瘤的壓迫,腸扭轉、腸套疊、嵌頓疝時腸系膜靜脈和動脈受壓等情況。恢復血流灌注是有效的治療方法[1-2]。但扭轉的卵巢恢復正常解剖位置后,重獲血供的卵巢組織損傷程度比單純缺血狀態更為嚴重[3-5]。對于卵巢恢復血供后的再灌注損傷頗為棘手,尚無特效措施。通常給予患者對癥支持及抗炎治療,但往往給患者留下一定的后遺癥,甚至導致不孕,因此需引起高度重視。近年來,干細胞在臨床中的應用取得了長足進步,在很多疑難雜癥的治療上顯示出相當優勢,治療效果明顯[6-8]。不同學者對干細胞的治療機制持有不同的態度,目前干細胞發揮治療效用的主要作用機制有細胞替代和干細胞的分泌或代謝“副產品”的“偽旁觀者效應”[9]。本研究選用細胞更為原始,且采用比骨髓間充質干細胞和脂肪干細胞分化能力更強的臍帶來源的間充質干細胞(umbilical cord-matrix stem cells,UC-MSCs)作為治療的“種子細胞”。本研究利用UC-MSCs作為“種子細胞”應用于卵巢扭轉模型干預卵巢組織的再灌注損傷,以探討UC-MSCs對為卵巢缺血再灌注的治療作用。
1 材料與方法
1.1“種子細胞”的采集及質量控制 本研究使用的臍帶來源于武裝警察部隊后勤學院特色醫學中心收入的孕產婦。臍帶的獲取經產婦本人及家屬同意并告知應用于相關的科學研究,孕婦本人及家屬同意并了解后續用途后簽訂知情同意書。采集臍帶干細胞后用無血清間充質干細胞培養液培養,CD73與CD105雙陽性細胞數為95.5%、CD90陽性細胞數為96.2%,CD34陽性細胞數<3%,見圖1;細胞活力≥95%,病原菌排查未檢出細菌,培養至第3~4代時使用。

圖1 臍帶間充質干細胞的鑒定
1.2實驗動物 30只雌性無特定病原菌級C57BL/6NCrl小鼠購自華阜康生物科技股份有限公司(北京),品系編碼:213,體重18~23 g。分籠喂養,每日日光燈照射時間控制為12 h,室溫控制在18.5~21.5 ℃,飼養環境濕度控制在38.8%~43.5%,整個實驗過程動物自由飲食,保證充足飲水。
1.3主要儀器及藥品 UC-MSCs培養基(美國Lonza公司生產,批號:YS000235),腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)抗體(美國Gibico公司生產,批號:K25772),血管內皮生長因子(vascular endothelial growth factor,VEGF)多克隆抗體(美國Gibico公司生產,批號:SP0810);thermo實驗室用離心機(美國Thermo Electron公司生產,批號:75002493),細胞培養箱(德國BINDER公司,型號:BD400),4%多聚甲醛(上海樊克生物科技有限公司生產,批號:P0099),逆轉錄試劑盒(南京諾唯贊生物科技有限公司,批號:Q223-01),磷酸鹽緩沖液(北京生東科技有限公司生產,批號:BP0002)。
1.4主要的實驗方法 采用隨機數字法將30只C57BL/6NCrl 小鼠分為3組:假手術組、卵巢缺血+再灌注損傷組(模型組)和卵巢缺血+再灌注損傷+UC-MSCs組(干細胞組),每組10只。假手術組:在卵巢動脈僅穿線,不阻斷血液灌流,縫合肌肉、皮膚;模型組:在假手術操作的前提下結扎卵巢動脈,阻斷卵巢血液供應30 min,后剪斷結扎線恢復卵巢血液供應;干細胞組:結扎卵巢動脈30 min后恢復血流灌注,并于恢復血流灌注后24 h通過向尾靜脈注射1.0×106UC-MSCs;模型組給予與干細胞組UC-MSCs同體積的0.9% NaCl注射液。采用實時定量聚合酶鏈反應、Western blot、酶聯免疫吸附測定法等技術檢測各組缺血卵巢組織內VEGF和TNF-α 在分子水平及蛋白水平的表達差異。術后3 d 處死動物,取手術側C57BL/6NCrl小鼠卵巢。
1.4.1血清TNF-α的測定及卵巢組織TNF-α及VEGF mRNA檢測 術后10 d眼球靜脈取血,以離心半徑20 cm,3 000 r/min,離心5 min,去上清,然后按照TNF-α酶聯免疫吸附試劑盒相應說明書逐步操作。應用TRIZOL(Total RNA Isolation)試劑提取創傷區卵巢組織總RNA,根據試劑盒說明反轉錄合成逆轉錄NDA。反應條件:94 ℃預變性3 min,變性30 s,60 ℃ 退火30 s,72 ℃ 延伸30 s,共 29個循環,72 ℃ 再延伸10 min。聚合酶鏈反應產物進行瓊脂糖凝膠電泳,采用快速凝膠成像系統拍攝電泳圖譜條帶,利用圖像分析軟件分析條帶灰度值。TNF-α引物序列如下:TNF-Rat-F:CCCAATCTGTGTCCTTCTAACT;TNF-Rat-R:CAGCGTCTCGTGTGTTTCT(105 bp);ACTB-Rat-F:GTGTGGATTGGTGGCTCTATC;ACTB-Rat-R:CAGTCCGCCTAGAAGCATTT(122 bp)。
1.4.2手術側卵巢組織TNF-α及VEGF變化情況 取三組小鼠手術側卵巢組織,用磷酸鹽緩沖液反復沖洗,去除表面的血液成分和覆膜。加入2 mL體積比為99∶1的細胞裂解液與蛋白磷酸酶混合物,迅速使用液氮進行研磨,然后4 ℃離心,以離心半徑20 cm,15 000 r/min,離心20 min,倒棄離心后的上清剩余物質為卵巢組織總蛋白。三組總蛋白各取總蛋白樣本25 μg,電泳、轉模,蛋白封閉6~8 h。與相應的TNF-α及VEGF抗體孵育,與第二抗體 26 ℃孵育2 h。
1.4.3流式細胞術檢測 各組實驗動物到達預先設計的時間點后,采用安樂死的方法處死各組實驗動物。取各組損傷側卵巢組織,300目篩網研磨,制成單細胞懸液,然后取異硫氰酸熒光素、別藻青蛋白、多甲藻葉綠素蛋白抗體進行CD90、CD73、CD105染色,按照相關說明書進行操作,取流式抗體0.5 μL,磷酸鹽緩沖液+2%血清3.5 μL染色30 s,上機檢測。
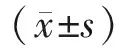
2 結 果
2.1三組實驗大鼠卵巢組織中TNF-α mRNA和VEGF mRNA及其蛋白表達情況 與假手術組比較,模型組、干細胞組小鼠卵巢組織的TNF-α mRNA、TNF-α蛋白、VEGF mRNA及VEGF蛋白表達均升高(P<0.05);與模型組比較,干細胞組TNF-α mRNA、TNF-α蛋白表達水平均下降(P<0.05);VEGF mRNA及VEGF蛋白表達水平均上調(P<0.05),見表1,圖2~3。


組別只數TNF-α mRNATNF-α蛋白VEGF mRNAVEGF蛋白假手術組100.19±0.040.23±0.100.26±0.110.19±0.09模型組 100.57±0.19a0.65±0.21a0.29±0.13a0.22±0.09a干細胞組100.31±0.16ab0.21±0.07ab0.70±0.23ab0.58±0.24abF值3.1732.7652.1682.243P值0.0070.0090.0420.009
TNF-α:腫瘤壞死因子-α;VEGF:血管內皮生長因子;a與假手術組比較,P<0.05;b與模型組比較,P<0.05

TNF-α:腫瘤壞死因子-α;GAPDH:磷酸甘油醛脫氫酶

VEGF:血管內皮生長因子;GAPDH:磷酸甘油醛脫氫酶
2.2各組血清中TNF-α蛋白水平比較 假手術組、模型組、干細胞組TNF-α蛋白水平分別為(0.435±0.012) pg、(5.232±1.320) pg、(1.439±0.508) pg,三組TNF-α蛋白水平比較差異有統計學意義(F=95.886,P<0.001)。模型組、干細胞組TNF-α蛋白水平較假手術組升高(P<0.01);干細胞組TNF-α水平較模型組降低(P<0.01)。
2.3各組卵巢組織內UC-MSCs數量的比較 假手術組、模型組、干細胞組UC-MSCs的數量分別為(0.091±0.034)%、(0.134±0.081)%、(3.176±0.936)%。三組大鼠UC-MSCs的數量比較差異有統計學意義(F=105.310,P<0.001)。模型組大鼠UC-MSCs的數量與假手術組比較,差異無統計學意義(P>0.05);干細胞組UC-MSCs的數量高于假手術組和模型組(P<0.05)。
3 討 論
卵巢扭轉為女性臨床的常見病癥,但若處理不及時或不恰當,輕則可出現輸卵管粘連、堵塞,重則可出現卵巢梗死、破裂等。卵巢扭轉臨床可見于劇烈運動后、外腫瘤的壓迫,腸扭轉、腸套疊、嵌頓疝時腸系膜靜脈和動脈受壓等情況[1-3]。重建血流灌注是卵巢扭轉的有效治療方法,而扭轉的卵巢恢復正常的解剖位置后,雖然血液供應得到恢復,但恢復血流灌注后會出現較前期單純缺血更為嚴重的損傷,因此對卵巢扭轉的缺血再灌注損傷的科學處理對患者的預后轉歸具有重要的臨床意義[3-5]。
MSCs是一類具有干細胞特征的細胞群體,有體內外擴增培養和多向分化的潛能,在再生醫學領域及多種疑難雜癥的治療方面具有廣闊的前景[6-9]。各種組織來源的間充質干細胞及其分泌的細胞因子和外泌體主要通過改善卵巢組織微環境、免疫調節、促進卵泡發育或分化為顆粒細胞,恢復卵巢早衰患者的卵巢功能及生育能力[10]。另有研究證實,UC-MSCs 及骨髓來源的MSCs培養上清所提取的細胞外泌體可通過調節血清中各激素水平而促進卵泡發育,有效降低順鉑對卵巢的損傷和破壞,明顯修復卵巢的功能[11]。可見,MSCs可有效修復受損卵巢組織。基于此,本課題選用無倫理學爭議、細胞增殖和分化能力強、擴增速度快的UC-MSCs作為種子細胞[6,8,12],探討對卵巢扭轉小鼠的治療效果。
有文獻報道,UC-MSCs免疫調節特性強,在自身免疫疾病治療和炎癥的調節方面有獨特的優勢,在臨床上治療自身免疫性疾病、移植物抗宿主疾病、炎癥反應的調節等方面效果顯著[8-9,13]。同時MSCs本身又可分泌多種具有生物活性物質、外泌體、酶類等,而這些物質本身具有良好的治療效果[9,13]。可見,UC-MSCs的治療作用可能既包括損傷細胞的替代作用,又包括細干細胞代謝產物的“旁觀者效應”。MSCs所分泌的生物活性物質可在促進血管再生及血管生成、免疫調節方面發揮強大的作用[14-15]。MSCs外泌體在調節靶細胞功能中發揮重要作用,外泌體囊泡內含MSCs源mRNA、微RNA、酶等成分,這些物質均參與受損組織的修復[16]。UC-MSC修復損傷的作用機制主要包括損傷細胞的替代作用、MSCs的分泌作用、促進血管再生與重建等[17-19]。本研究選用C57BL/6NCrl小鼠模型,成功復制卵巢缺血再灌注模型,給予UC-MSCs進行干預,發現VEGF明顯增加,對恢復受損卵巢組織功能、維持血供具有重要意義;同時,在缺血再灌注損傷發生的病理生理過程中,炎癥反應級聯放大進一步加重受損卵巢組織的“熱反應”,需要在機體的免疫調節方面給予相應的干預,以維持內環境的穩定[5,20]。本實驗結果顯示,UC-MSCs治療可降低TNF-α表達。
綜上所述,UC-MSCs既可下調TNF-α的表達,又可有效加速治療性血管再生,有效促進受損卵巢組織的功能恢復。

