耐受全氟辛酸細菌的篩選及其對脅迫的生理響應
易浪波,柴立元,彭清忠,唐崇儉,周璐璐
(1.中南大學冶金與環境學院,湖南長沙,410083;2.吉首大學生物資源與環境科學學院,湖南吉首,416000)
全氟化合物(perfluorinated compounds,PFCs)指氫原子全部被氟取代的鹵代有機化合物,具備優良的穩定性、表面活性和疏水疏油等特性[1-2]。全氟辛酸(perfluorooctane acid,PFOA)作為PFCs 的典型代表之一,過去幾十年廣泛應用于機械、紡織、石化、電子、輕工、汽車、航空航天等行業[3-5]。隨著其大量使用,近些年在多種環境介質、生物體和人體中不斷被檢測出,從人群密集的城市到少有人類活動的極地區域,呈現出全球分布態勢[6]。由于PFOA 污染廣、性質極其穩定、生物蓄積性強、毒性高,已經嚴重威脅到人類健康和整個生態環境的安全[7],成為繼多氯聯苯和二噁英之后日益引起人們重視的新型持久性有機污染物(POPs)。近年來,國內外學者陸續開展微生物降解PFOA 的研究工作,如薛學佳等[8]通過馴化篩選得到可利用氟代有機化合物為唯一碳源生長的細菌Z1和Z3,經LG-MS檢測分析發現全氟辛酸分子中與羧基相鄰碳的1 個氟被氫取代。何海濤等[9]通過富集篩選獲得降解PFOA 的克雷白氏桿菌(Klebsiellasp.)。SCHR?DER 等[10-11]證明在嚴格限定氧的條件下活性污泥能降解PFOA。但這些微生物降解PFOA 效率低,除了PFOA具有優良的穩定性,其強的生物毒性抑制微生物生長也是重要原因。因此,篩選耐受PFOA 能力強的降解菌是生物修復技術應用的前提。微生物在生態系統中扮演重要角色,其生物特性與生態系統的功能密切相關[12]。微生物在受到PFOA等不利環境脅迫時,會產生活性氧自由基(ROS),誘導體內脂質過氧化反應,引起微生物的損傷甚至凋亡。生物體內的抗氧化應激系統對氧化脅迫極為敏感,其活性可以間接反映機體細胞中ROS 的濃度,因此,測試表征ROS 水平的指標,如丙二醛(MDA)質量摩爾濃度、ATP 酶、超氧化物歧化酶(SOD)、過氧化氫酶(CAT)和谷胱甘肽轉移酶(GST)等的活性變化能監測微生物對PFOA 脅迫的生理響應,理解微生物對PFOA脅迫的適應性和耐受機制。本研究從長期受氟化物污染的環境中篩選能以PFOA為唯一碳源生長的優良菌株,研究其在PFOA脅迫下的耐受能力和生理響應及其耐受機制。
1 材料與方法
1.1 材料
1.1.1 樣品
采集武漢某氟化物工廠污水處理中心的活性污泥,共6 份,分別裝入無菌塑料袋,低溫運至實驗室。
1.1.2 培養基
富集培養基各種組分的質量濃度如下:NaCl 為2 g/L,KH2PO4為1 g/L,NH4NO3為5 g/L, K2HPO4為1 g/L,CaCl2?2H2O 為0.05 g/L,MgSO4?7H2O 為0.5 g/L,酵母膏為1 g/L;根據需要添加不同質量的PFOA。pH 為7.0,實驗 壓力為1.01×105Pa,并在120 ℃條件下滅菌20 min。
篩選培養基(改良的無機鹽離子培養基)的質量濃度如下:NaCl為2 g/L,KH2PO4為1 g/L,NH4NO3為5 g/L,K2HPO4為1 g/L,CaCl2?2H2O 為0.05 g/L,MgSO4?7H2O 為0.5 g/L,PFOA 為500 mg/L;pH 為7.0,實驗壓力為1.01×105Pa,并在120 ℃條件下滅菌20 min。配制固體培養基時加瓊脂粉15 g/L。
鑒定培養基(改良的牛肉膏蛋白胨培養基)的質量濃度如下:酵母膏為5 g/L,蛋白胨為10 g/L,NaCl為10 g/L,PFOA 為500 mg/L;pH 為7.0,實驗壓力為1.01×105Pa,在120 ℃條件下滅菌20 min,配制固體培養基時加瓊脂粉15 g/L。
葡萄糖無機鹽離子培養基的質量濃度如下:NaCl 為2 g/L,KH2PO4為1 g/L,NH4NO3為5 g/L,K2HPO4為1 g/L,CaCl2?2H2O 為0.05 g/L,MgSO4?7H2O為0.5 g/L,PFOA為500 mg/L,葡萄糖2為g/L;pH 為7.0,實驗壓力為1.01×105Pa,在115 ℃條件下滅菌20 min。
1.1.3 儀器與試劑
提取細菌基因組DNA,PCR 擴增所用酶和試劑均購自寶生物工程(大連)有限公司,PFOA(純度98%)購自Sigma 公司,MDA,ATP,SOD,CAT 和GST等酶試劑盒購自南京建成生物工程研究所,其他分析純化學試劑購自湖南科化工貿有限公司。配置PFOA溶液和振蕩實驗所用器皿均為聚丙烯容器。
實驗儀器:J810R型臺式冷凍離心機(德國艾本德股份公司);ABI-2720 PCR 擴增儀(美國ABI 公司),Tanon 1600R全自動數碼凝膠成像分析系統(上海天能科技有限公司);JY98-iiin 超聲波細胞粉碎機(新芝生物科技股份有限公司);UV-2600 紫外可見分光光度計(日本島津儀器公司);FC酶標儀(美國熱電);125 mL和500 mL聚丙烯錐形瓶(美國樂基因)。
1.2 方法
1.2.1 PFOA耐受細菌的分離
將6 份樣品混合均勻,隨機稱取5 g 樣品接種于95 mL PFOA 質量濃度為150 mg/L 的富集培養基中,于30 ℃、轉速160 r/min下振蕩培養,每7 d以5%的接種量轉接至新鮮富集培養基中,每轉接2 次,PFOA的質量濃度增加50 mg/L,當PFOA質量濃度增至500 mg/L 時,繼續傳代培養4 周,菌株馴化結束。取經馴化的菌液5 mL 轉入95 mL 篩選培養基中,于30 ℃,轉速160 r/min下振蕩培養7 d,連續轉接培養3次。取1 mL菌液按梯度稀釋至10-6,吸取0.1 mL稀釋液涂布于篩選培養基平板上,于30 ℃倒置培養7 d,觀察菌株生長情況。挑取生長狀態良好的菌落進行傳代純化。純化后的菌株用15%的甘油于-70 ℃保存。
1.2.2 菌株鑒定
1)菌株的形態及生理生化特性。將富集純化的菌株接種于鑒定培養基上,于35 ℃培養96 h,觀察菌落形態特征。各細菌菌株生理生化特性檢測按文獻[13]方法進行。
2)16S rRNA基因序列測定及系統發育分析。采用CTAB法提取細菌總DNA,以其為模板,利用16S rRNA 基 因 通 用 引 物 PA: 5′ -AGAGTTTGA TCCTGGCTCAG-3′ 和 PB: 5′ -TTAAGGTGAT CCAGCCGCA-3′ 進行PCR 擴增。反應程序如下:于95 ℃預變性5 min,于95 ℃變性30 s,于55 ℃退火30 s,于72 ℃延伸80 s,經過30 個循環,最后于72 ℃延伸10 min。經電泳檢測PCR 產物合格后送生工生物工程(上海)股份有限公司測序。
將測序所得16S rRNA基因序列用BLAST軟件在GenBank 數據庫進行檢索,下載相似性較高的16S rRNA 基因序列,采用CLUSTAL-X 軟件多重比對序列,系統進化距離矩陣根據Kimura 模型估算,用MEGA 4.0軟件進行聚類分析和系統進化樹構建。
1.2.3 菌株對PFOA的耐受性測定
從平板上挑取單菌落接種至牛肉膏蛋白胨液體培養基中,于30 ℃、轉速160 r/min 振蕩培養,取對數生長中期的菌液10 mL,在轉速6 000 r/min 下離心5 min,棄上清,加無菌水10 mL 混勻水洗,如此重復3 次,制備在600 nm 下吸光度(OD600)為2.0 的菌懸液。
配置PFOA甲醇母液,經濾膜過濾除菌,分別加入至300 mL 牛肉膏蛋白胨培養基中,使PFOA 質量濃度分別為0,300,600,900,1 200 和1 500 mg/L。培養基振蕩30 min脫除甲醇后,接入0.3 mL菌懸液,于30 ℃、轉速為160 r/min 條件下培養,定期取樣測定菌液OD600,考察菌株對PFOA的耐受性。
1.2.4 PFOA質量濃度對菌株酶活的影響
根據菌株對PFOA 的耐受程度,分別設置對照(0 mg/L)和低(600 mg/L)、中(900 mg/L)、高(1 200 mg/L)共4 個PFOA 處理質量濃度組,按1%的接菌量將菌株接種至LB液體培養基中振蕩培養(30 ℃,160 r/min),每24 h 取樣60 mL,于6 000 r/min 離心10 min,棄上清,用PBS緩沖液洗2次,并重懸,于冰浴超聲破碎(功率300 W,開3 s,停5 s)10 min,然后將樣品分成3 份:第1 份于1 000 r/min 離心5 min 后,取上清液2 mL測定ATP酶活性;第2份在4 ℃、轉速3 000 r/min下離心10 min,取上清測定蛋白質,SOD,CAT和GST酶活性;第3 份在10 000 r/min 下離心10 min,取上清液測定MDA 濃度。MDA 質量摩爾濃度,ATP 酶,SOD 酶、CAT 活性和還原性GSH 酶均采用可見分光光度法測定,測定方法按照試劑盒的說明。每組實驗重復3次。
1.2.5 數據統計分析
實驗數據采用3次平均值加減標準差表示,利用SPSS19.0 統計軟件對實驗數據進行方差分析和顯著性檢驗,并采用origin8.5繪制圖表。
2 結果與分析
2.1 菌株的分離、形態及生理生化特性
經長期梯度壓力馴化和富集篩選,分離獲得4株細菌,分別編號為YAB-1,YAB-2,YAB-3 和YAB-4。根據馴化的最終質量濃度可知這4 株細菌至少能耐受500 mg/L的PFOA,且能在PFOA 為唯一碳源的篩選培養基中生長,表明其能轉化利用PFOA。將4株菌分別接種至LB培養基平板培養3 d后,菌落形態如圖1所示。
由圖1可見:YAB-1 菌落直徑為1.5~2.5 mm,呈金黃色,表面濕潤,邊緣整齊,圓形隆起;YAB-2菌落直徑0.5~1.0 mm,呈淡黃色,表面濕潤,邊緣整齊,圓形隆起;YAB-3 菌落呈乳白色,表面較干燥,邊緣不整齊,扁平難挑起;YAB-4 菌落直徑1.0~2.0 mm,半透明乳白色,表面濕潤,邊緣整齊,圓形隆起。
分離菌株的革蘭氏染色檢測發現:菌株YAB-2為革蘭氏陽性菌,其他3株細菌為革蘭氏陰性菌。部分生理生化反應檢測結果如表1所示。
2.2 16S rRNA基因序列測定及系統發育分析
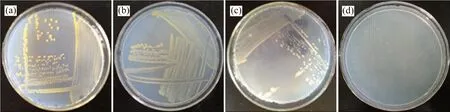
圖1 細菌菌落形態Fig.1 Colony morphological characters of isolates

表1 菌株的生理生化實驗結果Table1 Physiological and biochemical characteristics of the isolates
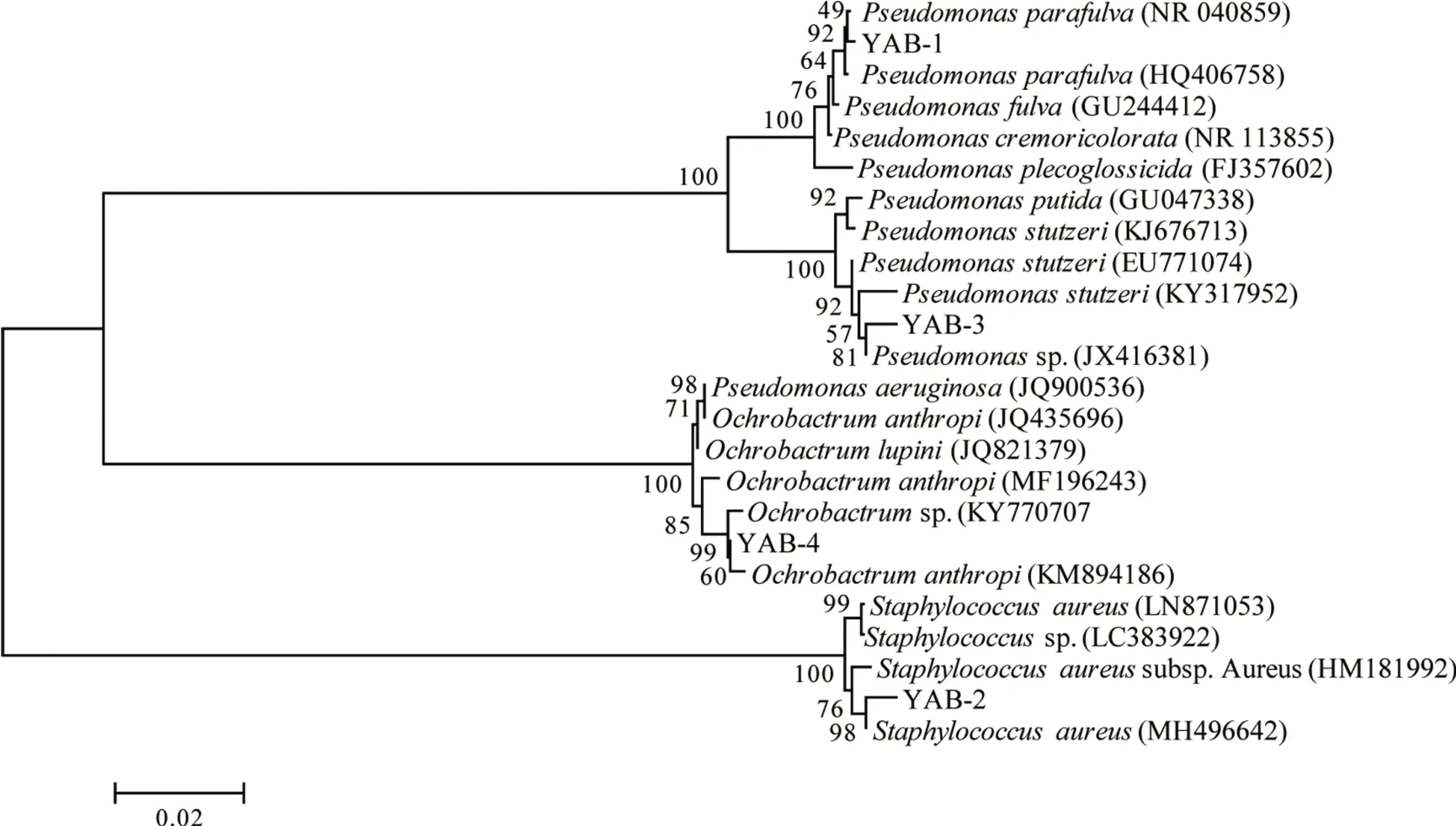
圖2 基于16S rRNA基因序列構建的菌株與其相似性較高典型菌株的系統發育樹Fig.2 Neighbor-Joining tree constructed based on 16S rRNA gene sequence analysis showing phylogenetic relationships among strains and other related taxa
以4 株細菌基因組DNA 為模板,利用PCR 成功擴增出16S rRNA 基因片段,PCR 產物經測序、序列校對后與公共數據庫中相似度較高的同源序列進行多重比對和構建系統進化樹(見圖2)。結果表明:菌株YAB-1 以99.86%的相似值與Pseudomonas parafulva(NR 040859)聚為一支;菌株YAB-2 與Staphylococcusaureus(MH496642)序列同源性為99%;菌株YAB-3與Pseudomonassp.(JX416381)聚在一起,16S rRNA 基因序列同源性達99%;YAB-4與蒼白桿菌屬菌株處于同一分支,與Ochrobactrum anthropi(KM8994186)的同源性達99%;結合其菌落形態和生理生化特性,鑒定菌株YAB-1,YAB-2,YAB-3和YAB-4分屬于類黃色假單胞菌屬(Pseudomonassp.),葡萄球菌屬(Staphylococcussp.),假單胞菌屬(Pseudomonassp.)和蒼白桿菌屬(Ochrobactrumsp.)。
2.3 菌株對PFOA的耐受能力
根據預實驗結果,按1%的接菌量接種測試菌至低、中、高這3種PFOA質量濃度的牛肉膏蛋白胨培養基中考察各細菌對PFOA的耐受情況,圖3所示為不同質量濃度PFOA處理下菌株的生長曲線。
由圖3(a)可知:當菌株YAB-1 在PFOA 質量濃度為900 mg/L 和1 200 mg/L 時,其生長規律符合微生物典型的生長曲線,而當PFOA質量濃度為1 500 mg/L時,菌株YAB-1 不能生長。菌株YAB-1 在900 mg/L PFOA 脅迫下能較好生長,最大吸光度OD600可達3.238 3。當PFOA質量濃度為1 200 mg/L時,菌體生長相對緩慢,生物量顯著降低,最大OD600僅為1.369 0。當PFOA質量濃度為1 500 mg/L時,PFOA對菌株毒害作用顯著,菌體幾乎不增長,菌液OD600接近0。
由圖3(b)可知:當PFOA質量濃度為300 mg/L時菌株YAB-2生長良好(最大OD600為2.705 5);當PFOA質量濃度為600 mg/L 時,菌株生長受到一定程度抑制;當受到900 mg/L PFOA 脅迫時,菌株YAB-2 不生長。
由圖3(c)可知:菌株YAB-3 在PFOA 質量濃度梯度設置與YAB-2 相同的條件下,生長規律也類似。菌株YAB-4 對PFOA 的耐受情況如圖3(d)所示,在600 mg/L PFOA 脅迫下生長良好,在900 mg/L PFOA脅迫下菌株生長顯著降低,菌液最大OD600僅為0.465 9;當PFOA為1 200 mg/L時,菌株YAB-4無法生長。
PFOA對菌株有一定的毒害作用,高質量濃度的PFOA 會顯著抑制菌體增值,但4 株菌仍表現出較強的耐受性和生長適應性,這可能與其篩選于長期受PFOA 污染的樣品有關。比較4 株菌對PFOA 的耐受性發現,不同菌株的耐受能力不同,所能承受的PFOA 脅迫質量濃度也不一樣,菌株YAB-1 對PFOA的耐受性最強,其次是YAB-4,而菌株YAB-2 和YAB-3的耐受能力較弱。
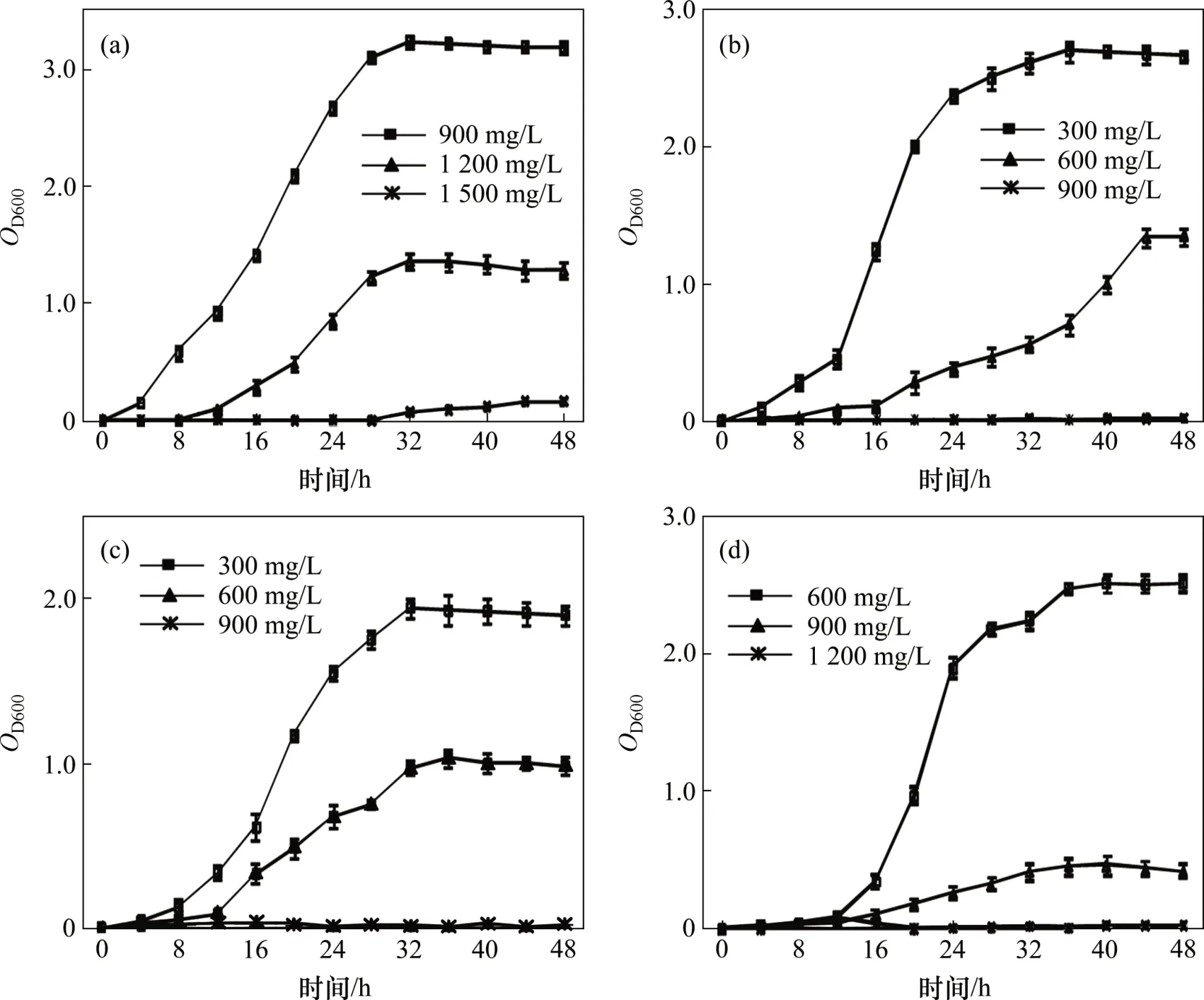
圖3 PFOA處理下菌株的生長曲線Fig.3 Growth curves of the isolates in presence of PFOA
2.4 PFOA對菌株YAB-1的生理毒性
2.4.1 MDA質量摩爾濃度
生物細胞內濃度過高的活性氧會攻擊細胞膜中不飽和脂肪酸,進而影響膜的流動性與穩定性。MDA是膜脂過氧化的主要產物之一,是評價膜脂過氧化和細胞受脅迫程度的一項重要指標[14]。圖4所示為PFOA對菌株YAB-1細胞MDA質量摩爾濃度的影響。由圖4可見:培養基中不添加PFOA的對照組,菌體MDA 質量摩爾濃度無明顯變化;當菌株YAB-1 被脅迫24 h 時,PFOA 質量濃度越高,MDA 質量摩爾濃度越高;當PFOA 質量濃度為1 200 mg/L 時MDA 質量摩爾濃度達最高值,為19.2 nmol/g;當脅迫32 h時,MDA 質量摩爾濃度變化隨PFOA 質量濃度提高而逐步升高,但在高質量濃度PFOA 脅迫下MDA 質量摩爾濃度較脅迫24 h已顯著降低。當脅迫48 h時,低質量濃度和中等質量濃度PFOA 脅迫能引起MDA質量摩爾濃度增加,高質量濃度PFOA 脅迫會使MDA 質量摩爾濃度顯著降低。以上結果表明:低質量濃度PFOA 短期脅迫菌株YAB-1 細胞的MDA 質量摩爾濃度無顯著變化,長期脅迫會使MDA質量摩爾濃度顯著上升;高質量濃度PFOA 短期脅迫則使MDA 質量摩爾濃度顯著升高,長期脅迫可使菌體MDA質量摩爾濃度顯著降低。
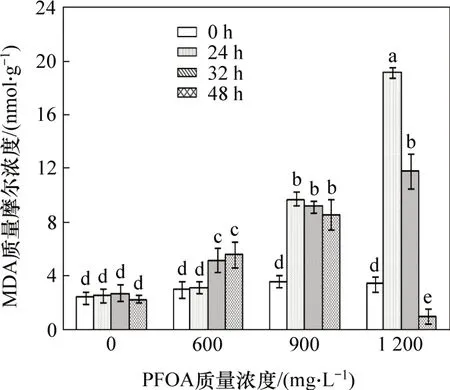
圖4 PFOA 對菌株YAB-1細胞MDA 濃度的影響Fig.4 Effect of different time and PFOA concentrations on MDA of strain YAB-1
2.4.2 ATP酶活性
在PFOA 脅迫下,菌株YAB-1 細胞膜Na+K+-ATPase 和Ca2+Mg2+-ATPase 酶活性變化規律如圖5所示。菌株YAB-1在沒有PFOA脅迫下,Na+K+-ATPase和Ca2+Mg2+-ATPase 酶活性無顯著變化;低質量濃度PFOA 脅迫能引起Na+K+-ATPase 酶活性持續顯著升高,而Ca2+Mg2+-ATPase 酶活性自24 h 顯著升高后維持穩定。中等質量濃度PFOA 脅迫能誘導Na+K+-ATPase 和Ca2+Mg2+-ATPase 酶活性出現相似的變化規律,即24 h時酶活性顯著升高,隨后酶活顯著降低。高質量濃度PFOA脅迫菌株致使2種ATPase的活性與對照相比均顯著降低。
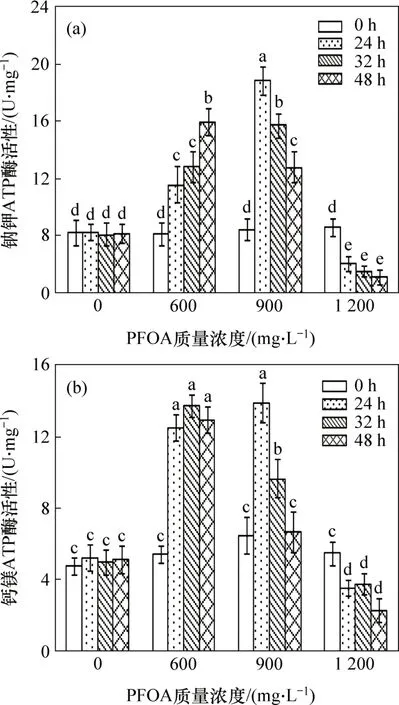
圖5 PFOA對菌株YAB-1細胞ATP酶活性的影響Fig.5 Effect of different time and PFOA concentrations on ATPase activitres of strain YAB-1
2.4.3 SOD酶活性
機體遭受逆境脅迫時,會形成大量的活性氧自由基,從而造成氧化損傷。而抗氧化酶的存在可以降低活性氧自由基,抑制膜脂過氧化,維持細胞正常的生理功能。圖6所示為菌株YAB-1 遭受不同劑量PFOA脅迫時,SOD抗氧化酶活性隨反應時間的變化情況。由圖6可知:低質量濃度PFOA 脅迫能夠引起菌體SOD酶活顯著升高;中等質量濃度PFOA能夠刺激機體產生大量SOD,被脅迫32 h 時,機體產生的SOD酶活性達最大值,為0.399 2 U/mg;高質量濃度PFOA 脅迫菌株會抑制機體產生SOD,致使SOD 活性顯著下降。
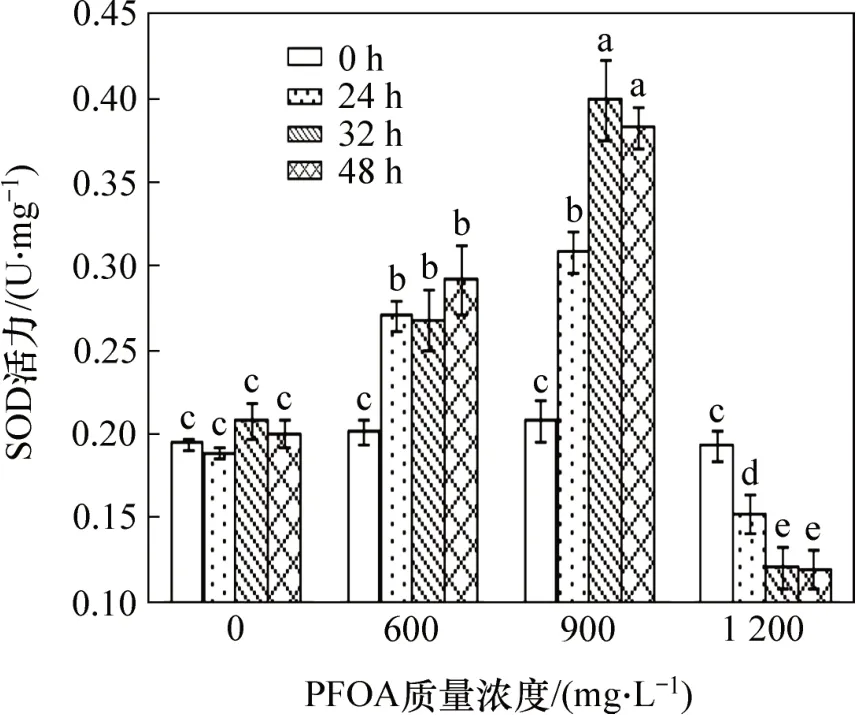
圖6 PFOA對菌株YAB-1細胞SOD酶活力的影響Fig.6 Effect of PFOA on SOD activity of strain YAB-1
2.4.4 CAT酶活性
CAT酶是抗氧化防御系統中一類重要的酶,能將SOD 酶歧化產生的H2O2分解成為H2O 和O2,從而消除細胞內過剩的活性氧自由基,保護細胞穩定的內環境及細胞的正常代謝。圖7所示為PFOA對菌株YAB-1細胞CAT酶活力的影響。由圖7可知:低質量濃度PFOA 脅迫誘導菌株YAB-1 細胞CAT 酶升高,脅迫32 h時CAT活性達最大為0.361 9 U/mg;中等質量濃度PFOA會誘導菌株CAT活性緩慢升高,之后趨于平緩,48 h后CAT活性達最高為0.294 3 U/mg。采用高質量濃度PFOA處理菌株,CAT活性與處理時間呈負相關,培養至48 h時,菌體CAT活性僅為0.115 4 U/mg,顯著低于對照組。
2.4.5 GST酶活性
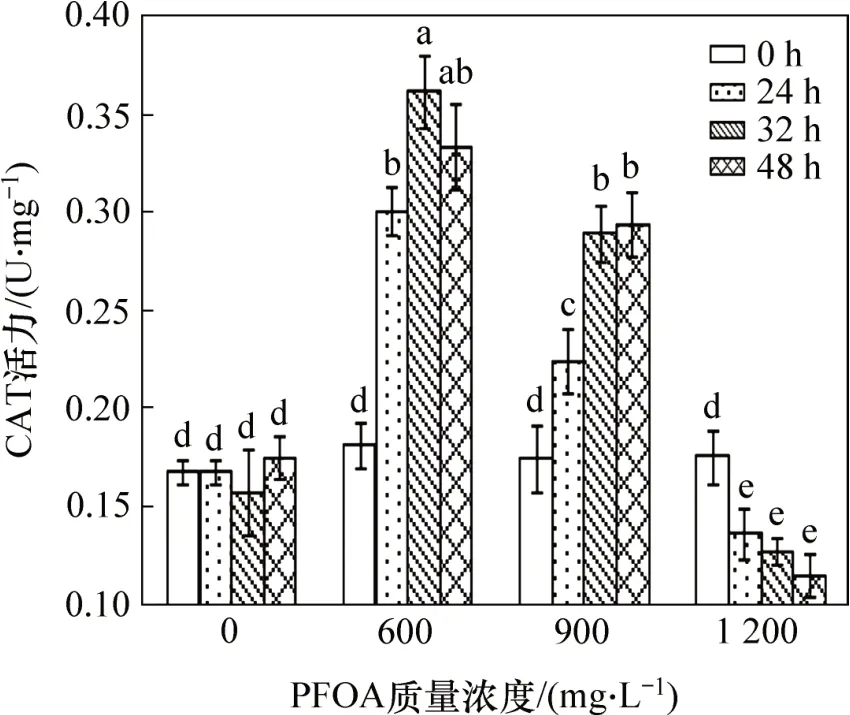
圖7 PFOA對菌株YAB-1細胞CAT酶活力的影響Fig.7 Effect of different time and PFOA concentrations on CAT activity of strain YAB-1
作為非酶抗氧化系統一類重要的物質GST,也是活性氧自由基重要的清除劑,能保護細胞膜中含巰基的蛋白質和酶不被氧化變性,從而維持細胞體內活性氧自由基的動態平衡。圖8所示為菌株YAB-1細胞從圖8可見:GST在不同質量濃度PFOA脅迫下的變化關系曲線。低質量濃度PFOA脅迫能引起菌株YAB-1隨時間延長而GST 活性大幅增長,48 h 時達到最大值,GST 活性為0.077 8 U/mg;中等質量濃度PFOA能誘導菌株GST活性隨時間延長而小幅增長,48 h時達最大值,GST 活性為0.047 3 U/mg。高質量濃度PFOA脅迫不能誘導GST活性顯著變化。
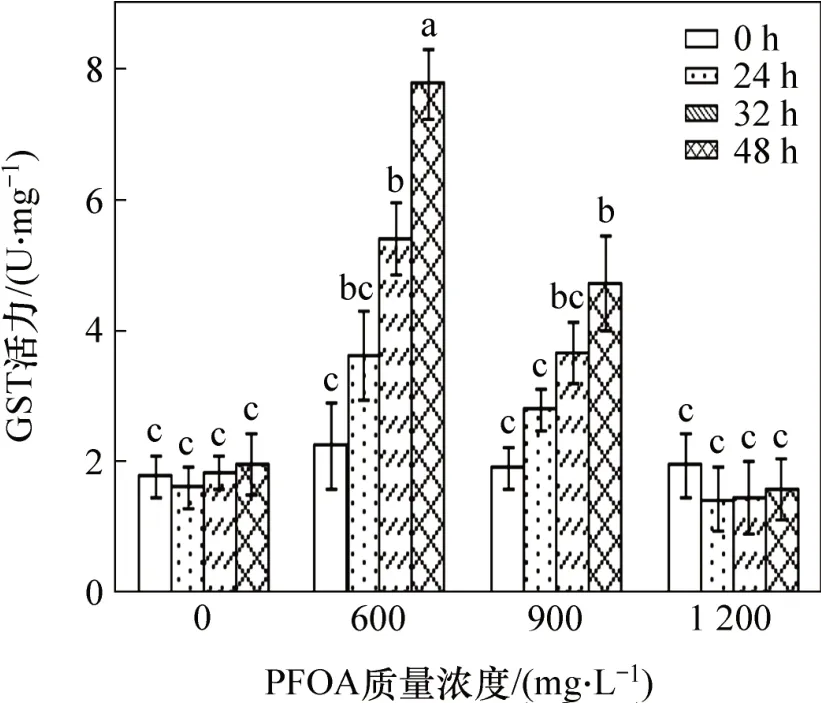
圖8 PFOA 對菌株YAB-1細胞GST 酶活力的影響Fig.8 Effect of different time and PFOA concentrations on GSH of strain YAB-1
3 討論
3.1 分離株耐受PFOA能力
本研究采用梯度壓力馴化和以PFOA為唯一碳源富集培養,篩選獲得4 株耐受力較強的細菌。其中,菌株YAB-1 表現出突出的耐受優勢,在1 200 mg/L PFOA 脅迫下仍能生長。總體來看,4 株菌對PFOA的耐受性相比薛學佳等[8]分離的降解菌Z1和Z3更強,也遠優于符安等[15]報道的釀酒酵母耐受PFOA的能力(<100 mg/L)。推測分離菌株來自受氟化物污染的環境,長期的選擇壓力導致部分細菌發生突變以適應新的環境,耐受能力顯著提高。同時,開展這些菌株對PFOA 降解效率的研究,發現4 株細菌在優化培養條件下PFOA 降解率達到25%~35%,其中菌株YAB-1的最大降解率為32.4%[16]。
3.2 PFOA脅迫對耐受菌的細胞毒性
微生物受到外界脅迫時,會引發細胞內ROS 含量升高,過量的ROS 會導致細胞質膜的過氧化而引起膜氧化損傷。MDA 是細胞膜脂過氧化作用的產物之一,可用來表征細胞膜脂過氧化作用能力,揭示細胞膜損傷程度。本研究中,菌株YAB-1 細胞內的MDA 質量摩爾濃度隨PFOA 質量濃度的增加而顯著升高。當PFOA質量濃度升高到1 200 mg/L時,隨著脅迫時間的延長,菌體內MDA濃度呈現出先升高后降低的變化趨勢,這表明污染物脅迫可以增加細胞內活性氧的積累,引起菌體細胞膜脂質化,MDA 濃度升高。MDA 濃度越高說明細胞膜損傷越嚴重,當長時間高質量濃度脅迫后,細胞膜損傷,可致菌體破裂解體,MDA 釋放至溶液中,膜上MDA 相對濃度降低。鄧庭進等研究微囊藻毒素對細菌中MDA濃度影響時也證實了該變化規律[17]。重金屬脅迫也會造成MDA 在微生物細胞質膜上積累,從而降低質膜的流動性,損傷細胞[18]。
Na+K+-ATPase 和Ca2+Mg2+-ATPase 等ATP 酶 廣 泛存在于細胞膜及細胞器膜上,對維持細胞能量代謝和細胞內外滲透壓平衡、離子運輸和細胞膜完整性起著重要作用。當中等質量濃度PFOA脅迫時,能誘發菌株YAB-1 細胞膜上Na+K+-ATPase 和Ca2+Mg2+-ATPase酶活性顯著升高,在高質量濃度PFOA 脅迫下,這2種ATP酶活性顯著降低。脅迫初期菌體通過提高酶的活性來維持細胞膜兩側的膜電位,維持細胞內外滲透壓平衡,當ROS 積累過量時,膜系統完整性受損嚴重,膜上的ATP酶也受到攻擊,ATP酶活下降,物質運輸受阻,進而使得細胞凋亡。不同種類的菌株對PFOA 的響應情況不同,楊蒙等[19]研究PFOA 對大腸桿菌細胞膜上的Na+K+-ATPase 和Ca2+Mg2+-ATPase 活性發現,10 mg/L 的PFOA 脅迫36 h 即能誘導ATP 酶活力下降,符安等[15]通過研究PFOA對酵母菌細胞膜上ATP酶活性影響得出,100 mg/L PFOA 對釀酒酵母具有即時毒性,能使ATP 酶活性降低,致使細胞凋亡,本實驗室篩選的菌株YAB-1 較之有突出的耐受優勢,這與菌株來源于受PFOA 長期脅迫的環境有關。
逆境脅迫誘發生物體產生的ROS 和SOD 是細胞對抗ROS 的第一道防線,能將細胞內過量的O2-歧化為H2O2和H2O,而CAT 則能有效地把H2O2轉化成H2O和O2,降低氧自由基的毒性,增強細菌的耐受性和適應性。在本研究中,菌株YAB-1 細胞SOD 和CAT活性在遭受到低質量濃度PFOA脅迫時與對照相比顯著增加,在高質量濃度PFOA 脅迫時,SOD 和CAT酶活性均顯著降低。低質量濃度PFOA能引發機體產生活性氧,從而誘導抗氧化酶濃度升高,高質量濃度PFOA長時間脅迫會引起機體ROS大量積累,機體不能及時清除造成氧化損傷,導致酶活性降低。這與王志剛等[20]研究鄰苯二甲酸二甲酯對典型細菌Bacillus subtilisB19 和Escherichia coliK12 的氧化損傷所得結果一致。
機體內GST易與有害物質親電結合,具有解毒作用。菌株YAB-1 在小于900 mg/LPFOA 處理下,刺激機體產生大量的GST 與PFOA 或其他中間代謝物結合,阻止外源化合物與細胞內其他生物大分子結合,從而實現減毒效應,增強機體對毒物的耐受性能。隨著PFOA 濃度升高,氧化損傷加劇,細胞受損甚至凋亡,導致GST活性降低。
4 結論
1)篩選到4 株以PFOA 為唯一碳源生長的細菌,鑒定YAB-1 為類黃色假單胞菌屬(Pseudomonas parafulva),YAB-2,YAB-3 和YAB-4 分別屬于葡萄球菌屬 (Staphylococcussp.),假單胞菌屬(Pseudomonassp.)和蒼白桿菌屬(Ochrobactrumsp.)。
2)對分離株進行PFOA耐受脅迫分析,發現低質量濃度PFOA脅迫細菌生長速度快,在中等質量濃度PFOA脅迫下生長相對較慢,生物量較低;高質量濃度PFOA 抑制菌株增值。菌株YAB-1 表現出較強的PFOA耐受性。
3)優勢耐受菌YAB-1受低質量濃度PFOA短期脅迫后,引起細胞內MDA 相對質量摩爾濃度顯著升高,膜上Na+K+-ATP 酶活性與Ca2+Mg2+-ATP 酶活性顯著升高,胞內SOD,CAT和GST酶活性顯著升高。當高質量濃度長時脅迫時,細胞內MDA濃度顯著降低,膜上Na+K+-ATP 酶活性與Ca2+Mg2+-ATP 酶活性顯著降低,胞內SOD和CAT 酶活性顯著降低。

