紅茶菌發(fā)酵黃漿水的體外抗氧化活性
唐思頡,涂傳海,胡文秀,董明盛*
(南京農(nóng)業(yè)大學(xué)食品科技學(xué)院,江蘇 南京 210095)
紅茶菌也被稱為康普茶、“海寶”,是一種味道酸甜可口的純天然保健飲品[1],對于多種胃病具有一定保健作用,在亞洲已有2 000多年的食用歷史。傳統(tǒng)紅茶菌制備方法為以茶糖水為基質(zhì),添加紅茶菌菌液及菌膜經(jīng)自然發(fā)酵而成。最新研究表明,紅茶菌菌膜是一種液面生物膜,其中包含醋酸菌、酵母菌和少量的乳酸菌。紅茶菌的功能特性主要取決于發(fā)酵液中含有的茶葉浸出物、活的微生物及其代謝產(chǎn)物。由于菌種的差異性和培養(yǎng)方法的不同,紅茶菌的代謝途徑復(fù)雜,所得到菌液中功能成分的種類、含量也有所不同,其功能特性主要歸因于在發(fā)酵過程中產(chǎn)生的有機酸和酚類等抗氧化物質(zhì)[2]。
黃漿水是豆腐生產(chǎn)過程中所產(chǎn)生的副產(chǎn)品,其中含有大量的低聚糖、大豆異黃酮及少量的蛋白質(zhì)等營養(yǎng)物質(zhì)[3]。隨著豆制品在世界范圍內(nèi)產(chǎn)量的增加,黃漿水的排放所造成的資源浪費和環(huán)境污染備受關(guān)注。已有研究表明,經(jīng)過益生菌發(fā)酵黃漿水的營養(yǎng)價值和功能活性有所提高,尤其是經(jīng)過微生物發(fā)酵后,糖苷型的異黃酮轉(zhuǎn)化為苷元型的異黃酮,其體外抗氧化能力有所提高,微生物發(fā)酵有可能為黃漿水的利用提供新的途徑[4-6],實現(xiàn)黃漿水資源的利用,減少排污,為豆制品企業(yè)帶來良好的經(jīng)濟效益。
1 材料與方法
1.1 材料與試劑
黃漿水 南京市豆果果豆制品有限公司;紅茶菌發(fā)酵母液由南京農(nóng)業(yè)大學(xué)食品微生物研究室保存;紅茶茶包、白砂糖 南京市蘇果超市。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-聯(lián)氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽(2,2’-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid),ABTS)、三吡啶基三嗪(tripyridyltriazine,TPTZ)、抗壞血酸 南京雙領(lǐng)化玻有限公司;大豆異黃酮標(biāo)準(zhǔn)品(色譜級) 上海源葉生物科技有限公司;乙腈、三氟乙酸(色譜級) 南京大光明器化玻及供應(yīng)部;其他試劑均為國產(chǎn)分析純。
1.2 儀器與設(shè)備
LDZX-40AI型立式電熱壓力滅菌鍋 上海申安醫(yī)療器械廠;64RL高速冷凍離心機 美國Beckman公司;SYG-1220數(shù)顯恒溫水浴鍋 美國Crystal有限公司;AUY-120分析天平、UV-2450紫外分光光度計 日本島津公司;IS128 pH計 上海儀邁儀器科技有限公司;Synergy-2酶標(biāo)儀 美國Biotek公司;UP-250-HE數(shù)控超聲波清洗器 南京壘君達超聲電子儀器設(shè)備有限公司;1100型高效液相色譜儀 美國安捷倫公司。
1.3 方法
1.3.1 紅茶菌發(fā)酵液的制備
將紅茶以5 g/L添加到沸水中,煮沸5 min,加入質(zhì)量分數(shù)10%白砂糖,充分溶解后過濾,待茶糖水冷卻至室溫后,按質(zhì)量分數(shù)10%接入紅茶菌發(fā)酵母液,28 ℃恒溫靜置培養(yǎng)8 d,發(fā)酵好的紅茶菌用于后續(xù)黃漿水的發(fā)酵。
1.3.2 紅茶菌發(fā)酵黃漿水的制備
黃漿水于108 ℃滅菌15 min后冷卻至室溫。參照謝惠青[7]、Vitas[8]等的方法,在無菌環(huán)境下,按質(zhì)量分數(shù)10%接入紅茶菌,28 ℃恒溫靜置培養(yǎng)8 d,每隔1 d無菌操作取樣,樣品經(jīng)12 000 r/min離心10 min后放置于4 ℃冰箱,用于后續(xù)實驗測定。
1.3.3 pH值和總酸濃度的測定
用pH計測定發(fā)酵過程中pH值的變化;用0.1 mol/L NaOH溶液滴定發(fā)酵黃漿水,總酸濃度的計算如式(1)所示。

式中:c2為發(fā)酵黃漿水總酸濃度/(mol/L);c1為NaOH溶液濃度/(mol/L);V1為NaOH滴定發(fā)酵液后的體積/mL;V2為NaOH滴定發(fā)酵液前的體積/mL;V3為待測發(fā)酵液體積/mL。
1.3.4 還原糖質(zhì)量濃度的測定
參照Sengupta等[9]的方法,采用3,5-二硝基水楊酸比色法測定黃漿水發(fā)酵過程中還原糖質(zhì)量濃度。
1.3.5 樣品提取
參照Fei Yongtao等[10]的方法,采用體積分數(shù)80%甲醇溶液提取樣品,其中一部分提取液經(jīng)0.45 μm無菌微孔濾膜過濾后用于高效液相色譜測定大豆異黃酮質(zhì)量濃度;另一部分提取液經(jīng)旋轉(zhuǎn)蒸發(fā)濃縮后冷凍干燥,并按實驗需要用體積分數(shù)80%甲醇溶液復(fù)溶,稀釋至不同質(zhì)量濃度,用于體外抗氧化活性測定。
1.3.6 總酚和總黃酮質(zhì)量濃度的測定
參照Chakravorty等[11]的方法,采用福林-酚比色法測定總酚質(zhì)量濃度,以沒食子酸質(zhì)量計,根據(jù)標(biāo)準(zhǔn)曲線計算。總黃酮質(zhì)量濃度的測定參照Jia Zhishen等[12]的方法,以蘆丁質(zhì)量計,根據(jù)標(biāo)準(zhǔn)曲線計算。
1.3.7 大豆異黃酮組分的測定
采用高相液相色譜法測定黃漿水中大豆異黃酮質(zhì)量濃度。參考Xiao Yu等[4]的實驗方法。實驗條件為:色譜柱為C18柱(250 mm×4.6 mm,5 μm);流動相A為體積分數(shù)0.1%三氟乙酸水溶液,流動相B為乙腈;流速:0.7 mL/min;柱溫:25 ℃;檢測器:紫外檢測器;檢測波長:254 nm;進樣量:20 μL。梯度洗脫條件為:0~10 min,體積分數(shù)90%~75%流動相A;10~12 min,體積分數(shù)75%~70%流動相A;12~25 min,體積分數(shù)70%~45%流動相A;25~30 min,體積分數(shù)45%~90%流動相A。
大豆異黃酮的種類通過將未知峰與標(biāo)準(zhǔn)品在完全相同條件下的保留時間進行對比而確定。通過大豆異黃酮標(biāo)準(zhǔn)品的標(biāo)準(zhǔn)曲線計算發(fā)酵黃漿水中各大豆異黃酮的質(zhì)量濃度。
1.3.8 體外抗氧化能力測定
1.3.8.1 DPPH自由基清除能力測定
參照丁艷如等[13]的方法,配制不同質(zhì)量濃度的樣品及生育酚,向2 mL樣品中加入2 mL DPPH溶液(0.5 mmol/L),振蕩搖勻,在室溫下避光反應(yīng)30 min,于517 nm波長處測定吸光度。DPPH自由基清除率如式(2)所示計算。
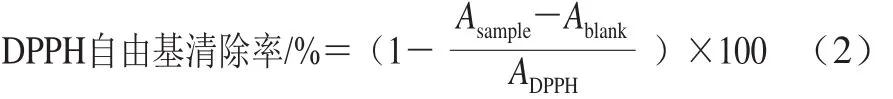
式中:ADPPH為DPPH和甲醇溶液的吸光度;Asample為DPPH和樣品溶液的吸光度;Ablank為樣品和甲醇溶液的吸光度。
1.3.8.2 ABTS陽離子自由基清除能力測定
參考Xiao Yu等[4]的方法,配制7 mmol/L ABTS溶液和2.45 mmol/L過硫酸鉀溶液,按體積比1∶2混勻后置于黑暗環(huán)境16 h。使用前用乙醇稀釋ABTS溶液,使其在734 nm波長處的吸光度為0.70±0.02。配制不同質(zhì)量濃度的樣品和生育酚溶液0.3 mL,加入1.2 mL ABTS溶液,在室溫下反應(yīng)6 min,測定734 nm波長處的吸光度。ABTS陽離子自由基清除率如式(3)所示計算。
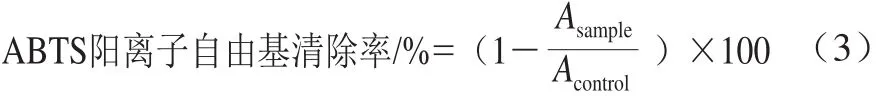
式中:Asample為ABTS和樣品溶液的吸光度;Acontrol為ABTS和甲醇溶液的吸光度。
1.3.8.3 亞鐵離子還原力測定
參照Xiao Yu等[14]方法,配制0.3 mol/L醋酸緩沖液(pH 3.6),用40 mmol/L HCl溶液配制濃度為10 mmol/L的TPTZ溶液和20 mmol/L FeCl3·6H2O溶液,按體積比10∶1∶1將上述溶液混勻制得亞鐵離子還原力溶液。配制不同質(zhì)量濃度的樣品和生育酚溶液0.2 mL,加入1 mL亞鐵離子還原力溶液,在37 ℃下放置20 min,測定593 nm波長處的吸光度。配制梯度FeSO4標(biāo)準(zhǔn)溶液(100~1 400 μmol/L),于593 nm波長處測定吸光度,繪制標(biāo)準(zhǔn)曲線:y=0.002 1x+0.202 5(R2=0.999),通過標(biāo)準(zhǔn)曲線計算亞鐵離子濃度以表示亞鐵離子還原力。
1.3.8.4 還原力測定
參照朱曉慶等[15]方法,將0.2 mL樣品、1 mL 0.2 mol/L磷酸鹽緩沖液(pH 6.6)和1 mL質(zhì)量分數(shù)1%鐵氰化鉀溶液混勻,于50 ℃反應(yīng)30 min。冷卻后加入體積分數(shù)10%三氯乙酸溶液1 mL,混勻,3 000 r/min離心10 min。取1 mL上清液加入0.2 mL質(zhì)量分數(shù)1%三氯化鐵溶液,混勻,靜置10 min。以蒸餾水為空白對照,于700 nm波長處測定吸光度。以樣品溶液與空白對照吸光度的差表示還原力。
1.4 數(shù)據(jù)統(tǒng)計與分析
2 結(jié)果與分析
2.1 黃漿水發(fā)酵過程中pH值和總酸濃度的變化
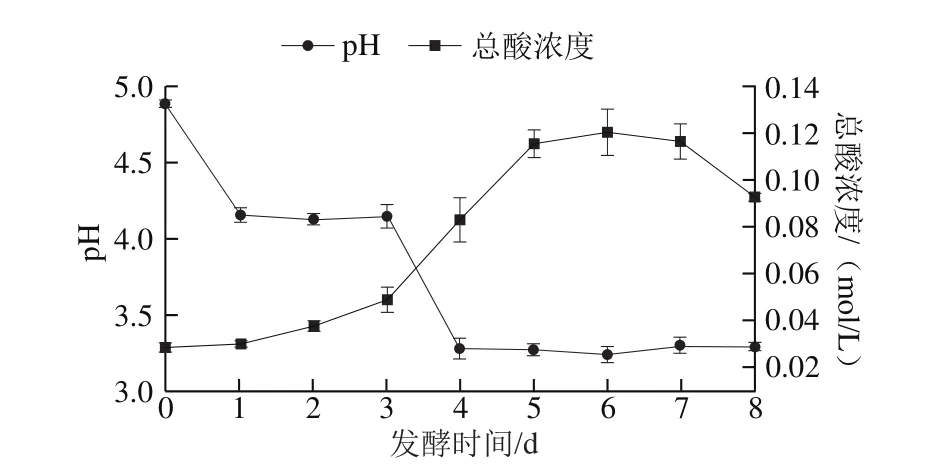
圖1 黃漿水發(fā)酵過程中pH值和總酸濃度的變化Fig. 1 Changes in pH and titratable acidity during soy whey fermentation
如圖1所示,pH值下降伴隨著總酸濃度的增加。8 d發(fā)酵期間出現(xiàn)兩個明顯的轉(zhuǎn)折點。第1個轉(zhuǎn)折點出現(xiàn)在第1天,pH值由為初始的4.89降至4.16,其后pH值穩(wěn)定在4.15左右。第3天,pH值再次下降到3.28,此后pH值穩(wěn)定在3.24~3.30之間。與此相反,總酸濃度持續(xù)增加至第6天,在第3~6天之間增加幅度最明顯,從0.049 mol/L增加至0.121 mol/L,在第8天略下降至0.093 mol/L。pH值下降是由于發(fā)酵過程中產(chǎn)生的酸所致。有研究發(fā)現(xiàn),紅茶菌發(fā)酵過程中存在兩個階段,即乙醇發(fā)酵階段和醋酸發(fā)酵階段[16]。在發(fā)酵初期為乙醇發(fā)酵階段,主要由酵母發(fā)揮重要作用,酵解果糖產(chǎn)生乙醇和二氧化碳;此后為醋酸發(fā)酵階段,其間醋酸菌利用葡萄糖產(chǎn)生葡萄糖酸或葡萄糖醛酸等活性物質(zhì),并利用乙醇產(chǎn)生乙酸等多種有機酸,其中乙酸被公認為紅茶菌發(fā)酵過程中產(chǎn)生的最主要的有機酸。Jayabalan等[17]證明紅茶菌發(fā)酵液具有緩沖作用,因其產(chǎn)生的二氧化碳溶于水中產(chǎn)生HCO3-,與有機酸釋放的H+反應(yīng),導(dǎo)致即使在醋酸發(fā)酵階段產(chǎn)生大量有機酸時pH值仍然保持穩(wěn)定。
2.2 還原糖質(zhì)量濃度的變化
如圖2所示,第1天還原糖質(zhì)量濃度略增加,第1~3天還原糖質(zhì)量濃度從9.68 mg/mL急速下降至1.37 mg/mL,此后在1.24~1.83 mg/mL之間波動。結(jié)合2.1節(jié)pH值和總酸濃度在發(fā)酵過程中的變化情況,可推斷前3 d為乙醇發(fā)酵階段,其間酵母菌為主要生長代謝的菌種,消耗了大量還原糖,并將其轉(zhuǎn)化為乙醇和二氧化碳,所產(chǎn)生的乙醇在發(fā)酵后期被醋酸菌迅速氧化為乙酸及其他有機酸,導(dǎo)致發(fā)酵液中H+濃度升高,在酸性環(huán)境中加速蔗糖水解產(chǎn)生葡萄糖和果糖;同時,醋酸菌消耗水解產(chǎn)生還原糖,進而使發(fā)酵體系中還原糖的產(chǎn)生和代謝維持平衡,表現(xiàn)為發(fā)酵第3天之后還原糖質(zhì)量濃度保持穩(wěn)定。
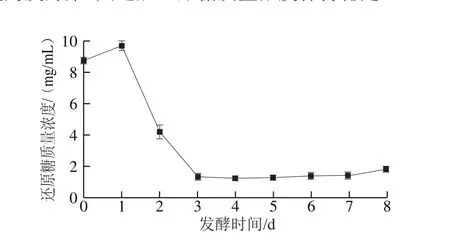
圖2 黃漿水發(fā)酵過程中還原糖質(zhì)量濃度的變化Fig. 2 Changes in reducing sugar content during soy whey fermentation
2.3 總酚和總黃酮質(zhì)量濃度的變化
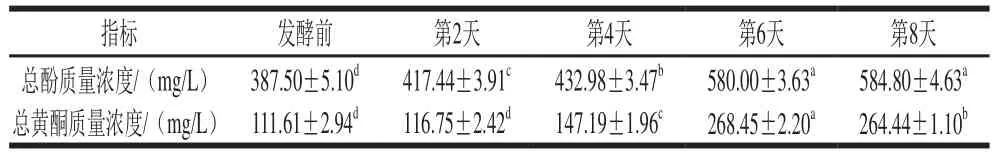
表1 發(fā)酵前后黃漿水體積分數(shù)80%甲醇溶液提取物中總酚和總黃酮質(zhì)量濃度Table 1 Contents of total phenols and total flavonoids in 80% methanol extracts from unfermented and fermented soy whey
如表1所示,發(fā)酵黃漿水中總酚和總黃酮質(zhì)量濃度都有顯著提升。黃漿水提取物中總酚質(zhì)量濃度從(387.50±5.10)mg/L提高至發(fā)酵第8天的(584.80±4.63)mg/L,總黃酮質(zhì)量濃度由(111.61±2.94)mg/L持續(xù)增加至發(fā)酵第6天的(268.45±2.20)mg/L。結(jié)果表明,發(fā)酵后黃漿水中新生成了酚類、黃酮類物質(zhì)。許多研究表明酚類物質(zhì)(包括黃酮類物質(zhì))多與蛋白、脂肪等物質(zhì)相結(jié)合,以復(fù)雜且不可溶的形式存在于植物中[18],在發(fā)酵過程中由于微生物分泌的各種酶或發(fā)酵環(huán)境酸堿度的變化等,結(jié)合酚被釋放出來[19-20];另一方面,微生物的代謝活動也可以作用于某些生物活性物質(zhì),改變其性質(zhì),從而產(chǎn)生新的酚類和黃酮類化合物[21]。
2.4 大豆異黃酮質(zhì)量濃度的變化

表2 4 種大豆異黃酮標(biāo)準(zhǔn)品的線性方程Table 2 Standard curves for various soybean isoflavonoids
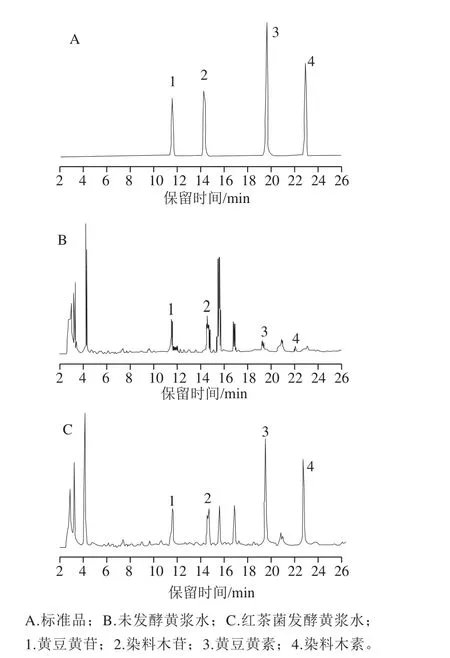
圖3 大豆異黃酮的高效液相色譜圖Fig. 3 HPLC chromatogram of extracts rich in soybean isoflavonoids
如圖3、表2所示,本實驗測定了4 種主要的大豆異黃酮,其中黃豆黃苷和染料木苷屬于結(jié)合型的糖苷,黃豆黃素和染料木素屬于游離型的苷元。如表3所示,總體而言,在紅茶菌發(fā)酵黃漿水過程中,糖苷型異黃酮總質(zhì)量濃度逐漸降低,從(86.49±1.61)mg/L減少至(47.65±3.74)mg/L,苷元型異黃酮總質(zhì)量濃度提高,從(28.17±2.96)mg/L增加至(150.11±2.50)mg/L,發(fā)酵至第6天時大豆異黃酮總質(zhì)量濃度比接種第0天增加約86.05 mg/L。綜合上述實驗結(jié)果,發(fā)酵至第6天的黃漿水中大豆異黃酮質(zhì)量濃度達到最大值,因此確定發(fā)酵終點為第6天。
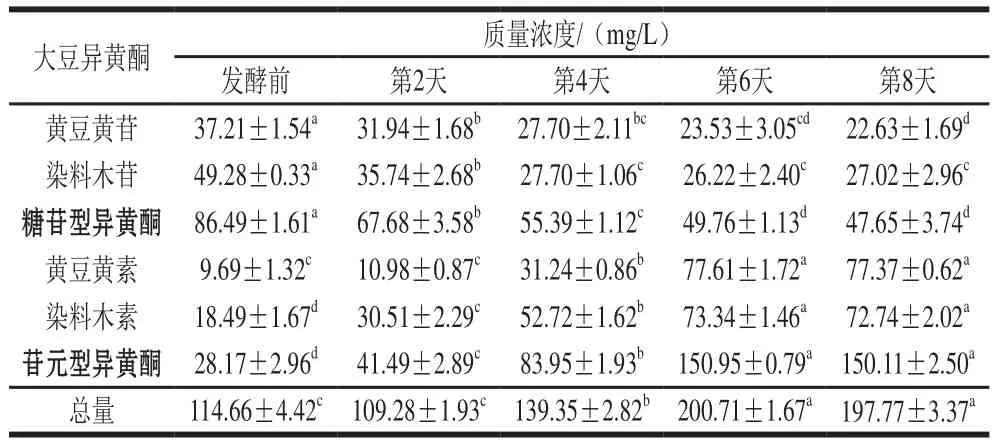
表3 發(fā)酵前后黃漿水體積分數(shù)80%甲醇溶液提取物中大豆異黃酮的質(zhì)量濃度Table 3 Soybean isoflavonoids composition of 80% methanol extracts from unfermented and fermented soy whey
表3結(jié)果表明,苷元型的物質(zhì)是由發(fā)酵前糖苷型的物質(zhì)轉(zhuǎn)化而來。已有很多研究表明,在微生物發(fā)酵后,大豆制品中苷元型物質(zhì)的含量顯著提高,這可能是由于微生物在發(fā)酵過程中產(chǎn)生的β-葡萄糖苷酶或是酸水解的作用,導(dǎo)致了苷元型物質(zhì)含量的增加[22-24];另一方面,與蛋白、脂肪等物質(zhì)相結(jié)合的黃酮類物質(zhì)可能在發(fā)酵前無法被檢測出,在發(fā)酵過程中逐漸被釋放,轉(zhuǎn)化成游離型的異黃酮,從而導(dǎo)致異黃酮總質(zhì)量濃度增加[25]。由于游離型的苷元已被證實具有更高的生物活性,且更易被人體小腸吸收利用[26]。因此,黃漿水可作為紅茶菌的一種新型發(fā)酵基質(zhì),從而為其賦予更高的營養(yǎng)價值。
2.5 發(fā)酵黃漿水的抗氧化活性
如圖4A所示,與未發(fā)酵黃漿水相比,發(fā)酵黃漿水對DPPH自由基的清除能力明顯提高,在樣品質(zhì)量濃度為0.25~10 mg/mL時,未發(fā)酵黃漿水的DPPH自由基清除率從5.22%提高至58.25%,而發(fā)酵黃漿水則從15.19%提高至93.19%。結(jié)果表明,發(fā)酵過程對提高DPPH自由基清除能力起著重要作用。Marazza等[27]利用鼠李糖乳桿菌發(fā)酵豆?jié){,發(fā)現(xiàn)發(fā)酵豆?jié){內(nèi)苷元型異黃酮質(zhì)量濃度增加,導(dǎo)致DPPH自由基清除率也隨之增加;苷元型異黃酮相較于其對應(yīng)的β-葡萄糖苷型前體具有更高的抗氧化活性。因此,推測苷元型大豆異黃酮質(zhì)量濃度的提高是DPPH自由基清除率提高的重要原因。
如圖4B所示,未發(fā)酵黃漿水和發(fā)酵黃漿水的ABTS陽離子自由基清除能力在0.25~4 mg/mL之間明顯提高。當(dāng)質(zhì)量濃度超過4 mg/mL時,兩者對ABTS陽離子自由基的清除能力分別維持在55%和80%左右。Dani等[28]認為酚類化合物的抗氧化能力具有濃度飽和上限,這意味著當(dāng)濃度超過飽和上限的時候,酚類化合物對ABTS陽離子自由基的清除能力不再增加。
如圖4C所示,未發(fā)酵黃漿水和發(fā)酵黃漿水的亞鐵離子還原力與樣品質(zhì)量濃度成正比。發(fā)酵黃漿水的亞鐵離子濃度從7.70 μmol/L增加至681.03 μmol/L,而未發(fā)酵黃漿水僅從15.37 μmol/L增加至253.24 μmol/L,可以看出經(jīng)過發(fā)酵的黃漿水明顯增強了亞鐵離子還原力。
從圖4D可知,隨著質(zhì)量濃度的增加,未發(fā)酵黃漿水和發(fā)酵黃漿水的還原力均增強。4~10 mg/mL時,發(fā)酵黃漿水的還原力明顯強于未發(fā)酵黃漿水。在6 mg/mL下,未發(fā)酵黃漿水的還原力為0.08,而發(fā)酵黃漿水為0.27,是未發(fā)酵黃漿水的3.4 倍。研究表明,發(fā)酵過程中微生物產(chǎn)生的一些還原酮物質(zhì)可以向自由基提供電子而使其更加穩(wěn)定,進而有利于終止自由基鏈?zhǔn)椒磻?yīng)的進行[29],因此發(fā)酵后的黃漿水具有更強的還原力。
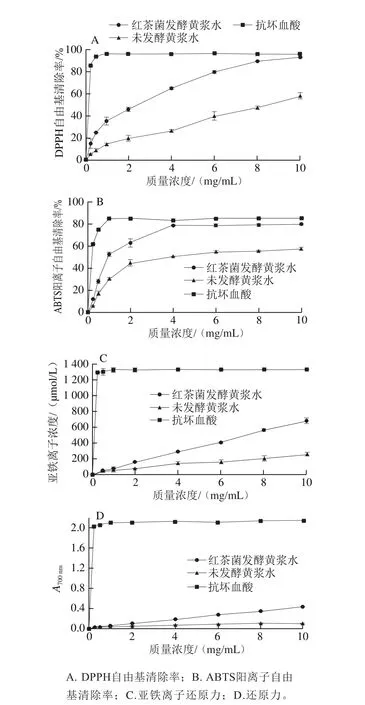
圖4 發(fā)酵前后黃漿水體積分數(shù)80%甲醇溶液提取物體外抗氧化活性Fig. 4 In vitro antioxidant activity of 80% methanol extracts from unfermented and fermented soy whey
事實上,紅茶菌發(fā)酵體系復(fù)雜,發(fā)酵液抗氧化活性的提高取決于多種因素,在發(fā)酵過程中,存在多種次級代謝產(chǎn)物,包括葡萄糖酸和葡萄糖醛酸。已有研究證明這些物質(zhì)具有鈣離子和鐵離子螯合劑的特性[30]。除此之外,發(fā)酵過程中的一些物理化學(xué)變化也會給黃漿水發(fā)酵產(chǎn)物的抗氧化活性帶來一定的影響[31-32]。
黃漿水的抗氧化活性與其EC50成反比。發(fā)酵黃漿水的DPPH自由基清除力、ABTS陽離子自由基清除力和還原力的EC50分別為1.660、1.306、11.339 mg/mL,顯著低于未發(fā)酵黃漿水(分別為9.108、4.584、821.722 mg/mL)(P<0.05)。上述結(jié)果表明,利用紅茶菌發(fā)酵黃漿水可明顯提高其抗氧化活性。
3 結(jié) 論
本研究以紅茶菌為菌種、以黃漿水為基質(zhì)進行發(fā)酵,得到具有功能活性的新型黃漿水發(fā)酵產(chǎn)品。本研究結(jié)果可支持一種改善營養(yǎng)價值和功能特性的紅茶菌發(fā)酵飲品的開發(fā)。經(jīng)發(fā)酵后的黃漿水營養(yǎng)和功能特性相比未發(fā)酵黃漿水明顯提高。相比于未發(fā)酵黃漿水,發(fā)酵至第6天黃漿水中的游離型苷元質(zhì)量濃度增加至(150.95±0.79)mg/L,是未發(fā)酵黃漿水的5.3 倍;黃豆黃素質(zhì)量濃度從(9.69±1.32)mg/L增加至(77.61±1.72)mg/L;染料木素質(zhì)量濃度從(18.49±1.67)mg/L增加至(73.34±1.46)mg/L。經(jīng)紅茶菌發(fā)酵后的黃漿水抗氧化活性明顯提高。本研究結(jié)果表明,苷元型大豆異黃酮質(zhì)量濃度的增加是發(fā)酵黃漿水抗氧化活性提高的重要原因。

