五福飲含藥血清對大鼠軟骨細胞腫瘤壞死因子-α 誘導凋亡軟骨細胞活性及基質金屬蛋白酶表達的影響
汪燦鋒 葉正從 沈欽榮 韓 雷 曹國平
骨關節炎(osteoarthritis,OA)是指由多種因素引起關節軟骨纖維化、脫落而導致的以關節疼痛為主要癥狀的一種退行性關節疾病,屬中醫“痹證”范疇,治療主要以活血通絡、溫經散寒、滋補肝腎等法為主。五福飲為明代醫家張景岳治療五臟氣血不足的代表方,通過前期臨床研究證實,其治療膝OA 療效確切,但具體作用機制尚不明確[1]。本實驗采用五福飲含藥血清培養退變關節軟骨細胞,研究五福飲對大鼠退變關節軟骨細胞活性及基質金屬蛋白酶(matrix metalloproteinase,MMPs)的影響,探討其防治關節軟骨退變的可能作用機制。現報道如下。
1 實驗材料
1.1 實驗動物 SPF 級雌性Wistar 大鼠30 只,體質量150~180g。由上海西普爾-必凱實驗動物有限公司提供,動物生產許可證號:SCXK(滬)2013-0016。飼養條件:所有大鼠均飼養在屏障環境內,每籠飼養6只,溫度(22±2)°C,濕度50%~60%,光照每12h 明暗交替,換風次數15~20 次/h。由浙江中醫藥大學動物實驗研究中心飼養。實驗飼養室許可證號SYXK(浙)2013-0184。本實驗經浙江中醫藥大學動物管理與倫理委員會審核通過。
1.2 主要儀器與試劑 細胞培養箱(美國Thermo Fisher Scientific,型號BB150),流式細胞儀(美國Becton,Dickinson and Company,型號Accuri C6),酶標儀(美國SpectiaMax,型號CMaxPius),電泳儀(天能,型號EPS300),電泳槽(天能,型號VE 180C),轉膜儀(天能,型號VE186),普通PCR 儀(德國Eppendorf,型號Mastercycler),核酸定量儀(美國Thermo Fisher Scientific,型號Nanodrop one),實時熒光定量PCR 儀(瑞士Roche,型號LightCycler)。
Anti-Rat TNF-α(美國PeproTech,貨號500-P72,批號AD36532623),Collagen II(英國Abcam,貨號ab34712,批號GR221316-10),DMEM 高糖培養基( 美 國 Hyclone, 貨 號 SH30243.01, 批 號AD24464275),胎牛血清(四季青,貨號11011-8611,批號20171203),MTT 試劑盒(BBI LIFE SCIENCES,貨號BS6334-500T,批號DB30FA0005),PBS 磷酸鹽 緩 沖 液(pH7.2 -7.4)(美 國 Hyclone 貨 號SH30256.01,批號AD22391274 ),二抗Alexa flour(594 美國Abcam,貨號ab150076,批號GR235615-2),DAPI(SIGMA,貨號D9542,批號NC45325V),RIPA 裂解液(Beyotime,貨號P0013D,批號10352),蛋白酶抑制劑(康為世紀,貨號60237,批號50321),BCA 蛋白定量試劑盒(Solarbio,貨號pc0020,批號20180328),化學發光檢測試劑(Solarbio,貨號PE0010,批號20181220),10%APS(Biosharp,貨號A600072-0025,批號DC20BA1005),PVDF 膜(瑞典GE Healthcare Life Sciences,貨號10600023,批號A16954279),Anti-collagen Ⅱ(美國abcam,貨號ab34712,批號GR198512-4),Anti-actin(華安,貨號EM21002,批號HK0824),Trizol(Sangon Biotech,貨號B548124-0500,批號E108KA7471),SYBR Green qPCR 試劑盒(康為世紀,貨號CW2601,批號H7825250),逆轉錄試劑盒(康為世紀,貨號cw2569m,批號30251)。
1.3 實驗藥品 硫酸氨基葡萄糖膠囊:本院藥劑科提供,商品名為伊索佳,浙江海正藥業股份有限公司生產,批號71805311,規格:0.314g/粒。五福飲制劑:根據《景岳全書》卷五十的方藥制備:黨參、熟地各30g,炒白術、當歸各20g,炙甘草10g,藥液濃縮至1mL 含生藥4g,由本院中藥制劑室提供。
2 實驗方法
2.1 動物分組及血清制備 2 月齡大鼠采用隨機數字表法分為生理鹽水組(生理鹽水灌胃)、硫酸氨基葡萄糖組(硫酸氨基葡萄糖灌胃)、五福飲組(五福飲灌胃),每組10 只。硫酸氨基葡萄糖成人的每天劑量依照說明書定為1.5g。按人-大鼠體表面積比值折算成相當于人臨床劑量20 倍量,給予大鼠口飼劑量,每100g 大鼠灌胃2mL 計算給藥濃度。隔天稱重算出相應劑量給藥物組灌胃,2 次/天,連續灌胃7 天。第7天,在灌胃2h 后予以眼球取血。經離心、滅活、過濾除菌后,4mL 每瓶分裝,貼好各組別血清標簽,-20℃保存備用。
2.2 軟骨細胞提取及培養 取2 只2 月齡雌性大鼠,脫頸處死,酒精消毒后移入超凈臺,提前備好含有1%雙抗的無菌PBS。在無菌條件下切取大鼠雙側髖、膝關節,經PBS 液漂洗后裝入無菌離心管并迅速轉移至細胞房生物柜。清理軟骨周圍的軟組織,刀片削取關節軟骨,再次經PBS 液清洗,剪碎至1mm3大小,裝入培養皿,加入膠原酶Ⅱ(0.3U/mL),37℃下恒溫消化4h。將消化后的細胞懸液經100μm 細胞篩網過濾,經1000r/min 離心5min,棄上清液,分別加入含10%FBS 的DMEM 培養液以1×105/mL 接種于培養瓶,置于5%CO2培養箱中進行傳代培養用于后續實驗。
2.3 軟骨細胞干預 培養第2 代軟骨細胞,分為以下四組進行藥物處理。參考文獻[2]采用20μg/L 腫瘤壞死因子-α 誘導軟骨細胞凋亡。分為四組:空白組采用0μg/L TNF-α+10%生理鹽水組血清;模型組采用20μg/L TNF-α+10%生理鹽水組血清;對照組采用20μg/L TNF-α+10%硫酸氨基葡萄糖組血清;觀察組采用20μg/L TNF-α+10%五福飲組血清,干預48h 后檢測相關指標。
2.4 指標檢測
2.4.1 Collagen II 表達檢測 細胞生長至指數期時,消化后制備細胞混懸液并計數,準備鋪板。具體方法如下:6 孔板每個孔中放入無菌高潔凈度蓋玻片,以60%~70%細胞密度即每孔5×105個細胞接種于蓋玻片上,每孔體積2mL。加入1~2mL 預冷的4%多聚甲醛(PFA),固定10min 后PBS 漂洗3 次,每次5min;每孔加入1mL 0.1% Triton X-100,處理2min,2mL PBS 漂洗3 次,每次5min;每孔加入2mL 3%BSA 室溫封閉30min;每個蓋玻片上滴加80μL Collagen II 一抗(稀釋比例1:50,稀釋液5% goat serum 溶液),4℃過夜孵育;一抗孵育結束后,經漂洗后每個蓋玻片上加入80μL 二抗(二抗稀釋比例為1:500,用5% goat serum 稀釋),室溫避光下孵育30min。后續步驟需避光操作;每孔加入2mLPBS,漂洗3 次,每次5min;每孔加入核染試劑1μg/mL DAPI 染色2min。經PBS 漂洗后保持濕潤,放入載玻片中在顯微鏡下觀察拍照。檢測各組細胞中Collagen II 的表達。
2.4.2 細胞增殖檢測 細胞生長至指數期時,消化后培養基制備單個細胞混懸液并計數,以每孔1000個細胞接種到96 孔板,每孔體積200μL。細胞單層貼壁鋪滿孔底后,按照上述分組給藥分別干預24、48、72h 后,每組3 個復孔。使用酶標儀檢測各孔吸光度值(酶標儀在490nm)。
2.4.3 細胞凋亡檢測 取對數生長期的軟骨細胞種植于放有無菌高潔凈度蓋玻片6 孔板,每孔2mL 工作體積,細胞接種密度為1.2×106,按上述分組分別與藥物共培養。各組干預后,棄培養液,取出蓋玻片,4%多聚甲醛室溫固定30min,PBS 清洗3 次,每次5min,1μg/mL DAPI 進行細胞核染色2min,染色結束后PBS 清洗并用指甲油封片。顯微鏡下觀察、計軟骨細胞的凋亡數量。
2.4.4 MMP-3、MMP-9、MMP-13 mRNA 檢測 用漩渦振蕩器將管中溶液徹底混合均勻,短暫低速離心。反應條件:95℃,10min 變性;95℃,15s;60℃,60s;40 次循環。將以上步驟中混合好的液體加入孔板中,每個樣本的每個基因保證3 個復孔。Real time PCR儀使用ABI7500 實時熒光定量PCR 儀,PCR 程序已優化。將以上已點好樣的8 連管板置于Realtime PCR 儀上進行PCR 反應。反應條件:95℃,10min 變性;95℃,15s;60℃,60s;40 次循環。內參引物均由上海生工生物有限公司設計及合成,引物設計序列:MMP -3:5' -ATGCAGGGAAAGTGACCCAC -3',5' -CGACGCCCTCCATGAAAAGA -3';MMP -9:5' -GTGCCCTGGAACTCACACAAC-3',5'-CCAGAAGTA -TTTGTCATGGCAGAA -3';MMP -13:5' -TGCTGC -ATACGAGCATCCAT-3',5'-TGTCCTCAAAGTGAACCGCA -3';ACTB:5' -GGGAAATCGTGCGTGACA -TT-3',5'-GCGGCAGTGGCCATCTC-3'。
2.5 統計學方法 應用SPSS 19.0 統計軟件進行數據分析,所有數據以均值±標準差表示,作圖采用GraphPad Prism 6.2 軟件。兩組間比較采用兩個獨立樣本的t 檢驗,多組間均數比較采用單因素方差分析,P<0.05 為差異有統計學意義。
3 結 果
3.1 含藥血清對大鼠軟骨細胞Collagen II 熒光表達的影響 與空白組比較,模型組、對照組和觀察組大鼠軟骨細胞Collagen II 平均熒光表達強度均降低(P<0.01,P<0.05);與模型組比較,對照組和觀察組大鼠軟骨細胞Collagen II 熒光表達升高(P<0.05,P<0.01)。觀察組大鼠軟骨細胞Collagen II 熒光表達低于對照組(P<0.01),見表1,插頁圖1。
表1 各組大鼠軟骨細胞Collagen II 免疫熒光表達量比較

表1 各組大鼠軟骨細胞Collagen II 免疫熒光表達量比較
注:與空白組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05,△△P<0.01;與對照組比較,▲P<0.01;空白組:采用0μg/L TNF-α+10%生理鹽水組血清;模型組:采用20μg/L TNF-α+10%生理鹽水組血清;對照組:采用20μg/L TNF-α+10%硫酸氨基葡萄糖組血清;觀察組:采用20μg/L TNF-α+10%五福飲組血清;Collagen II:膠原蛋白II
組別空白組模型組對照組觀察組孔數3 3 3 3平均熒光強度值70.92±3.72 43.39±1.52**62.92±5.32*△△53.33±2.33**△▲
3.2 含藥血清對大鼠軟骨細胞增殖能力的影響 與空白組比較,24、48 和72h 給藥時間點的模型組大鼠軟骨細胞OD 值均顯著降低(P<0.01),給藥24h 后,對照組和觀察組大鼠軟骨細胞OD 值也顯著低于空白組(P<0.01);與模型組比較,對照組和觀察組大鼠軟骨細胞OD 值稍有升高,但差異無統計學意義(P>0.05)。給藥48h 后,對照組和觀察組大鼠軟骨細胞OD 值均低于空白組,高于模型組(P<0.05,P<0.01)。給藥72h 后,對照組和觀察組大鼠軟骨細胞OD 值均低于空白組(P<0.05);與模型組比較,對照組和觀察組大鼠軟骨細胞OD 值顯著升高(P<0.01);24、48和72h 時間點觀察組與對照組比較,差異無統計學意義(P>0.05),見表2。
表2 給藥24、48、72h 各組大鼠軟骨細胞OD 值比較

表2 給藥24、48、72h 各組大鼠軟骨細胞OD 值比較
注:與空白組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05,△△P<0.01;空白組:采用0μg/L TNF-α+10%生理鹽水組血清;模型組:采用20μg/L TNF-α+10%生理鹽水組血清;對照組:采用20μg/L TNF-α+10%硫酸氨基葡萄糖組血清;觀察組:采用20μg/L TNF-α+10%五福飲組血清;OD 值:吸光度值
組別空白組模型組對照組觀察組孔數3 3 3 3 24h 0.396±0.017 0.297±0.014**0.342±0.021**0.316±0.028**48h 0.470±0.018 0.333±0.021**0.414±0.029*△△0.394±0.028**△72h 0.570±0.031 0.361±0.014**0.510±0.035*△△0.493±0.030*△△
3.3 含藥血清對大鼠軟骨細胞凋亡的影響 經DAPI 熒光染色后,熒光顯微鏡下觀察可得,空白組細胞核圓潤完整,分布均勻熒光明亮,模型組細胞核出現碎裂,有較多不完整的細胞核,局部染色質出現的熒光高度集中。對照組和觀察組的細胞核部分出現凝聚,有少量的核碎片。見插頁圖2。
3.4 含藥血清對大鼠軟骨細胞MMP-3、MMP-9、MMP-13 mRNA 水平的影響 與空白組比較,模型組、觀察組大鼠軟骨細胞MMP-3、MMP-9、MMP-13及對照組MMP-9 mRNA 水平顯著升高(P<0.01,P<0.05)。與模型組比較,對照組和觀察組大鼠軟骨細胞MMP-3、MMP-9、MMP-13 mRNA 水平顯著下降(P<0.01,P<0.05)。與對照組比較,觀察組大鼠軟骨細胞MMP-3 顯著升高(P<0.05),MMP-9、MMP-13 表達差異無統計學意義(P>0.05)。
表3 各組大鼠軟骨細胞MMP-3、MMP-9、MMP-13 mRNA水平比較
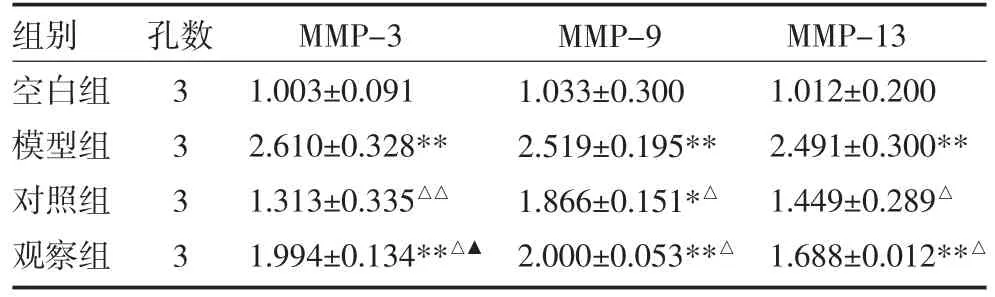
表3 各組大鼠軟骨細胞MMP-3、MMP-9、MMP-13 mRNA水平比較
注:與空白組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05,△△P<0.01;與對照組比較,▲P<0.05;空白組:采用0μg/L TNF-α+10%生理鹽水組血清;模型組:采用20μg/L TNF-α+10%生理鹽水組血清;對照組:采用20μg/L TNF-α+10%硫酸氨基葡萄糖組血清;觀察組:采用20μg/L TNF-α+10%五福飲組血清;MMP:基質金屬蛋白酶
組別空白組模型組對照組觀察組孔數3 3 3 3 MMP-3 1.003±0.091 2.610±0.328**1.313±0.335△△1.994±0.134**△▲MMP-9 1.033±0.300 2.519±0.195**1.866±0.151*△2.000±0.053**△MMP-13 1.012±0.200 2.491±0.300**1.449±0.289△1.688±0.012**△
4 討 論
軟骨破壞是OA 的主要病理特征。關節軟骨破壞包括軟骨細胞自身降解軟骨細胞外基質和炎癥滑膜、血管翳組織、浸潤的炎癥細胞通過關節滑液(synovialfluid,SF)破壞軟骨細胞外基質,兩種途徑中酶性降解細胞外基質是軟骨破壞的主要原因[3]。研究表明,在各種蛋白酶中,MMPs 在關節軟骨破壞中起重要作用,主要表現為:(1)通過阻斷蛋白聚糖和Ⅱ型膠原,使得關節軟骨纖維結構遭到破壞;(2)MMPs特異性裂解膠原分子,膠原網損傷,炎性因子能直接攻擊軟骨細胞,最終導致關節炎[4]。MMPs 家族龐大,按其作用底物,主要分為膠原酶(MMP-1、MMP-8 和MMP-13)、基質溶解素(MMP-3、MMP-7、MMP-10和MMP-11)和明膠酶(MMP-2 和MMP-9)等亞家族,其中MMP-3、MMP-9、MMP-13 是關節軟骨基質降解中最重要的酶[5-7]。目前一些OA 的治療研究中[8-9],通過下調MMPs 的表達,促進軟骨細胞形成,起到治療目的。通過調控MMPs 將可以延緩OA 進展,可作為OA 中重要的治療靶點以作研究。
目前中醫藥治療OA 仍是主要的保守治療方式[10],根據《中醫骨傷科常見病診療指南》,目前OA 中藥治療主要以活血化瘀法,溫經散寒、養血通脈法,滋補肝腎法為主。筆者通過前期臨床治療總結,結合明代醫家張景岳《傳忠錄·治形論》中“中年修復”觀點,認為中老年OA 的診治,需要注重強形體,補五臟氣血,遂用五福飲治療膝OA。五福飲見于張景岳的《景岳全書》,該方藥性平和,五味藥歸五臟,主治五臟氣血虧損。筆者前期在臨床取得滿意療效[1],但其具體作用機制尚未完全清晰,本研究通過五福飲含藥血清培養凋亡軟骨,觀察相關指標,探究五福飲治療OA 相關作用機制。
本研究以TNF-α 誘導軟骨細胞凋亡為OA 的細胞模型[2],檢測五福飲含藥血清對模型下的Collagen II 熒光表達、軟骨細胞軟骨細胞增殖、凋亡及MMPs的影響。實驗結果顯示,經五福飲血清作用后觀察組大鼠軟骨細胞Collagen II 表達較空白組低,但較模型組高(P<0.05),與陽性藥物對照組比較,Collagen II 表達降低(P<0.05);在軟骨細胞增殖和凋亡方面,與空白組比較,模型組細胞OD 值均顯著降低(P<0.01)而與模型組比較,對照組和觀察組細胞OD 值稍有升高,但差異無統計學意義;熒光染色后,顯微鏡下可觀察到空白組的細胞核圓潤完整,分布均勻熒光明亮,模型組細胞核出現碎裂,有較多不完整的細胞核,局部染色質出現的熒光高度集中,對照組和觀察組的細胞核部分出現凝聚,有少量的核碎片。對照組和觀察組MMP-3、MMP-9、MMP-13 mRNA 水平較模型組顯著下降(P<0.01 或P<0.05),MMP-9、MMP-13 mRNA 表達同對照組差異無統計學意義。
綜上所述,通過降低軟骨細胞MMPs 的表達來延緩OA 軟骨細胞凋亡的進程,可能是五福飲治療OA 的作用機制之一。[本文受到杭州市蕭山區重大科技項目資助(No.2017213)]

