南瓜未授粉子房和胚珠離體培養影響因素
張蕾琛,孫楠,王迎兒,應泉盛,嚴蕾艷,黃蕓萍,王毓洪,王潔
(寧波市農業科學研究院 寧波市瓜菜育種重點實驗室,浙江 寧波 315040)
培育單倍體植株在遺傳學基礎研究和植物育種中具有重要意義。1922年,意大利的植物學家Blakeslee首次在曼陀羅中發現了自然產生的單倍體植株[1],引起了植物學家和育種家的廣泛關注。隨后,植物學家開始了離體誘導單倍體植株再生的研究。離體雌核發育是指通過離體培養未受精子房或胚珠,使子房中大孢子或雌配子體向孢子體途徑轉變,從而產生單倍體或雙單倍體植株的過程[2]。相對于離體雄核發育,離體雌核發育的研究歷史較短,且由于植物本身生理因素和技術等方面的原因,利用離體雌核培養獲得單倍體植株的技術體系并不完善和成功。但離體雌核發育具有其獨特的價值,尤其在雄核發育誘導單倍體尚未成功或誘導率太低,白化苗率高,雄性不育植株及雌雄異株等植物中,離體雌核發育是獲得優良單倍體植株的唯一可行途徑[3-4]。此外,在某些材料的離體雄核培養中,植株表現明顯的性狀變異和倍性變異,而離體雌核培養的后代則較為穩定。因此,離體雌核發育作為離體雄核發育的補充,為單倍體誘導提供了另外一條有效的途徑[5]。
葫蘆科植物的離體雄核培養難度極大且成功率很低,因此,離體雌核培養技術已成為獲得葫蘆科植物單倍體的重要途徑[6]。南瓜(Cucurbitamoschata)是葫蘆科重要的蔬菜作物之一,擁有“世界性蔬菜”的美稱,具有豐富的營養和保健功能[7],獲得雙單倍體純系植株對于加快南瓜育種進程具有重要意義。國內外對葫蘆科植物離體雌核培養的研究已有報道[8-11],但鮮見在南瓜中報道,且受基因型影響較大[12-13]。本研究以11個砧木型南瓜一代雜交品種的未授粉子房或胚珠為外植體,對影響南瓜未授粉子房或胚珠離體誘導胚狀體的主要因素進行了探索,為完善南瓜離體雌核培養技術體系及育種應用提供了理論支持。
1 材料與方法
1.1 材料
試驗材料均由寧波市農業科學研究院提供的11份砧木型南瓜一代雜交品種,其中包括2份西葫蘆雜交材料(X1、X2)、5份中國南瓜雜交材料(Z1、Z2、Z3、Z4和Z5)、3份印度南瓜雜交材料(Y1、Y2和Y3)和1份印中雜交南瓜材料Y4。于2017—2018年3月中旬育苗,4月下旬定植于寧波高新農業技術試驗園區。
1.2 方法
1.2.1 外植體取樣
在開花前1 d進行扎花,以確保未授粉。取開花當天的未授粉子房作為外植體,盡量選取自生長健壯的植株。
1.2.2 外植體處理與消毒
用無菌水清洗外植體表面,用解剖刀除去花瓣和柱頭部分。
對11份南瓜材料的外植體進行以下操作:削去表皮,將子房縱切成4塊,用75%酒精消毒30 s,無菌水沖洗1次,用3% NaClO消毒8 min,用無菌水沖洗6次,用解剖刀削去子房壁組織,用接種針剝離出胚珠,接種在誘導培養基上。
對南瓜材料X1的外植體進行如下3種操作:1)削去表皮,將子房橫切成1~2 mm厚的切片,用75%酒精消毒30 s,無菌水沖洗1次,用3% NaClO消毒8 min,用無菌水沖洗6次,接種在誘導培養基上。2)削去表皮,將子房縱切成1~2 mm厚的切片,用75%酒精消毒30 s,無菌水沖洗1次,用3% NaClO消毒8 min,用無菌水沖洗6次,接種在誘導培養基上。3)削去表皮,將子房縱切成4塊,用75%酒精消毒30 s,無菌水沖洗1次,用3% NaClO消毒8 min,用無菌水沖洗6次,用解剖刀削去子房壁組織,用接種針剝離出胚珠,將其接種在誘導培養基上。
誘導培養基用IM-4,接種后的外植體在35 ℃黑暗下熱激5 d后,置于光照(3 500 lx)16 h、25 ℃培養箱中培養,后續觀察其外植體處理方式對誘導胚珠膨大、轉綠的影響。
1.2.3 誘導培養基及影響因子
誘導培養基是以Murashige and Skoog(1962)作為基本培養基,包括大量元素、微量元素和維他命。
8組誘導培養基中添加不同濃度的激素,具體為IM-1(5.00 mg·L-12,4-D)、IM-2(4.00 mg·L-12,4-D+1.00 mg·L-16-BA+0.50 mg·L-1NAA)、IM-3(4.00 mg·L-12,4-D+1.00 mg·L-16-BA+0.25 mg·L-1NAA)、IM-4(4.00 mg·L-12,4-D+0.50 mg·L-16-BA+0.50 mg·L-1NAA)、IM-5(1.00 mg·L-12,4-D)、IM-6(1.00 mg·L-12,4-D+1.00 mg·L-1KT)、IM-7(1.00 mg·L-16-BA+0.10 mg·L-1NAA)和IM-8(0.04 mg·L-1TDZ)。
所有培養基中均添加3%的蔗糖和0.8%的瓊脂,pH調至5.7~5.8,在121 ℃高壓滅菌20 min。
1.2.4 胚狀體的獲得
接種后的外植體在35 ℃黑暗下熱激5 d后,置于光照(3 500 lx)16 h、25 ℃培養箱中6周,之后在無添加激素的MS培養基中培養,觀察胚狀體的形成。
南瓜材料X1,剝取胚珠后接種在IM-4誘導培養基上。對外植體分別進行0、3、5和7 d不同時間長度的35 ℃黑暗下熱激處理,再置于光照(3 500 lx)16 h、25 ℃培養箱中培養,觀察不同條件下胚珠膨大和轉綠的比率。
1.2.5 數據分析
熱激完成后記錄膨大的胚珠數目,25 ℃光下培養7 d后記錄胚珠轉綠數;培養6周后,記錄胚狀體個數。計算胚珠膨大率、胚珠轉綠率、胚狀體誘導率和成苗率。利用SPSS軟件對以上各數據進行方差分析和鄧肯多重比較分析。
2 結果與分析
2.1 不同基因型對胚狀體誘導的影響
不同基因型供體材料在相同誘導條件下對培養的反應不一致,對胚狀體誘導有不同程度的表現(表1,圖1)。不同基因型對誘導胚珠膨大(P=0.003)、胚珠轉綠率(P=0.001)和胚狀體誘導率(P=0.001)有顯著影響。其中,胚狀體誘導率最高的是西葫蘆組合X1(6.9%),其次是中國南瓜組合Z1(3.8%)和西葫蘆組合X2(3.7%)。胚珠膨大率最高的是印度南瓜組合Y2(90.5%),但其胚珠轉綠率和胚狀體誘導率都不高。中國南瓜組合Z3、Z4、Z5和印度南瓜組合Y1、Y3,以及印中雜交組合Y4雖然都有一定程度的胚珠膨大和轉綠,但卻未誘導出胚狀體。從不同南瓜類型看,西葫蘆總體比中國南瓜和印度南瓜更易誘導出胚狀體。

表1 不同基因型對胚狀體誘導的影響
注:同列不同小寫字母表示在0.05水平上差異顯著(表2~5同)。
2.2 不同濃度激素處理對胚狀體誘導的影響
不同激素對胚狀體的誘導結果見表2。不同培養基對胚珠膨大率的影響不顯著(P=0.129),但對胚珠轉綠率(P<0.001)和胚狀體誘導率(P=0.001)影響顯著。其中,培養基IM-3胚狀體誘導率最高(4.8%);培養基IM-8胚珠轉綠率和胚狀體誘導率都較低。同時發現,外植體在添加2,4-D的培養基長久培養,轉綠的胚珠會漸漸黃化后發白。

A,從未授粉子房剝離出的胚珠;B,在誘導培養基上膨大轉綠的胚珠;C,誘導出的胚狀體;D,胚狀體初步誘導植株。圖1 南瓜材料Y2未受精胚珠的胚狀體誘導及植株再生
2.3 不同基因型和不同濃度激素互作效應對胚狀體誘導的影響
不同基因型和不同濃度激素互作效應對胚珠的膨大率(P=0.015)、胚珠轉綠率(P=0.018)和胚狀體的誘導率(P<0.001)都有顯著影響。由表3可知,西葫蘆材料X2培養基IM-4的誘導胚狀體效率最高(15.0%)。
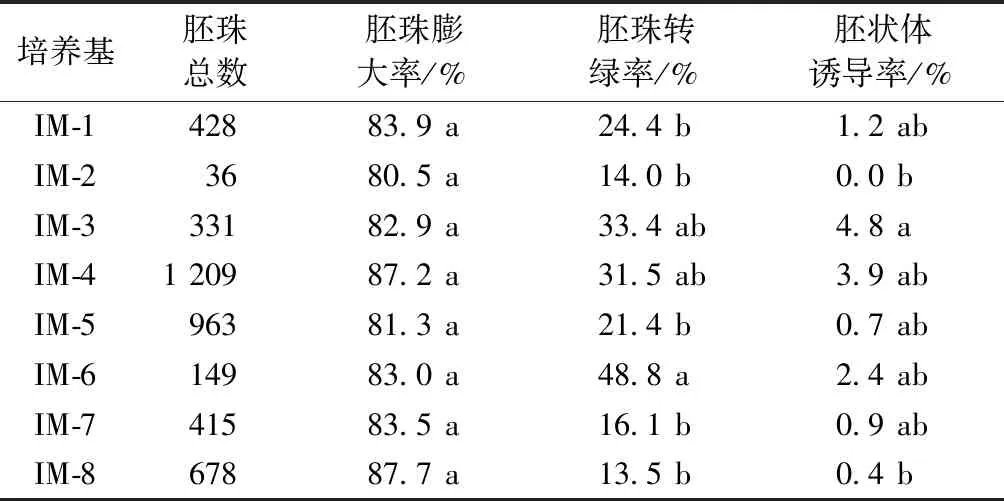
表2 不同濃度激素對胚狀體誘導的影響

表3 不同基因型和不同濃度激素對胚狀體誘導的影響
2.4 外植體不同切片方式對胚狀體誘導的影響
本試驗通過對南瓜材料X1外植體不同的切片方式來研究其對胚狀體誘導的影響。表4表明,子房縱切法對胚狀體的誘導率顯著最低,子房橫切片和胚珠剝離對胚珠膨大轉綠及胚狀體誘導的差異不顯著,但在操作方法上各有利弊。子房橫切片操作相對簡單,操作快,可同時處理的材料數量較多,但子房切片的厚度和子房除去胚珠的周邊組織都會影響胚狀體的誘導,一方面切面會誘導愈傷組織的產生,一方面誘導出的植株存在可能是胎座細胞誘導產生的可能性。胚珠剝離的方法較繁瑣,且材料本身的胚珠大小對離體胚珠培養也有一定的影響,相對小的胚珠容易在剝離的時候產生傷口而導致愈傷,有些則易發白而難以轉綠(圖2)。
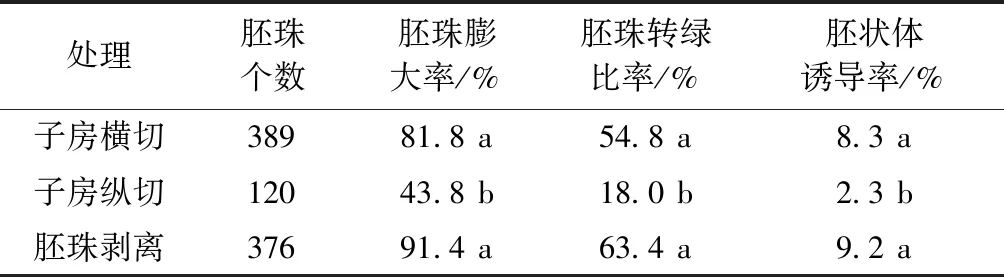
表4 外植體不同切片方式對胚狀體誘導的影響

A,子房橫切片;B,在誘導培養基上膨大轉綠的胚珠;C,子房縱切片;D,從未授粉子房剝離出的胚珠。圖2 外植體不同切片處理誘導胚狀體
2.5 不同熱激處理時間對胚狀體誘導率的影響
通過對南瓜材料X1外植體不同熱激處理時間來研究其對胚狀體誘導的影響,表5顯示,不同熱激處理對誘導胚珠膨大(P<0.001)和胚珠轉綠(P=0.001)有顯著影響。相比之下,熱激處理可促進胚珠的膨大和轉綠,其中處理5 d的胚珠膨大和轉綠的比率最高。
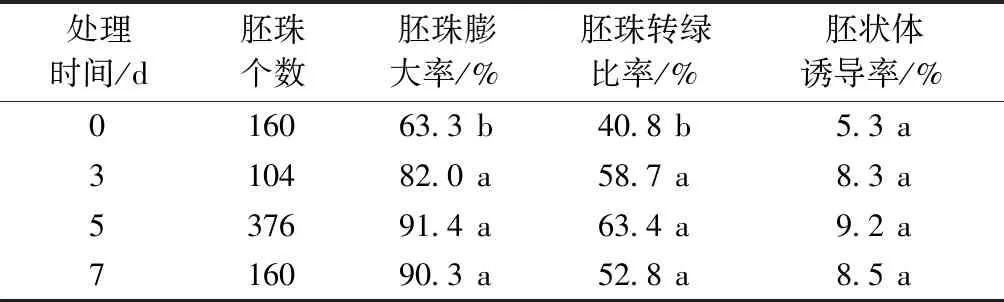
表5 外植體不同熱激處理時間對胚狀體誘導的影響
3 討論
孫守如等[12]研究表明,從南瓜未授粉子房中剝離出的胚珠在誘導培養基上培養3 d后,胚珠明顯膨大,顏色變為黃白色。光照培養約18 d后,形成淺綠色且具光澤的球形胚。大約在誘導培養的20 d,球形胚發育成典型的心形胚,并逐漸與母體胚珠組織分離。將心形胚轉移至未添加任何激素的培養基上進行成苗培養,1周后轉變為子葉胚。
本研究統計不同因素影響下不同基因型南瓜品種離體雌核的胚珠膨大率、胚珠轉綠率和胚狀體誘導率發現,胚珠膨大對誘導胚狀體的產生并不產生直接關系,只有膨大且轉綠的胚珠才有可能誘導形成胚狀體。因此,胚珠膨大后進行光照培養形成淺綠色球形胚的時期是誘導產生胚狀體的關鍵時期。
影響植物未受精胚珠孤雌生殖的因素眾多。研究發現,未授粉子房胚狀體的誘導率存在明顯的基因型依賴性[14],且胚狀體誘導率較高的南瓜品種均為長勢較強、細胞分裂較活躍、植株生理狀態較好的材料[13]。在本研究中,11個供試材料中只有5個成功誘導出胚狀體,其他6個材料的胚珠離體培養后,雖有不同程度的膨大和轉綠,但胚狀體誘導率均為0,說明這些基因型的品種對誘導培養的反應較遲鈍。
大量研究表明,外源激素是影響植物未受精胚珠誘導出胚的決定性因素,但不同研究者使用的種類和濃度卻不完全相同。孫守如等[12]研究發現,2,4-D、NAA和6-BA組合有利于南瓜未受精胚珠離體培養胚狀體的形成,出胚效果最好的培養基為MS+1.00 mg·L-12,4-D+0.25 mg·L-1NAA+0.50 mg·L-16-BA,出胚率達31.1%。而閔子揚等[13]的結果表明,南瓜未受精子房在MS+4.00 mg·L-12,4-D+0.50 mg·L-1NAA+1.00 mg·L-16-BA和MS+0.04 mg·L-1TDZ兩種培養基上離體培養胚狀體的誘導率均較高,分別為19.8%和20.1%。劉栓桃等[15]認為,開花當天的西葫蘆未受精胚珠在含5%蔗糖和0.8%瓊脂的N6基本培養基中添加0.50 mg·L-1NAA和1.00 mg·L-12,4-D最有利于誘導植株再生。程慧等[16]在MS培養基中添加1.00 mg·L-16-BA和0.50 mg·L-1NAA時,對西葫蘆未受精子房胚狀體的誘導效果最好,誘導率為19.8%。本研究發現,在MS+4.00 mg·L-12,4-D+1.00 mg·L-16-BA+0.25 mg·L-1NAA的培養條件下出胚率最高,且不同基因型和不同濃度激素對胚狀體的誘導存在互作效應,西葫蘆材料X2在MS+4.00 mg·L-12,4-D+0.5 mg·L-16-BA+0.5 mg·L-1NAA的培養條件下誘導胚狀體效率最高(15.0%),這可能是因為不同基因型材料中的內源激素存在差異,導致不同基因型材料對不同激素誘導胚狀體產生的效率也不盡相同。
本研究發現,采用子房縱切的方法對胚狀體的誘導率較低,這可能與胎座分布有關,子房縱切使得胚珠都密集在一個剖面上,由于切片僅1~2 mm,導致表面胚珠易被切到而產生愈傷。但子房橫切片和胚珠剝離對胚珠膨大轉綠及胚狀體誘導不存在顯著性差異,這與孫守如等[12]的研究存在不一致。孫守如等[12]認為,南瓜未受精胚珠離體培養的出胚率(最高為32.2%)高于子房培養的出胚率(最高為20.6%),這可能是因為剝離胚珠在試驗操作上存在一定難度,操作不當易使胚珠產生傷口而難以轉綠形成胚狀體。研究表明,在葫蘆科植物中,對外植體進行35~40 ℃高溫預處理可提高其孤雌生殖頻率,但具體機理目前尚不清楚[12]。本研究中,35 ℃高溫預處理5 d,胚珠膨大轉綠和胚狀體誘導的比率最高。

