DEB-TACE治療消化道腫瘤肝轉移的初步觀察
李 臻,李 鑫,白亮亮,紀 坤,詹鵬超,任建莊,段旭華,韓新巍
鄭州大學第一附屬醫院放射介入科鄭州450052
肝臟是腫瘤發生血行轉移最常見的部位之一,由于肝轉移癌常多發,外科切除率并不高,因此姑息性治療成為肝轉移癌主要的治療方式,方法有全身化療、經動脈化療栓塞術(transarterial chemoembolization,TACE)、射頻消融術、靶向治療、放射治療等,其中TACE因具有微創、可重復性強、療效確切等優勢,已經成為治療肝轉移癌的重要手段[1]。栓塞劑是影響TACE療效的主要因素之一。傳統TACE(c-TACE)常采用碘油與化療藥物乳劑作為栓塞劑,但肝轉移瘤是一種乏血供腫瘤,使得碘油沉積不良;因此栓塞效果不盡如人意。近年來載藥微球(drug-eluting bead,DEB)作為新型栓塞劑,逐步應用于臨床。用加載緩釋藥物的DEB栓塞腫瘤血管床可具有雙重治療作用,已初步顯示出對肝轉移癌有療效[2]。本文分析了DEB-TACE治療的25例消化道腫瘤肝轉移患者的資料,并與c-TACE治療的23例進行對比分析,探討DEB-TACE治療肝轉移癌的可行性、安全性及近期療效。
1 臨床資料
1.1 一般資料 病例納入標準:經影像學或病理學確診的消化道腫瘤肝轉移患者,無法切除或拒絕外科手術;臨床治療后腫瘤復發者;無心、腦、腎等重要臟器功能障礙;年齡18~85歲。排除標準:肝功能嚴重障礙(Child-Pugh C級)者,包括黃疸、肝性腦病、難治性腹水或肝腎綜合征;嚴重凝血功能障礙者;門靜脈主干完全阻塞,且側支血管較少者;惡病質或多器官功能衰竭者;腎功能障礙(尿肌酐>20 mg/L或者肌酐清除率<30 mL/min)者;妊娠期患者。2016年5月至2018年12月我科收治的符合上述標準的消化道腫瘤肝轉移患者48例,均接受化療栓塞治療。DEB-TACE治療25例,其中男20例,女5例,年齡31~75(59.9 ±3.3)歲;結直腸癌肝轉移17例,胃癌肝轉移8例;16例原發灶已切除;8例有單個肝轉移灶,17例有多個轉移灶。c-TACE治療23例,其中男15例,女8例,年齡27~77(60.1±10.0)歲;結直腸癌肝轉移16例,胃癌肝轉移7例;13例原發灶已切除;3例有單個肝轉移灶,20例有多個轉移灶。
1.2 介入手術 術前完善影像學檢查(CT/MRI平掃+增強掃描)、心電圖、實驗室檢查等,明確診斷。患者簽署治療知情同意書。介入手術器械:5F鞘管、5FRH 導管(美國庫克公司),0.889 mm(0.035英寸)親水膜導絲、微導管系統2.7F(日本泰爾茂醫療產品有限公司),直徑100~300μm及300~500 μm CalliSpheres微球、罌粟乙碘油(江蘇恒瑞醫藥股份有限公司)。
DEB的制備:術前30 min開始載藥。以20 mL注射器抽出全部微球,然后將注射器豎立放置2~3 min,直至微球沉降、分層明顯,去除上清液。用10 mL注射器抽取注射用水或50 g/L葡萄糖水溶解待載藥物,確認化療藥物完全溶解。將微球與化療藥物混合,每5 min輕搖1次,共6次。加載藥物完畢后,按1∶1比例加入對比劑,接三通及另一注射器充分混勻備用。
介入手術操作:患者仰臥位,心電監護。雙側腹股溝區消毒鋪巾。一般行右股動脈穿刺,置入5F鞘管。引入親水膜導絲及5FRH導管,行肝動脈造影,明確腫瘤供血動脈,必要時以微導管超選。根據病理結果選擇個體化化療藥物,依據轉移灶大小、數目、血供情況選擇DEB大小(表1)。緩慢推注預先配制好的DEB栓塞腫瘤血管床,直至造影示腫瘤無染色。c-TACE術中操作與DEB-TACE相同,以碘油乳劑栓塞腫瘤血管床,直至造影示腫瘤無染色。
術后主要針對栓塞后綜合征(惡心、嘔吐、腹痛、發熱)常規給予對癥處理,包括止吐、止疼、保肝、預防感染等。

表1 DEB方案
1.3 療效評估 ①分析患者術前、術后1周、術后1個月的血常規、肝腎功能、凝血功能等實驗室指標,包括谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、總膽紅素(TBIL)、凝血酶原時間(PT)、血尿素氮(BUN)、白細胞計數(WBC)、血小板計數(PLT)。②記錄患者術前及術后1、3、6個月的CT或MRI檢查結果,根據實體瘤療效評價標準(mRECIST)[3]評價療效,分為完全緩解(CR)、部分緩解(PR)、疾病穩定(SD)和疾病進展(PD),死亡病例歸為PD。CR+PR為疾病客觀緩解,CR+PR+SD為疾病控制。
1.4 統計學處理 應用SPSS 23.0進行數據處理。兩組疾病客觀緩解率、控制率及主要并發癥發生率的比較采用χ2檢驗,治療前后實驗室指標的比較應用重復測量數據的方差分析,檢驗水準α=0.05。
2 結果
2.1 治療效果 典型病例DSA表現見圖1。DEBTACE組25例中,有3例隨訪時間未達6個月;c-TACE組23例隨訪時間均達6個月。兩組不同時間點疾病客觀緩解率和控制率差異均無統計學意義(表2)。
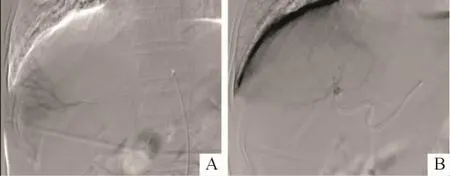
圖1 典型病例DSA表現
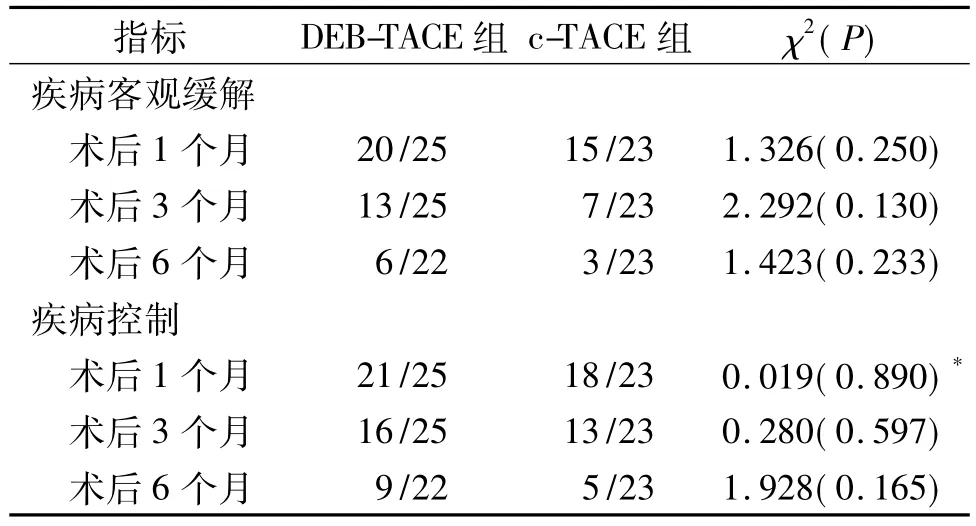
表2 兩組不同隨訪時間疾病客觀緩解和疾病控制狀況的比較 例
2.2 兩組實驗室指標的比較 兩組患者術前及術后1個月內實驗室指標檢測結果見表3。兩組患者均主要表現出一過性ALT升高及WBC升高。
2.3 并發癥發生情況 患者術前均預防性應用鎮痛及止吐藥物,部分患者術中出現腹痛,可耐受。兩組術后均未發生嚴重并發癥,兩組術后栓塞后綜合征發生率差異無統計學意義(表4)。
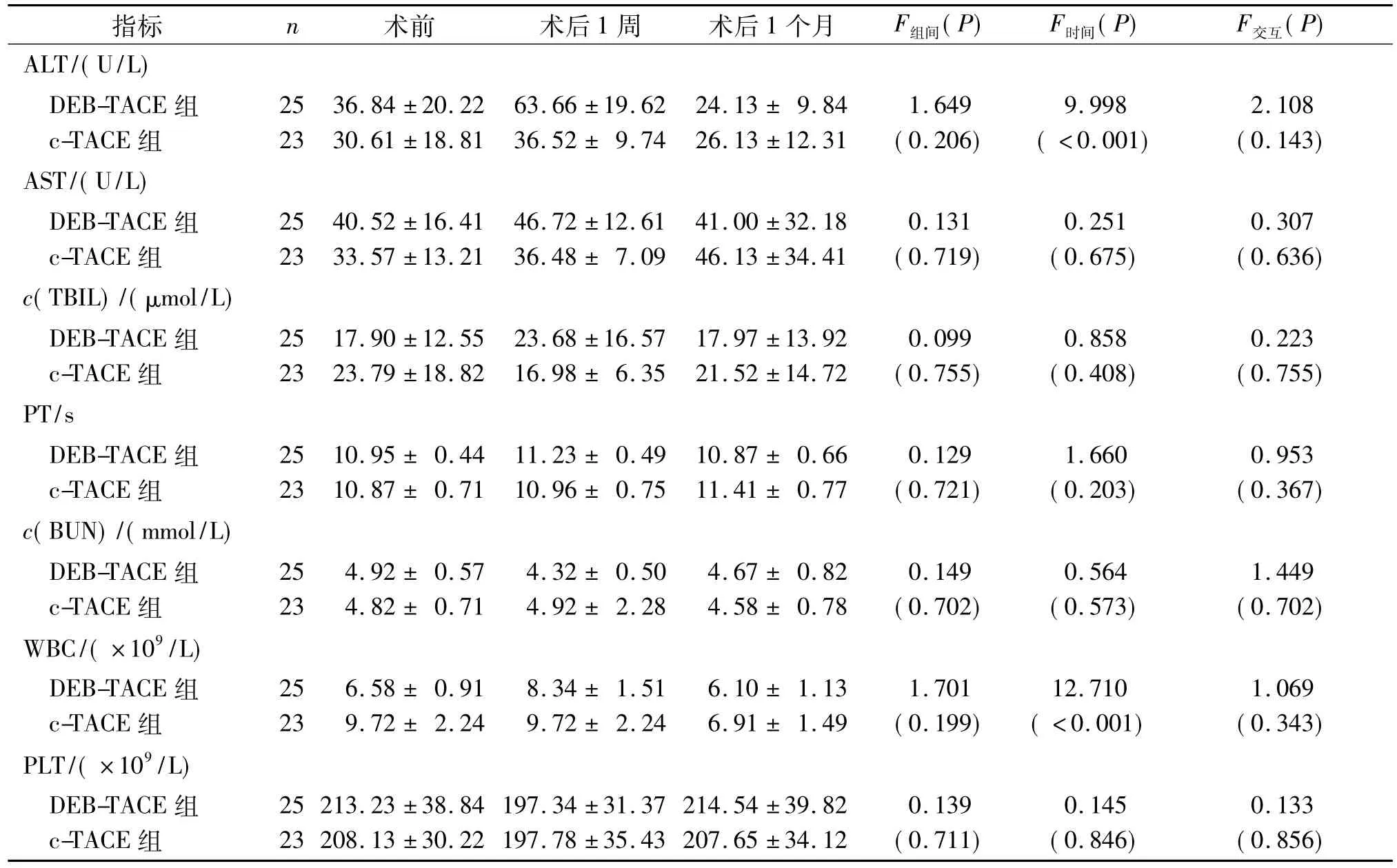
表3 兩組實驗室指標的比較

表4 兩組術后栓塞后綜合征發生情況的比較 例
3 討論
肝轉移癌最常見于消化道惡性腫瘤,尤以結直腸癌、胃癌多見,25% ~50%的結腸癌患者確診時已出現肝轉移[4],胃癌的肝轉移發生率亦較高,為4% ~14%[5]。臨床對于消化道癌肝轉移的治療主要有外科切除、內科化療及介入治療,肝功能基礎較好的寡轉移灶,可以外科切除或消融治療;但肝轉移灶主要表現為多發,接受內科化療或免疫治療者居多。c-TACE作為介入治療的代表性技術,最早用于肝癌的治療,并取得了顯著效果,但c-TACE亦存在諸多臨床缺陷:①由于肝腫瘤是一種既乏血供又多重血供的腫瘤,加之碘油本身的易流動性,導致碘油沉積不良,易發生腫瘤血管再通。②碘油可通過肝血竇進入瘤周的門靜脈,最后沉積在正常肝組織中。反復使用碘油會嚴重損害肝功能[6]。③碘油與化療藥物結合不牢固,易致化療藥物進入體循環,引起全身毒性。
與碘油相比,DEB具有以下特點:微球形態均勻、規則,粒徑規格齊全,能更好地栓塞腫瘤供血動脈;DEB可在腫瘤組織內持續、緩慢釋放抗腫瘤藥物,使腫瘤組織中藥物濃度顯著增加[7],有效控制轉移癌的復發;微球與抗腫瘤藥物結合牢固,可使進入體循環的藥物明顯減少,減輕藥物的毒副作用。當前DEB-TACE在治療原發性肝癌領域應用廣泛,且取得滿意療效[8-9]。
關于DEB-TACE治療消化道腫瘤肝轉移的研究,國外研究[10]報道,應用伊立替康載藥微球栓塞(DEBIRI)治療15例結直腸癌肝轉移,無進展生存期和總生存期分別為8個月和13個月,其中1例肝內轉移灶縮小至可外科手術切除。Iezzi等[11]應用DEBIRI治療20例結直腸癌肝轉移,無進展生存期和總生存期分別為4個月和7.3個月。此兩項研究表明應用DEB治療消化道腫瘤肝轉移是安全可行的。Fiorentini等[12]納入了74例結直腸癌肝轉移患者,對比DEBIRI與內科化療FOLFIRI(伊立替康+氟尿嘧啶+亞葉酸鈣)的療效,結果顯示DEBIRI組患者無進展生存期和總生存期均較FOLFIRI組延長,且患者全身不良反應較小。Akinwande等[13]應用DEBIRI聯合FOLFOX治療肝轉移癌,腫瘤壞死率明顯增加,患者生存期顯著延長。此外,Cucchetti等[9]發現DEB-TACE治療能縮短患者住院時間,改善患者生活質量。
本研究應用DEB-TACE治療25例消化道腫瘤肝轉移患者,應用c-TACE治療23例。結果顯示,兩組術后1、3及6個月疾病控制率和緩解率差異無統計學意義。兩組術后1周均主要表現出一過性ALT升高和WBC升高。分析其原因為化療栓塞導致一過性肝損傷,引起ALT升高;栓塞后瘤體壞死引起局部炎癥,導致WBC升高。術后兩組栓塞后綜合征發生率均不高,且差異無統計學意義,說明DEB-TACE并不增加患者術后不良反應,經保肝、抗炎、鎮痛、止吐等對癥治療后癥狀均緩解。術后1個月再次復查相關實驗室指標,已恢復至術前水平。本研究結果說明DEB-TACE治療消化道腫瘤肝轉移近期療效確切,技術安全、可行。
治療中需要注意因肝轉移癌多缺乏血供,需術中結合影像學檢查結果,超選擇供血動脈后造影,必要時增加對比劑劑量并延長曝光時間,以充分顯示病灶。特別強調在重視肝轉移癌局部治療的同時,要兼顧全身治療,如內科化療、靶向治療等,局部與整體相結合,以達到最佳療效。DEB-TACE治療消化道腫瘤肝轉移的遠期療效還有待于大樣本前瞻性隨機對照研究。

