應用生物信息學定向篩選產角鯊烯的微生物研究分析
陳 筆,陳良強,胡光源,王和玉,王 莉,楊 帆
(貴州茅臺酒股份有限公司技術中心,貴州仁懷 564500)
角鯊烯是一種高度不飽和直鏈三萜烯類化合物,具有抗癌、抗腫瘤、抗氧化等生物活性[1],廣泛應用于醫藥、食品和化妝品等工業領域[1-2]。角鯊烯雖廣泛存在于動物[3]、植物和微生物[4]體內,但是深海鯊魚的肝油目前仍是角鯊烯最為主要的來源。通過篩選高產或基因改造微生物菌株[5]發酵獲取角鯊烯具有生產周期短、不受時間和地域限制、易操作等優點[6-7],為解決角鯊烯資源的匱乏問題開辟了一條新途徑。
目前,文獻中篩選高產角鯊烯菌株的方法主要是通過非目標性的大量篩選,然后再測定角鯊烯的產量。例如,王曉龍[6]從紅樹林的腐葉中分離得到高產角鯊烯菌株Pseudozymasp.SD301,Bhattacharjee 等[9]從蜂蜜中分離得到產角鯊烯德氏孢圓酵母,Brid 等[10]在漢遜德巴利酵母、深紅螺菌和構巢曲霉等微生物中檢出角鯊烯。同時,隨著微生物基因組、轉錄組和蛋白質組等數據的日益豐富[11],大量數據表明微生物有非常豐富的次級代謝產物合成基因簇,運用任何一種單一的培養基均無法完全反映菌株的代謝產物生產能力[12]。為激活沉默基因,充分挖掘微生物產角鯊烯的潛力,需根據不同微生物的特點嘗試多種培養基,并不斷優化培養基配方[13-14]。這種傳統非目標性的篩選和培養優化方法周期較長,并且檢測角鯊烯的方法較為復雜,會耗費大量的時間、精力與資金[15-16]。因此,利用生物信息學提高篩選效率和挖掘微生物產角鯊烯的潛力有著重要的經濟意義。
茅臺酒作為醬香型白酒典型代表,存在多種生物活性成分,而角鯊烯就是其中之一[8],這表明茅臺酒釀造過程中可能存在具有合成角鯊烯能力的微生物。因此,利用生物信息學數據庫對角鯊烯的合成代謝途徑及關鍵基因進行分析,再與茅臺酒釀造過程中的優勢酵母代謝通路數據進行比對,篩選獲得具有完整角鯊烯合成代謝通路的候選菌株;并根據候選菌株產角鯊烯代謝通路的關鍵酶特性和底物要求,優化候選菌株的培養基,激活沉默基因,充分挖掘微生物產角鯊烯的潛力。
1 材料與方法
1.1 材料、試劑及儀器
候選菌株:扣囊復膜孢酵母(SaccharomycopsisfibuligerasMT001)、粟酒裂殖酵母(Schizosaccharo-mycespombe MT002)和庫德里阿茲威氏畢赤酵母(Pichia kudriavzeviiMT003),均從茅臺酒的釀造過程中分離,且已全基因組測序并保藏于茅臺微生物菌種庫。本文報道的3 株酵母的原始序列數據已保存在中國科學院北京基因組研究所大數據中心(BIGD)的GSA 檔案中,登記號為CRA001596,可在http://bigd.big.ac.cn/gsa上公開查閱。
試劑:角鯊烯(色譜純),美國sigma 公司;葡萄糖、蛋白胨、酵母膏、磷酸氫二鉀、氯化鈉、硫酸鎂、硫酸錳、乙酸和無水乙醇均為分析純,國藥集團。
儀器設備:KS4000i 搖床,德國艾卡公司;380R離心機,德國Hettich 公司;LRH-250 恒溫培養箱,上海飛越實驗儀器有限公司;IEC61010-1 超凈工作臺,新加坡藝思高科技有限公司;CL-32L 全自動蒸汽滅菌器,日本ALP 株式會社;G1888A-7890A-5975C 頂空-氣相色譜-質譜聯用儀(HS-GC-MS),美國Agilent公司。
1.2 試驗方法
1.2.1 代謝通路與關鍵酶查詢
利用KEGG pathway 數據庫查詢角鯊烯代謝途徑,并明確其代謝通路及參與反應所需關鍵催化酶。
1.2.2 候選菌株關鍵酶基因的完備性
基于3 株候選菌株全基因組測序數據及其預測的氨基酸序列,再與KEGG 數據庫對比,確定每株候選菌株產角鯊烯關鍵酶基因的完備性。
1.2.3 候選菌株的發酵驗證
發酵培養基:稱取葡萄糖50 g,蛋白胨20 g,酵母膏10 g,磷酸氫二鉀1 g,氯化鈉1 g,硫酸鎂0.1 g,硫酸錳0.05 g于容器中,加入1 L純水,溶解后分裝到250 mL三角瓶,每瓶100 mL,于121 ℃滅菌15 min。挑取1 環候選菌株的菌苔于發酵培養基,以30 ℃、180 r/min 培養16 h 作為種子液。用血球計數板對種子液的酵母數量進行計數,再將種子液接種于上述發酵培養基進行培養,接種后培養液中的菌落數量約為1×106cfu/mL,培養條件為30 ℃、180 r/min振蕩培養5 d。每組設3個平行。
1.2.4 基于生物信息學激活沉默基因
配制好發酵培養基,檸檬酸在滅菌前加入,乙酸在滅菌后加入,使發酵培養基中乙酸和檸檬酸終濃度為0、2 g/L、5 g/L、10 g/L、15 g/L、30 g/L、40 g/L和60 g/L,每組設3 個平行。接種候選菌株的種子液到發酵培養基,接種后培養液中的菌落數量約為1×106cfu/mL,培養條件為30 ℃、180 r/min 振蕩培養5 d。
1.2.5 角鯊烯含量測定
參照文獻[8],采用頂空-氣相色譜-質譜聯用儀(HS-GC-MS)測定發酵液中角鯊烯的含量。具體方法為:將發酵液8000 r/min 離心10 min 后進行液液微萃取(LLME),取上清液10 mL,加適量Na-Cl過飽和,再加1 mL的戊烷-乙醚(1∶3)萃取劑,迅速旋緊瓶蓋,渦旋振蕩1 min,靜置分層后,吸取有機相0.5 mL 于液相小瓶中,氮吹濃縮至0.1 mL,吸取1 μL 濃縮有機相進GC-MS 分析。采用標準譜圖比對和標準品比對,對目標物進行定性,內標標準曲線法進行定量。
2 結果與分析
2.1 角鯊烯代謝途徑的關鍵酶
通過查詢KEGG pathway 數據庫,發現角鯊烯的骨架成分合成主要有兩條代謝途徑:一是MVA(mevalonate pathway,甲羥戊酸)途徑,該途徑在20世紀60年代被發現[17],主要存在于高等真核生物和個別細菌中[18];另一條是MEP/DOXP(1-deoxy-Dxylulose-5-phosphatepathway,脫氧木酮糖-5-磷酸)途徑,其主要存在于細菌和原生動物中[19],在高等動物和真菌中不存在,但在綠色植物中,MEP/DOXP 和MVA 途徑共存于分離的細胞室中。這兩條代謝通路所需關鍵酶如圖1所示。
其中,MVA 途徑是以乙酰Co-A 為底物,乙酰乙酰CoA 經過HMG-CoA 酶催化縮合形成3-羥基-3 甲 基 戊 二 酰-CoA[20],HMG-CoA 隨 后 被HMG-CoA 還原酶還原為甲羥戊酸[21],再經過一列系列生化反應,甲羥戊酸被縮合形成法尼基焦磷酸(FPP)[20];最后,角鯊烯合成酶將FPP 催化合成角鯊烯[22],途徑中的關鍵酶如表1 所示。MEP 途徑是發生在質體內,以丙酮酸或3-磷酸甘油醛為底物,經過中間體2-甲基赤蘚醇磷酸(MEP)和1-脫氧木酮糖-5-磷酸(DOXP),再合成異戊烯焦磷酸(IPP)和DMAPP[23],之后合成角鯊烯的反應通路與MVA 途徑相同[24]。

圖1 角鯊烯MVA和MEP產生途徑示意圖
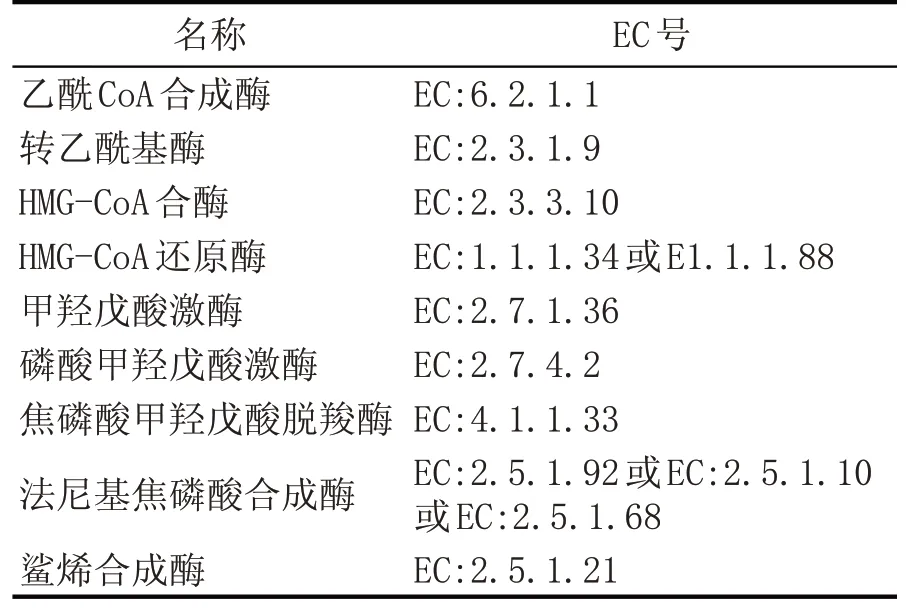
表1 MVA途徑合成角鯊烯所需要的關鍵酶類
2.2 候選菌株關鍵酶基因的完備性
根據相關研究報道[1],真核微生物的角鯊烯合成能力高于原核微生物,因此本研究選取了茅臺酒釀造過程中的3 株優勢酵母作為研究對象[25]。將3株候選酵母菌株的KEGG 功能注釋分析結果與角鯊烯代謝通路相關信息進行比對,結果如表2 所示:發現只有粟酒裂殖酵母(S.pombeMT002)具有完備的MVA 途徑合成角鯊烯所需關鍵酶基因;扣囊復膜孢酵母(S.fibuligerasMT001)缺少法尼基焦磷酸合成酶基因,庫德里阿茲威氏畢赤酵母(P.kudriavzeviiMT003)缺少磷酸甲羥戊酸激酶和法尼基焦磷酸合成酶基因。與其他研究結果相同[1,26],全基因組解析結果顯示,酵母等真核微生物具有MVA途徑,不具備MEP途徑[19]。

表2 候選菌株MVA途徑關鍵酶基因注釋情況
2.3 候選菌株的產角鯊烯發酵驗證
為驗證候選菌株產角鯊烯的能力,并與生物信息學的預測結果進行比對,本研究以常規的葡萄糖為碳源,接種粟酒裂殖酵母(S.pombeMT002)、扣囊復膜孢酵母(S.fibuligerasMT001)和庫德里阿茲威氏畢赤酵母(P.kudriavzeviiMT003)進行發酵,但在所有發酵液中均未檢測到角鯊烯(表3)。在MT001 和MT003 發酵液中未檢測到角鯊烯,可能是因為缺少角鯊烯合成關鍵酶基因,與生物信息學分析結果相一致;而粟酒裂殖酵母MT002 沒有合成角鯊烯,則可能是相關代謝基因沒有表達,因此需要進一步調整培養條件對其驗證。

表3 發酵液中候選菌株的角鯊烯產量 (μg/g干菌體)
2.4 基于生物信息學激活沉默基因
基于粟酒裂殖酵母全基因組數據的KEGG 功能注釋分析,其代謝途徑中合成乙酰CoA的最直接底物有檸檬酸和乙酸,因此本研究在發酵培養基中添加了乙酸和檸檬酸以促進乙酰CoA的產量。
對不同酵母菌株在不同有機酸濃度下發酵液中的角鯊烯含量進行分析,結果顯示,角鯊烯含量分布存在較大差異。從表4 可以看出,添加檸檬酸均不能促進3 株酵母生成角鯊烯,但在添加一定的乙酸(5~15 g/L)后,可以在粟酒裂殖酵母MT002的發酵液中檢測出疑似角鯊烯的物質,經過對發酵液中目標峰進行標準品比對及NIST 譜庫比對,確認檢測到角鯊烯(圖2)。

圖2 液液微萃取結合GC-MS檢測到發酵液中角鯊烯的總離子流圖

表4 不同乙酸和檸檬酸濃度下菌株產角鯊烯的含量 (μg/g干菌體)
當乙酸濃度低于2 g/L 時,發酵液中檢測不到角鯊烯;當乙酸濃度為10 g/L 時,角鯊烯含量最高可達14.71 μg/g菌體;當乙酸濃度升到15 g/L時,角鯊烯含量開始降低,可能是高濃度的乙酸會抑制菌體生長[27],進而減少角鯊烯的合成。由于茅臺酒發酵過程中最主要的有機酸是乳酸和乙酸[25],因此酒醅中的乙酸可能是促進茅臺酒中角鯊烯合成的重要條件。
目前,提高角鯊烯的產量主要通過培養基和發酵條件的優化,以及使用工程改造菌株。例如,通過添加鹽酸特比奈芬或茉莉酸甲酯來抑制角鯊烯單加氧酶的活力[28];或者通過調節氧濃度、接種量、氮源和發酵時間等來提高釀酒酵母的角鯊烯產量[29-30]。生物信息學顯示,大部分微生物都有非常豐富的次級代謝產物生物合成基因簇,但在傳統培養條件下不能被表達,被稱為沉默基因[12]。本研究篩選得到的粟酒裂殖酵母雖然具有完備的角鯊烯MVA 代謝通路所需關鍵酶基因,但在含葡萄糖等常規營養成分的培養基中不能合成角鯊烯;在培養基中加入特定濃度的乙酸之后,成功使粟酒裂殖酵母合成了角鯊烯。推測可能是因為乙酸刺激了粟酒裂殖酵母表達乙酸-CoA連接酶,激活了這個沉默基因,提高了乙酰CoA的濃度,從而提高了角鯊烯產量。雖然粟酒裂殖酵母在乙酸刺激下的應激反應和代謝調控變化還需要進一步的研究確定,但就我們所知,目前尚未有使用本研究思路以及通過添加乙酸促進角鯊烯合成的研究報道。
3 結論
本研究利用生物信息學數據庫對角鯊烯的合成途徑及關鍵基因進行分析,并結合已測序完成的白酒釀造過程中微生物全基因組數據,定向篩選出具有完備角鯊烯代謝途徑關鍵酶基因的粟酒裂殖酵母;然后根據其代謝途徑特征,添加特定濃度的乙酸促進角鯊烯合成,推測這可能是激活了沉默基因。本研究提供了一條挖掘目標菌株產角鯊烯潛力的新思路,避免了因非目標性試驗耗費的時間、精力和金錢。雖然最終得到的菌株角鯊烯產量與文獻報道存在差距[31],但本研究方法具有一定的針對性和有效性,對其他微生物代謝產物的挖掘也同樣具有重要的借鑒意義。

