吡格列酮對三硝基苯磺酸誘導炎癥性腸病大鼠過氧化物酶體增殖物激活受體γ和核因子-κB p65的影響
葛相栓,劉小玲,王慧超,李君芳
炎癥性腸病(inflammatory bowel disease,IBD)是一類多種病因引起的、異常免疫介導的腸道慢性及復發性炎癥。過氧化物酶體增殖物激活受體γ(peroxisome proliferators-activated receptor gamma,PPAR-γ)具有炎癥調控作用。本研究于2006年9月至2007年8月將PPAR-γ配體吡格列酮干預三硝基苯磺酸(TNBS)誘導的IBD大鼠,通過觀察大鼠的疾病活動度和結腸黏膜損傷情況并檢測結腸PPAR-γ,核因子-κB p65(NF-κB p65)表達,探討吡格列酮對大鼠IBD可能的作用機制和治療效果,為其今后應用于IBD臨床治療提供理論依據。

圖1 對照組、模型組及干預組大鼠結腸黏膜結構及過氧化物酶體增殖物激活受體γ(PPAR-γ)和核因子-κB p65(NF-κB p65)的表達:A、B、C分別是對照組、模型組及中劑量干預組大鼠結腸黏膜結構(HE染色×40);D、E、F、G分別是模型組及中劑量干預組PPAR-γ與NF-κB p65的表達(免疫組織化學SP法×100)
1 材料與方法
1.1實驗動物3月齡清潔級大鼠48只,體質量(200±20)g,由安徽醫科大學動物實驗中心提供。飼養條件:室內溫度18~22℃,相對濕度50%~60%,光照12 h/d,自由飲水,飼喂鼠全價飼料,隔日更換墊料。本研究符合一般動物實驗倫理學原則。
1.2主要試劑及儀器鹽酸吡格列酮片,江蘇恒瑞醫藥股份有限公司,生產批號040525,規格:30 mg;柳氮磺吡啶(SASP),上海信誼天平藥業有限公司,生產批號06181105,規格:15 mg;兔抗鼠PPAR-γ多克隆抗體,上海鈺博生物科技有限公司,濃度:1 mg/mL;羊抗兔過氧化物酶標記的鏈酶卵白素(SP)染色試劑盒,北京中衫金橋生物技術有限公司;兔抗NF-κB p65單克隆抗體,艾美捷科技有限公司,羊抗兔SP試劑盒,北京中杉金橋生物技術有限公司;TNBS,上海榕柏生物技術有限公司,規格:10 mL;圖像采集系統,美國PixeLINK1394 camera公司。
1.3實驗設計
1.3.1分組 48只SD大鼠稱體質量后編號,采用隨機數字表法分為對照組、模型組、SASP藥物治療組(SASP組)、吡格列酮低劑量治療組(低劑量組)、吡格列酮中劑量治療組(中劑量組)、吡格列酮高劑量治療組(高劑量組),每組8只,其中后四組為干預組。
1.3.2模型構建 TNBS/乙醇溶液(5%TNBS溶于50%乙醇中,體積比2∶1)法構建模型。原理:乙醇破壞結腸黏膜屏障,TNBS與腸黏膜角蛋白結合,激發局部的免疫反應,引起局部出血、水腫,糜爛,形成潰瘍,詳細過程參考文獻[1]。對照組給予0.9%氯化鈉溶液灌腸,其余各組均TNBS/乙醇溶液進行結腸炎模型構建。
1.3.3各組處置 對照組、模型組:0.9%氯化鈉溶液灌胃,每日1次;吡格列酮低劑量組、中劑量組、高劑量組:分別予吡格列酮2 mg/kg、4 mg/kg、6 mg/kg灌胃,每日1次;SASP組:給予SASP 100 mg/kg灌胃,每日1次。均于造模后第2天開始灌胃。
1.3.4標本采集 飼養14 d后開腹暴露腹主動脈,負壓管采取血液,低速離心后留血清,-75℃保存。游離結腸組織,取病變最明顯處組織,應用4%多聚甲醛液固定,石蠟包埋。
1.4免疫組織化學檢測免疫組織化學法檢測大鼠結腸組織NF-κB p65、PPAR-γ蛋白的表達,操作步驟參照試劑盒說明書進行。用PBS代替一抗作為陰性對照。切片集中染色。染色及結果判定:NF-κB p65、PPAR-γ陽性表達均為細胞核內和(或)胞質出現棕黃色顆粒。由兩位有經驗的病理醫師在光學顯微鏡下盲法讀片,觀察陽性染色在胞質、胞核的分布。每張切片任意選擇5個100倍視野,采用病理圖像分析系統分析陽性細胞積分光密度值。
1.5觀察指標
1.5.1結腸炎癥活動指數(DAI) 觀察動物體質量下降比例、大便性狀及血便的改變,按照結腸炎癥活動評分標準[2],代入公式DAI=(體質量下降分數+大便性狀分數+便血分數)/3,計算大鼠的炎癥活動。
1.5.2結腸黏膜大體形態損傷指數(CMDI) 肉眼觀察結腸黏膜的充血、水腫、壁內潰瘍、腸壁厚度及腸管長度的改變,參照Wallace、Keenan[3]結腸黏膜大體損傷評分標準進行結腸黏膜大體損傷評分。
1.5.3結腸黏膜組織學損傷指數(TDI) 顯微鏡下觀察組織切片有無潰瘍、淋巴細胞浸潤、嗜中性粒細胞浸潤及浸潤深度、黏蛋白減少、假膜形成等11項指標,進行評分,具體評分細則參照Pullan等[4]組織病理學評分標準。上述評分均由病理科醫師采用盲法進行。
1.6統計學方法所有數據采用SPSS 18.0統計軟件分析處理。不同組別間的數值比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。NF-κB p65、PPARγ表達水平雙變量間的單因素相關性分析采用Pearson相關性分析。P<0.05表示差異有統計學意義。
2 結果
2.1結腸DAI不同組間均數比較,F=8.495,P=0.000。SASP組、吡格列酮低、中及高劑量組DAI與模型組比較,均低于模型組,P值分別是0.000、0.010、0.000、0.010;中劑量治療組與SASP組比較,P=0.6900,差異無統計學意義;吡格列酮低劑量治療組、高劑量組DAI與SASP組比較,P值分別是0.020、0.020,差異有統計學意義。具體數值見表1。
2.2結腸黏膜CMDI對照組、模型組、SASP組、低劑量組、中劑量組、高劑量組結腸長度分別為(9.01±0.01)cm、(8.95±0.01)cm、(9.10±0.20)、(9.21±0.15)cm、(8.97±0.17)cm、(9.00±0.05)cm,差異無統計學意義,P=0.120。不同組間均數比較,F=7.057,P=0.000。SASP組、吡格列酮低劑量組、中劑量組、高劑量組與模型組比較顯著低于模型組,P值分別是0.000、0.001、0.000、0.005。吡格列酮不同劑量治療組與SASP組相比差異無統計學意義,P值分別是0.456、1.000、0.1400。具體數值見表1。
2.3結腸黏膜TDI不同組間均數比較,F=20.573,P=0.000。SASP組、吡格列酮低劑量組、中劑量治療組、高劑量治療組與模型組TDI比較,均P=0.000,低于模型組。吡格列酮不同劑量治療組與SASP藥物組比較,P值分別是0.568、0.849、0.568,差異無統計學意義。具體數值見表1。
2.4結腸NF-κBp65、PPAR-γ檢測
2.4.1對照組可見大量PPAR-γ陽性顆粒,主要位于細胞質;不同組間PPAR-γ均數比較,F=47.101,P=0.000。模型組PPAR-γ表達顯著低于對照組,P=0.000;SASP組、吡格列酮低劑量組、中劑量組、高劑量組PPAR-γ表達顯著高于模型組,均P=0.000,陽性顆粒主要位于腸上皮細胞和部分炎癥細胞的細胞核;吡格列酮低劑量組、中劑量組、高劑量組PPAR-γ與SASP組相比較,P值分別是0.000、0.773、0.004。
不同組間NF-κB p65均數比較,F=105.725,P=0.000。對照組NF-κB p65陽性細胞少見,以胞質表達為主;模型組可見大量腸上皮細胞和炎癥細胞的細胞核中有NF-κB p65陽性顆粒分布,表達顯著高于對照組,P=0.000;SASP組、吡格列酮低劑量組、中劑量組、高劑量組PPAR-γ表達顯著低于模型組,均P=0.000。吡格列酮中、高劑量組與SASP組相比差異無統計學意義,P值分別是0.370、0.952。具體數值見表2及圖1。
表1 不同組別大鼠結腸組織炎癥活動指數(DAI)、大體形態損傷指數(CMDI)、組織學損傷指數(TDI)的比較/±s

表1 不同組別大鼠結腸組織炎癥活動指數(DAI)、大體形態損傷指數(CMDI)、組織學損傷指數(TDI)的比較/±s
注:DAI(炎癥活動指數)中a示與模型比較,P值分別是0.001、0.010、0.002、0.009;b示與SASP組比較,P值分別是0.019、0.687、0.020;CMDI(大體形態損傷指數)中c示與模型比較,P值分別是0.000、0.001、0.000、0.005;d示與SASP組比較,P值分別是0.456、1.000、0.140;TDI(組織學損傷指數)中e示與模型比較,均P=0.000;f示與SASP組比較,P值分別是0.568、0.849、0.568
組別模型組SASP組低劑量組中劑量組高劑量組F值P值鼠數8 8 8 8 8 DAI 3.13±0.83 1.50±0.53a 2.25±0.71ab 1.63±0.52ab 2.25±0.46ab 8.495 0.000 CMDI 2.63±0.52 1.13±0.83c 1.38±0.52cd 1.13±0.83cd 1.63±0.84cd 7.057 0.000 TDI 9.50±1.93 4.63±1.19e 5.00±1.31ef 4.75±1.04ef 4.00±0.76ef 20.573 0.000
表2 不同組別大鼠結腸組織過氧化物酶體增殖物激活受體γ(PPAR-γ)及核因子-κB p65[NF-κB p65]的比較/±s
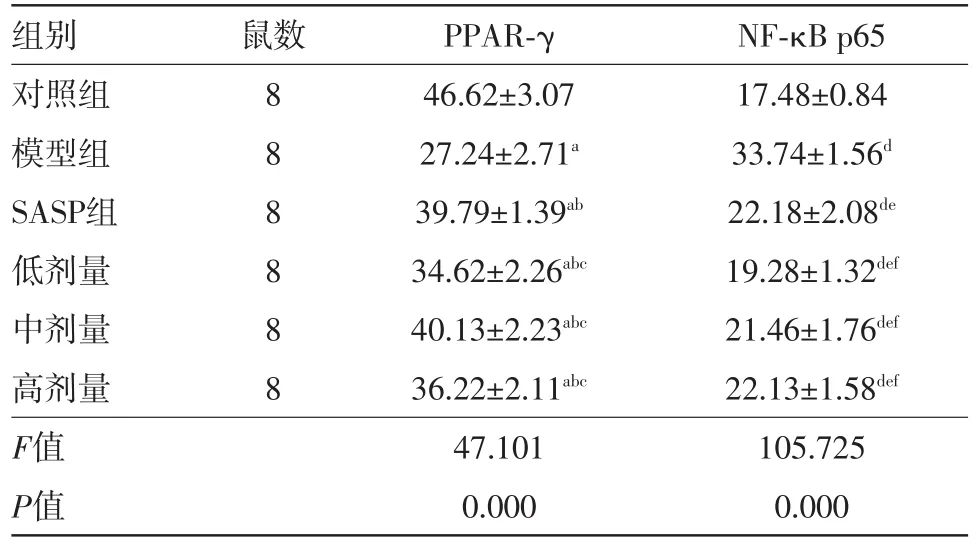
表2 不同組別大鼠結腸組織過氧化物酶體增殖物激活受體γ(PPAR-γ)及核因子-κB p65[NF-κB p65]的比較/±s
注:PPAR-γ(過氧化物酶體增殖物激活受體γ)中a示與對照組比較,P=0.000;b示與模型比較,均P=0.000;c示與SASP組比較,P值分別是0.000、0.773、0.004。NF-κB p65[核因子-κB p65]中d示與對照組比較,P=0.000;e示與模型比較,均P=0.000;f示與SASP組比較,P值分別是0.001、0.370、0.952
組別對照組模型組SASP組低劑量中劑量高劑量F值P值鼠數88 8 8 8 8 PPAR-γ 46.62±3.07 27.24±2.71a 39.79±1.39ab 34.62±2.26abc 40.13±2.23abc 36.22±2.11abc 47.101 0.000 NF-κB p65 17.48±0.84 33.74±1.56d 22.18±2.08de 19.28±1.32def 21.46±1.76def 22.13±1.58def 105.725 0.000
2.4.2NF-κB p65、PPARγ關聯性分析 對照組、模型組、SASP組、吡格列酮低劑量組、中劑量組、高劑量組PPAR-γ與NF-κB p65的表達均呈負相關(相關系數分別為-0.851、-0.875、-0.771、-0.776、-0.766、-0.910,P值分別是 0.007、0.004、0.025、0.024、0.027、0.000)。
3 討論
目前認為IBD的發病與環境因素、免疫、遺傳、感染等多種因素有關,腸道免疫系統導致免疫反應和炎癥過程。活化的免疫細胞,如單個核細胞、T細胞、B細胞經刺激后合成或分泌的細胞因子在IBD的發病機制中起重要的調節作用,其中促炎和抗炎細胞因子失衡在IBD發病過程中起關鍵作用[5]。免疫是目前IBD研究的熱點。
NF-κB是一種參與炎癥、免疫反應的重要轉錄因子,許多分子都受NF-κB的調控,如TNF(腫瘤壞死因子)-α、IL(白細胞介素)-1β、IL-8、IL-12、IL-2、IL-6、iNOS(誘導型一氧化氮合酶)、COX2(環氧酶2)、炎癥趨化因子、黏附分子[5]。NF-κB活化通過兩種主要的信號通路:經典和非經典信號通路。經典的NF-κB激活途徑來自不同免疫受體的刺激,激活程度是快速且短暫的,而非經典途徑是緩慢且持久的[6]。NF-κB在克羅恩病病人巨噬細胞中表達明顯升高,促使結腸上皮細胞促炎細胞因子表達增加,腸道炎癥反應增強。而作為NF-κB拮抗劑的二硫代氨基甲酸吡咯烷,通過降低NF-κB活性來緩解DSS誘導的結腸炎癥[7]。上述研究表明NF-κB在IBD中的促炎作用。NF-κB p65作為NF-κB家族成員之一,本研究發現TNBS誘導結腸炎模型中NF-κB p65的表達較同期正常對照組明顯增高,給予SASP及吡格列酮干預后不同程度降低。這印證了上述觀點。
PPAR-γ是介導脂肪酸及過氧化物酶體增殖物,分別在巨噬細胞、結腸上皮細胞及其它種類的免疫細胞上表達,在健康的大腸上皮細胞上高表達,而在IBD中低表達[8]。在克羅恩病病人和TNBS誘導的結腸炎模型中,PPAR-γ水平下降[9],表達PPAR-γ的基因載體或PPAR-γ激動劑(吡格列酮和姜黃素)能降低不同結腸炎模型的黏膜炎癥和疾病的嚴重程度。相反,破壞結腸PPAR-γ的表達能使化學藥物誘導結腸炎的敏感性增加。本研究中結腸炎模型組PPAR-γ下降,給予吡格列酮及SASP干預后不同程度升高,與上述研究一致,表明PPAR-γ參與了IBD的炎癥反應過程。
PPAR-γ主要通過抑制炎癥通路中NF-κB、AP-1、STAT及NFAT等轉錄因子的活性來發揮抗炎作用[10-11]。Yang等[9]研究表明TNBS誘導大鼠結腸炎模型中CMDI、DAI、NF-кB、TNF-α、IL-6、MPO(髓過氧化物酶)等升高,PPAR-γ降低,給予穿心蓮內酯衍生物干預后,前者下降、后者升高[12]。研究顯示含有吡唑的中氮茚衍生的化合物B4能通過激活PPAR-γ的表達來抑制NF-κB活化,緩解TNBS誘導的結腸炎大鼠的癥狀,包括體質量下降、腸道病理損傷及炎癥細胞的浸潤。相反,PPAR-γ拮抗劑GW9662能抑制 B4的抗炎效果[7]。Wang等[13]研究表明在葡聚糖硫酸酯鈉誘導鼠實驗性結腸炎,千層紙素苷通過PPARγ激活來抑制NF-κB通路發揮抗炎作用。本研究表明,給予PPAR-γ配體吡格列酮后PPAR-γ表達升高,而NF-κB p65表達下降。這說明實驗性結腸炎中NF-κB和PPAR-γ負相關,其相互關系為:PPAR-γ的活化能抑制NF-κB下游信號表達,從而減輕腸道炎癥。
吡格列酮是胰島素增敏劑噻唑烷二酮類降糖藥。早期研究表明噻唑烷二酮類藥物對TNBS誘導的結腸炎有治療作用[14]。羅格列酮作為PPAR-γ的配體能調控單核細胞和巨噬細胞中多種細胞因子的表達,如IL-1β,COX-2,IL-6,IL-8,TNF-α,INF(干擾素)-γ,iNOS和炎癥趨化因子的表達,減輕腸道炎癥,特別是NF-кB的表達[15-16]。梁紅亮和歐陽欽[17]在惡唑酮誘導的小鼠結腸炎模型中發現羅格列酮治療后PPAR-γ表達陽性率隨時間的延長而逐漸增高,NF-κB p65、Fas/Fasl和Caspase-3表達陽性率隨時間的延長而逐漸遞減,說明PPAR-γ配體噻唑烷二酮類通過激活PPAR-γ來抑制NF-κB活化,從而緩解結腸炎癥。本研究中吡格列酮干預實驗與上述結論一致。
總之,本實驗顯示吡格列酮可有效改善TNBS誘導的IBD大鼠的癥狀,其作用機制可能是吡格列酮作為PPAR-γ人工配體,通過增加PPAR-γ的表達,抑制促炎因子NF-κB p65的表達,減輕結腸的炎癥和免疫反應。同時,本研究也為吡格列酮治療結腸炎提供了一定理論依據。
志謝中國科技大學第一附屬醫院消化內科吳正祥教授及河南大學基礎醫學院喬玲教授在本研究設計、指標檢測、論文書寫及數據統計等方面給予耐心、詳盡的指導
(本文圖1見插圖10-1)

