人血小板裂解液在人牙髓間充質細胞體外增殖與分化中的應用
謝賢哲,徐 燕,何家林,王騰飛,霍冬梅
牙周炎是導致牙槽骨缺損的重要因素之一。以人牙髓間充質細胞(human dental pulp stroma cells,hDPSCs)等自體來源種子細胞為基礎的組織工程技術得到越來越多學者與臨床醫師的關注。絕大多數細胞體外培養使用胎牛血清(fetal bovine serum,FBS)作為添加物。但由于FBS存在人畜共患病、免疫排斥等潛在風險,種子細胞體外擴增后的臨床應用受到了極大的限制[1]。血小板裂解液(human platelet lysate,HPL)作為可能的FBS替代物受到廣泛的關注[2-3]。很多學者嘗試使用HPL對細胞進行體外擴增,但對于最適使用濃度的觀點仍未統一[4]。
1 材料與方法
1.1 儀器與試劑杜氏改良Eagle培養基(Dulbecco′s modified eagle medium,DMEM,美國hylcone公司);FBS(美國Gibco公司);JJT-900超凈臺、細胞培養箱(美國Thermo公司);Elx808U酶標儀;Countstar細胞計數儀(上海睿鈺生物科技有限公司);熒光倒置顯微鏡(DMI3000B,德國Leica公司);茜素紅S法染色試劑盒、CCK-8試劑盒(北京Solarbio公司);TRIzol(美國Introvigen公司);實時熒光定量聚合酶鏈反應(Real time quantitive-polymerase chain reaction,RT-PCR)試劑盒(日本TaKaRa公司)。
1.2 HPL的制備與樣本收集篩選志愿者,年齡25~28周歲,身體健康,采血前均行血常規檢測血小板含量正常[(100~300)×109/L]。每位志愿者于肘靜脈處采血20 ml,置于5 ml無抗凝劑玻璃管中,立刻放入Intra-spin離心機中2 700 r/min離心12 min,可見分3層,中間層為富血小板纖維蛋白(platelet-rich fibrin,PRF)。無菌條件下棄去底層紅細胞后經3 000 r/min離心10 min將血小板與膠原蛋白網分離,上清液于-80 ℃與37 ℃下反復凍融3次后過0.22 μm濾篩,得到HPL。為避免個體間差異對實驗結果造成影響,將多人份HPL混合后使用。
收集安徽省口腔醫院口腔頜面外科2017年12月~2018年4月所拔除健康阻生第三磨牙共60顆,所有供體無系統性疾病,年齡18~40周歲。
1.3 細胞培養與檢測
1.3.1細胞分離與培養 樣本收集后立刻送往實驗室,無菌條件下將牙髓輕柔取出,剪成1 mm×1 mm×0.5 mm大小移入6孔細胞培養板中,使用改良組織塊法于37 ℃、5% CO2條件下在培養箱中分別使用含5%、10%、20% HPL以及10% FBS的DMEM進行原代細胞培養,每組15顆牙齒。
1.3.2細胞形態學觀察 倒置顯微鏡及掃描電鏡觀察并記錄原代細胞形態與生長狀況,計算細胞成活率。
1.3.3流式細胞術檢測細胞表面抗原表達 取7個流式管,選取第2代生長狀態良好的細胞,調節每管細胞數為1×106個。分別加入CD34、D45、CD44、CD90、CD105、Stro-1單克隆抗體, 另設置一空白對照管。4 ℃避光孵育30 min,1 000 r/min離心5 min去上清液,重懸,上流式細胞儀進行檢測。
1.3.4細胞活性檢測 胰酶消化細胞制備單細胞懸液,并稀釋至1×106/ml,取適量細胞懸液與0.4%臺盼藍溶液以9 ∶1混合均勻,3 min內用計數板分別計數活細胞與死細胞。
1.3.5細胞增殖檢測 取對數生長期的P3代細胞,以1×104/ml接種于96孔板,預培養24 h,分別在第1、2、3、4、5、6、7天加入CCK-8溶液,孵育1~4 h后,用酶標儀測定在450 nm處吸光度值。
1.3.6細胞體外成骨誘導和檢測 選擇分別加入10% HPL和10% FBS的兩組培養基為實驗組與對照組。選取生長良好的P3代細胞,制備成5×104/ml細胞懸液,接種于6孔板中培養12 h,待細胞貼壁后進行成骨誘導,分別在0、7、14、21 d使用茜素紅染色并進行觀察。
選取10% HPL和10% FBS的兩組生長狀態良好的P3代細胞以1×105/ml接種于6孔板。分別于成骨誘導的0、7、14、21 d吸去培養液,PBS 沖洗2遍后,立即加入1 ml TRIzol裂解細胞提取總RNA。定量后,以Prime-ScriptTMRT Master Mix反轉錄試劑盒反轉錄合成cDNA,以cDNA為模板,β-actin為內參,使用7500Real Time PCR System進行熒光實時定量PCR,分別檢測堿性磷酸酶(alkaline phosphatase,ALP)及骨形態發生蛋白-2(bone morphogenetic protein-2,BMP2)的mRNA表達水平。操作步驟嚴格按照產品說明書進行,所用引物均由上海生工生物有限公司設計并合成,各引物序列見表1。

表1 RT-PCR引物及其序列
1.4 統計學處理采用SPSS 22.0軟件進行數據分析,多組間比較采用方差分析(ANOVA),兩組之間比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 細胞形態學觀察培養7~12 d后,各組均有細胞從組織塊邊緣爬出,細胞形態規則呈長梭形,呈旋渦狀排列,胞膜完整。使用HPL培養的細胞立體感更強,期間夾雜少量多角形細胞(圖1、2)。
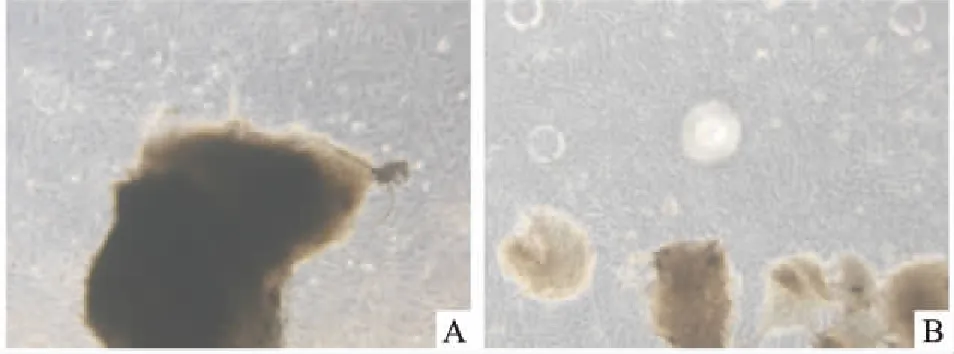
圖1 原代培養的牙髓間充質細胞 ×80A:10% FBS組;B:10% HPL組

圖2 掃描電鏡下細胞形態 ×2 000
2.2 細胞成活率各組均有細胞爬出,20% HPL組細胞成活率最高(73.3±4.7)%,5% HPL組最低(26.7±4.7)%,除10% HPL與20% HPL組間差異無統計學意義外(F=0.82,P=0.485 1),各組之間差異均有統計學意義(F=11.16,P=0.046 4),見表2。
2.3 流式細胞儀檢測結果流式細胞儀檢測細胞特定抗原表達結果顯示,所培養細胞陽性表達CD44(94.2%)、CD90(93.7%)、CD105(91.6%)、Stro-1(94.8%);陰性表達CD34(0.9%)、CD45(0.2%),見圖3。
2.4 細胞活性檢測結果臺盼藍染色結果顯示:10% HPL組細胞活性最高(88.424±1.866)%,5% HPL組細胞活性最低(68.583±3.519)%,各組間差異均有統計學意義(F=32.43,P=0.028 1)。見表2。
2.5 細胞增殖檢測結果各組細胞生長曲線均呈S型(圖4),10% FBS組在第3天開始快速增殖,第5天時生長速度放緩,5%、10%及20% HPL組細胞均于第2天即開始快速增長,但第4天時生長速度逐漸降低,20% HPL組第5天達到平臺期。各組間差異均有統計學意義(F總=5.25,P<0.001;F1d=18.56,P=0.018 7;F2d=7.04,P=0.114 6;F3d=65.52,P=0.006 3;F4d=356.60,P=0.001 5;F5d=138.80,P=0.001 0;F6d=108.40,P=0.005 6;F7d=77.51,P=0.001 3)。
2.6 成骨誘導后茜素紅染色實驗組(10% HPL)和對照組(10% FBS)經過連續4周的體外成骨誘導后,茜素紅染色可見實驗組與對照組均形成明顯的紅色礦化結節,見圖5、6。
2.7 成骨誘導后ALP、BMP-2的mRNA表達水平兩組細胞的成骨相關基因ALP、BMP-2隨著成骨誘導時間延長,其mRNA表達量均增加。在各個時間點,實驗組(10% HPL)的成骨相關基因ALP、BMP-2的mRNA相對表達量均高于對照組(10% FBS),差異有統計學意義(ALP:t7d=4.85,P<0.001;t14d=5.35,P<0.001;t21d=6.12,P<0.001; BMP-2:t7d=4.61,P<0.001;t14d=5.60,P<0.001;t21d=3.57,P<0.001)。見圖7。

表2 各組細胞細胞成活率、活率

圖3 流式細胞儀檢測結果A:CD90;B:CD34;C:CD44;D:CD45;E:CD105;F:Stro-1

圖4 牙髓間充質細胞增殖能力
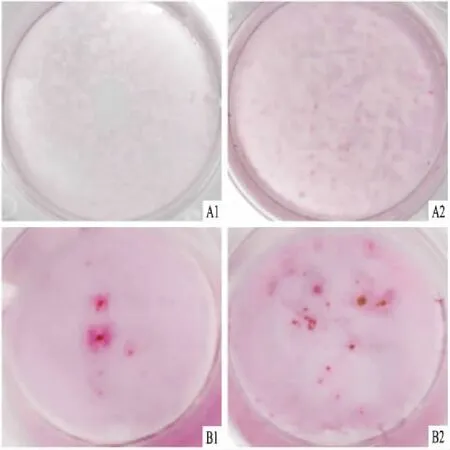
圖5 茜素紅染色照片 ×2A:10% FBS組成骨誘導;B:10% HPL組成骨誘導;1:7 d;2:21 d

圖6 茜素紅染色鏡下照片 ×80A:10% FBS組成骨誘導;B:10% HPL組成骨誘導;1:7 d;2:21 d

圖7 成骨基因ALP、BMP-2 mRNA相對表達量A:ALP;B:BMP-2;與10% FBS組比較:*P<0.05
3 討論
本研究結果顯示,健康牙髓組織在5%、10%以及20% HPL的培養體系下均有成活。其中5% HPL組成活率為各組最低,原因可能是組織塊法培養原代細胞時,對生長因子濃度要求較高[5],5% HPL不足以支持所有牙髓組織塊的成活,以致5% HPL組細胞成活率較低,隨著HPL濃度的提高,細胞成活率升高;20% HPL組成活率與10% HPL組成活率相當,且均高于10% FBS組成活率。
通過流式細胞儀對細胞特異性表面抗原表達檢測結果顯示,所培養細胞陽性表達CD44(94.2%)、CD90(93.7%)、CD105(91.6%)、Stro-1(94.8%);陰性表達CD34(0.9%)、CD45(0.2%),符合間充質來源干細胞表面抗原表達的特征,但由于本研究僅就細胞的成骨分化做了相關研究,而對成脂以及成軟骨方面并未加以驗證,故所培養細胞是否完全具有牙髓間充質干細胞的特性仍需在后續實驗中加以探究。
通過CCK-8對各組細胞培養不同時間節點增殖情況的分析顯示,5%、10%及20% HPL組細胞均于第2天即開始快速增長,這表明HPL中的生長因子在促進細胞貼壁方面相較于FBS更有優勢[6]。第4天時各HPL組生長速度逐漸降低,第5天時,20% HPL組首先到達平臺期,這可能與高濃度生長因子對細胞生長產生的抑制作用有關,這也與Chen et al[7]的相關研究結果一致。
Q-PCR結果顯示在各個時間節點,實驗組(10% HPL)的成骨相關基因ALP、BMP-2的mRNA相對表達量均高于對照組(10% FBS),差異有統計學意義(P<0.05)。有研究[8]顯示在使用5% HPL培養hDPSCs時,短時間內(15 d)可明顯觀察到ALP活性的增強,在此濃度下ALP活性最高;另有學者認為10% HPL在成骨誘導較長時間(15 d之后),促進hDPSCs成骨分化能力最強[7]。本研究使用Q-PCR與茜素紅染色所得到的結果也證明了10% HPL相對于10% FBS在成骨能力方面的優勢。
血小板在傷口愈合和組織修復中的基本生理作用構成了人血小板衍生物在再生醫學中使用的基礎[9]。用于誘導血小板中生長因子和其他生物活性分子釋放的方法可分為四大類:① 冷凍/解凍:血小板富集物在-80 ℃與37 ℃下反復凍融,循環次數1~5次不等,研究[10]表明凍融循環3次對于生長因子的釋放是一個較為穩定的循環次數;② 直接血小板激活:通過加入鈣鹽溶液誘導內源性凝血酶生成,或者直接加入人凝血酶或重組凝血酶使血小板脫粒,以釋放血小板α顆粒內的生長因子,但此種方法使用的外來物質可能會使HPL在細胞療法使用中的監管批準復雜化;③ 超聲:學者發現在20 kHz的頻率下超聲處理30 min對于血小板α顆粒的裂解是有效的;④ 化學處理:在大多數制取HPL方式中,都需要對血小板富集物進行離心以除去細胞碎片和纖維蛋白凝塊,若不去除則需在溶液中加入肝素等化學溶劑來作為抗凝劑,但有研究[11]顯示較高的肝素濃度會對細胞增殖造成負面影響。國外學者使用反復凍融、超聲裂解、凝血酶或鈣離子激活對PRF進行處理,并檢測其中各種生長因子的含量。結果顯示反復凍融組各類生長因子的釋放明顯高于直接激活組,與超聲裂解組相當;而對于儲存時間超過6個月血小板富集物的處理,超聲組中血小板衍生因子(platelet derived growth factor,PDGF)的釋放占優勢[12-13]。綜合各種HPL制取方式的特點,本研究采用-80 ℃/37 ℃下反復凍融3次的方式獲得HPL,并將多人份HPL混合使用以減少個體與批次間差異。
在HPL中各種生長因子對于細胞增殖與分化的作用機制方面,有研究[13]顯示PDGF是一種間充質來源的促細胞有絲分裂蛋白,在所有創傷的愈合過程中起著關鍵作用,可提高包括成纖維細胞、血管平滑肌等細胞在內的中胚層來源細胞的增殖活性;轉化生長因子-β(transforming growth factor-β,TGF-β)為一種調控細胞增殖與分化的蛋白,是體內多能性的基礎抗炎因子,參與諸多組織的修復進程及炎癥反應,并具有促成纖維細胞增殖及胞外基質形成、I型膠原和纖維蛋白生物合成、阻止破骨細胞形成和骨吸收發生的功能;胰島素樣生長因子(insulin like growth factor,IGF)是一種高度類似于胰島素的多肽,作為最早被發現的可作用于軟骨的生長因子之一,是軟骨基質合成中的主要刺激因子,其機制主要體現在刺激成骨細胞增殖與分化,促進軟骨及骨基質生成,其兩種亞類IGF-Ⅰ和IGF-Ⅱ均具有顯著促進多種來源軟骨細胞分裂增殖及軟骨基質合成的效應;血管內皮生長因子(vascular endothelial growth factor,VEGF)作為血管再生進程中必不可少的誘導因子,在胚胎發育時期和組織損傷時起到促進血管新生的作用,并可在血管阻塞造成組織局部血供不足時形成側枝循環,部分恢復血氧供應;成纖維細胞生長因子(fibroblast growth factor,FGF)有aFGF與bFGF兩種形式,其參與調控胚胎發育、創傷愈合及血管形成等過程,被認為是效應最顯著的軟骨細胞分裂及形態發生刺激原之一,對軟骨細胞在內的中胚層來源細胞具有明顯的促分裂作用[11,14]。
雖然HPL作為動物血清的替代物已經用于間充質細胞的體外培養[10],但對于HPL的標準制取以及最適使用濃度的觀點仍未統一[15]。本研究證明了適宜濃度HPL在hDPSCs體外培養及成骨分化中的優勢,為HPL代替FBS提供了依據。在后期研究中,課題組將深入探討HPL培養下hDPSCs在動物及臨床牙槽骨缺損模型中的有效性及調控機制,以期為重度牙周炎的治療提供更多的方法。

