碳還原氧化銅實驗探究
鄭春燕,粟 智
(新疆師范大學化學化工學院,新疆 烏魯木齊 830054 )
1 問題提出
碳還原氧化銅實驗是初中化學教學中一個重要而又難做成功的演示實驗[1]。經過對這一實驗的長期關注,從相關文獻著手分析,王壽紅[2]〗等人指出該實驗成功率低的主要原因是兩反應物(碳和氧化銅)的晶體結構相當穩定,使該化學變化具有高活化能,而且固相間的反應只能在表面進行,更增加了反應的困難程度。付立海[3]指出該實驗現象不明顯是因為碳粉還原氧化銅的反應類型屬于固體和固體反應生成固體和氣體的反應,增大反應物的接觸面積是實驗成功的關鍵因素。衛澤敏[4]通過實驗證實了反應物間的接觸面積越大,則反應界面越大,反應速度可明顯提高。可以看出,無論從反應物的性質還是反應機理出發都足以說明碳還原氧化銅實驗的復雜性和難成功性。徐傳兵[5]在對“甲烷的還原性”研究性學習的探討中采用與氫氣還原氧化銅相同的裝置來做甲烷還原氧化銅實驗,已證實甲烷能還原氧化銅。除了甲烷,像乙烯、乙炔都可以還原灼熱的氧化銅,已被唐玄馨[6]在甲烷不能還原氧化銅嗎一文中加以肯定。于海強[6]等人在探析分子“肼”之常見考點中介紹了肼可以將氧化銅還原為氧化亞銅,但未做詳細說明。那么用不同種類的反應物對該實驗進行改進是否可行呢?為此開展了以下探索工作。
2 理論依據
從不同種類反應物的狀態分析,碳還原氧化銅為兩種固態反應物生成至少一種固態產物的反應,稱為固固反應。依此甲烷、乙烯、乙炔與氧化銅的反應為氣固反應,肼與氧化銅反應為液固反應。查閱有關教材[7]得知:
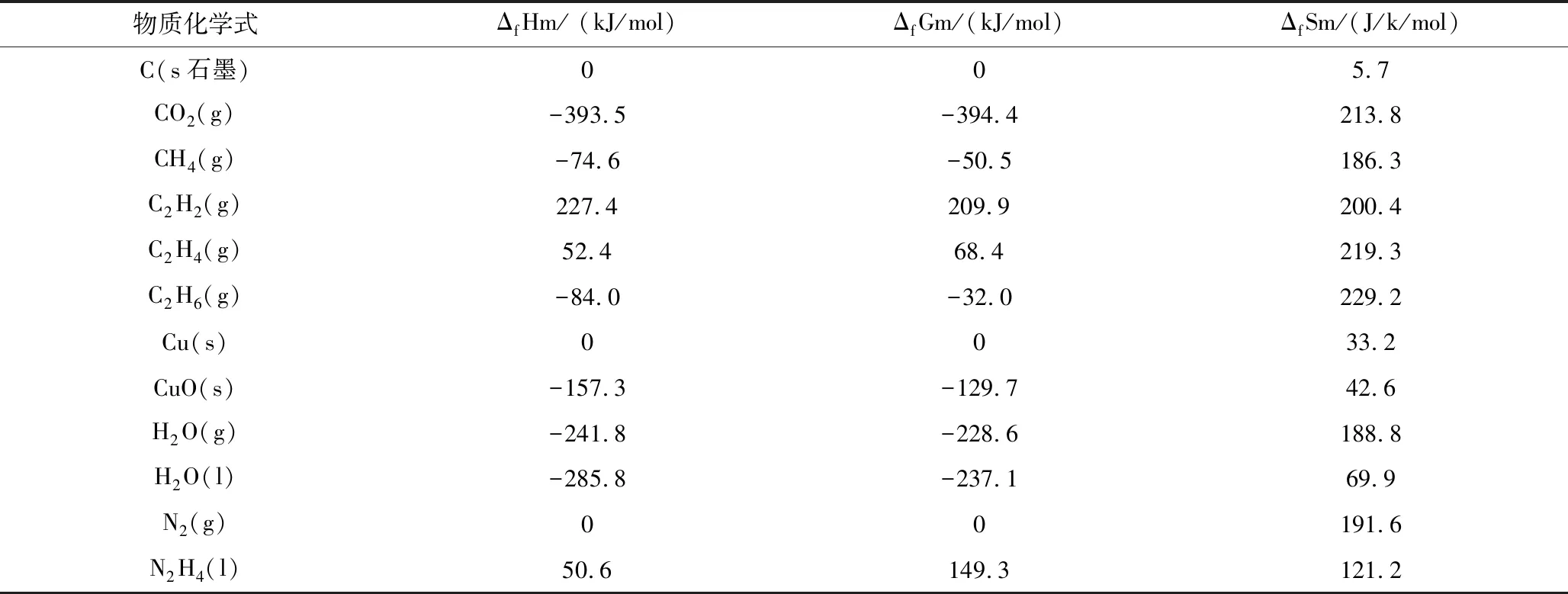
表1 相關物質的熱力學函數(298.15k,100.00kPa)
從熱力學角度分析,在恒溫恒壓非體積功為零的狀態變化中,吉布斯自由能ΔrGml可以作為反應能否自發進行的判據。我們通常用ΔrGml=ΔrHml-T×ΔrSml來計算反應的ΔrGml,ΔrGml的值越負,說明這個反應能自發進行的可能性越大。綜合考慮反應的焓熵值對反應過程的決定性作用,我們用焓熵的比值,即最低反應溫度直觀表示過程對溫度的要求:最低反應溫度值越負,反應自發過程對溫度的要求越低。當反應的ΔrGml=0時,反應達到最大限度,反應系統的組成不再改變,于是達到化學平衡狀態,此時反應的最低溫度T=ΔrHml/ΔrSm 。
根據表1相關熱力學參數分別計算固固反應,氣固反應,液固反應的ΔrHml和ΔrSml,從而求出ΔrGml和T。
固固反應碳還原氧化銅計算過程:
(1)
ΔrHml=-393.5-2(-157.3)=-78.9(kJ/mol)
ΔrSml=213.8+2×33.2-(2×42.6+5.7)=189.3(J/k/mol)=0.1893(kJ/k/mol)
(ΔrGml=ΔrHml-T×ΔrSml=-78.9-298.15×0.1893=-135.4(kJ/mol)
該反應ΔrGml﹤0,表示生成物的自由能小于反應物的自由能,化學反應能夠自發向產物方向進行。實際操作中我們知道該反應必須在一定溫度下發生。
T=ΔrHml/ΔrSml=-78.9/0.1893=-416.8(k)
理論分析表明該反應常溫下即可自發進行,但實際操作中,實驗結果并不理想,這不是熱力學的緣故,而是動力學上的障礙,也可見固固反應固有的復雜性。
同理我們對氣固反應進行計算,甲烷還原氧化銅反應計算過程:
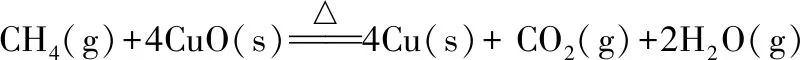
(2)
ΔrHml=2×(-241.8)-393.5-(4×(-157.3)+(-74.6))=-173.3(kJ/mol)
ΔrSml=2×188.8+213.8+33.2-(4×42.6+186.3)=367.5(J/k/mol)=0.3675(kJ/k/mol)
ΔrGml=ΔrHm -T×ΔrSm =-173.3-298.15×0.3675=-282.9(kJ/mol)
T=ΔrHml/ΔrSml=-173.3/0.3675=-471.6(k)
計算可知甲烷還原氧化銅反應ΔrGml﹤0,為自發反應。反應自發過程對溫度的要求低于碳還原氧化銅反應。
乙烷還原氧化銅反應計算過程:
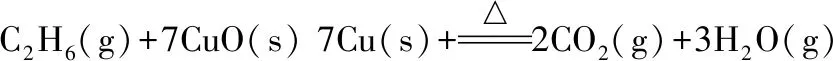
(3)
ΔrHml=3×(-241.8)+2×(-393.5)-(7×(-157.3)+(-84.0))=-327.3(kJ/mol)
ΔrSml=3×188.8+2×213.8+7×33.2-(7×42.6+229.2)=699(J/k/mol)=0.699 (kJ/k/mol)
ΔrGml=ΔrHml-T×ΔrSml=-327.3-298.15×0.699=-535.7(kJ/mol)
T=ΔrHml/ΔrSml=-327.3/0.699=-468.2(k)
計算可知該反應ΔrGml﹤0,為自發反應。反應自發過程對溫度的要求與甲烷相近。乙烯還原氧化銅反應計算過程:
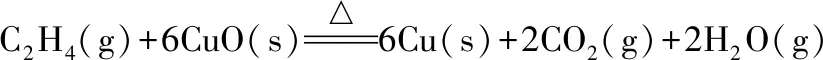
(4)
ΔrHml=2×(-241.8)+2×(-393.5)-(6×(-157.3)+52.4)=-379.2(kJ/mol)
ΔrSml=2×188.8+2×213.8+6×33.2-(6×42.6+219.3)=529.5(J/k/mol)=0.5295 (kJ/k/mol)
ΔrGml=ΔrHml-T×ΔrSml=-379.2-298.15×0.5295=-537.1(kJ/mol)
T=ΔrHml/ΔrSml=-379.2/0.5295=-716.1(k)
計算可知該反應ΔrGml﹤0,為自發反應。反應自發過程對溫度的要求低于甲烷、乙烷還原氧化銅反應。
乙炔還原氧化銅反應計算過程:
ΔrHml=241.8+2×(-393.5)-(5×(-157.3)+227.4)=-469.7(kJ/mol)
ΔrSml=188.8+2×213.8+5×33.2-(5×42.6+200.4)=369.5(J/k/mol)=0.3695 (kJ/k/mol)
ΔrGml=ΔrHml-T×ΔrSml=-469.7-298.15×0.3695=-579.9(kJ/mol)
T=ΔrHml/ΔrSml=-469.7/0.3695=-1271.2(k)
分析可知該反應ΔrGml﹤0,為自發反應,相比以上反應,自發過程對溫度的要求降低。
液固反應肼還原氧化銅的計算過程如下:
ΔrHml=2×(-285.8)-(2×(-157.3)+50.6)=-307.6(kJ/mol)
ΔrSml=2×69.9+191.6+2×33.2-(2×42.6+121.2)=191.4(J/k/mol)=0.1914(kJ/k/mol)
ΔrGml=ΔrHml-T×ΔrSml=-307.6-298.15×0.1914=-364.7 (kJ/mol)
T=ΔrHml/ΔrSml=-307.6/0.1914=-1607.1(k)
計算可知該反應ΔrGml﹤0,為自發反應,且相比以上反應自發可能性最大,自發過程對溫度的要求最低。
3 結果分析
對上述熱力學函數計算結果進行統計,在表2中列出各反應的吉布斯函數ΔrGml(kJ/mol)和最低反應溫度T(k)。
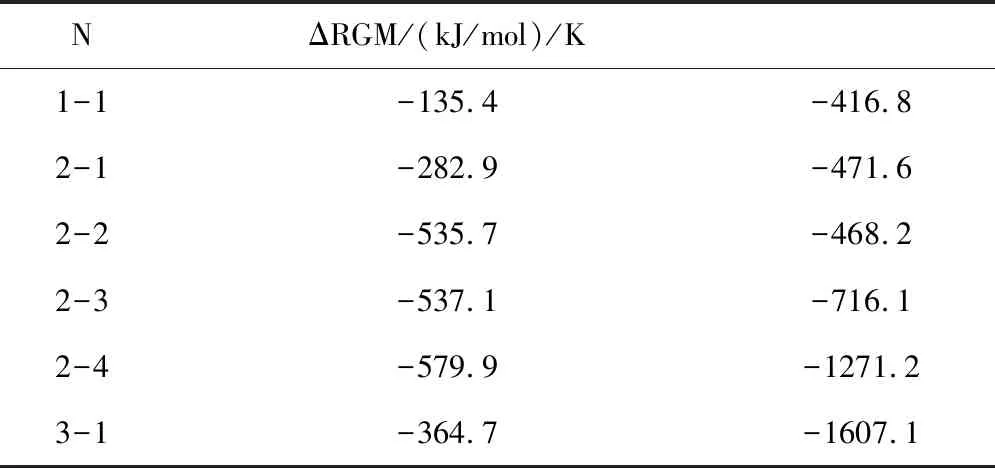
表2 各反應的吉布斯函數
對表2數據進行分析,作出各反應的吉布斯函數ΔrGml(kJ/mol)和最低反應溫度T(k)的柱狀圖見圖1和圖2。
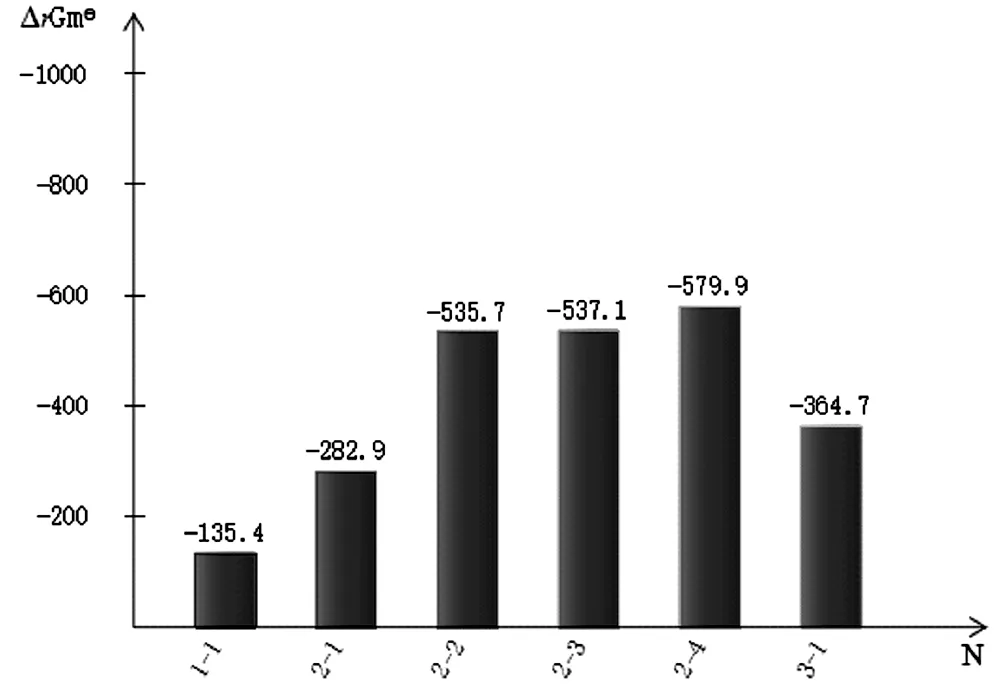
圖1 各反應的吉布斯函數ΔrGm (kJ/mol)
從圖1中可以清楚的看出各反應ΔrGm 均為負值,說明各反應都具有自發性。
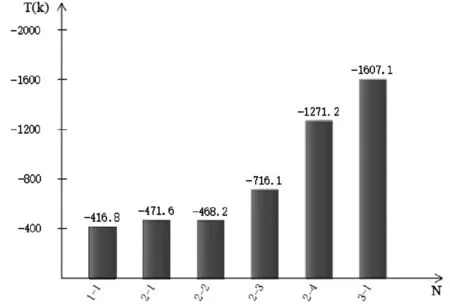
圖2 各反應的最低反應溫度T(k)
從圖2各反應的最低反應溫度T(k)可以看出,反應3-1的最低反應溫度為-1607.1(k),說明肼還原氧化銅的反應對溫度的要求最低。
綜上所述:(1)從熱力學角度分析,以上各反應都具有自發性,其中肼還原氧化銅反應對溫度要求最低。(2)從動力學角度看,氣固反應,液固反應大大增加了反應物的接觸程度,克服了固相反應固有的缺陷,降低了實驗難度。(3)從實驗裝置考慮:固固反應,氣固反應實驗均需要加熱裝置,且對溫度有一定要求,而液相肼還原氧化銅實驗在常溫下即可進行反應,反應條件溫和,實驗裝置簡單。(4)從環保角度,碳還原氧化銅反應產物中的二氧化碳是溫室氣體的罪魁禍首,反應不完全產生的一氧化碳危害更為嚴重。氣相反應甲烷等均為含碳化合物,產物中有二氧化碳。液相肼與氧化銅反應產物為氮氣,清潔安全。
4 教學應用
肼又稱聯氨,分子式為 N2H4,作為氮的重要氫化合物,在各類高中化學試題中出現的頻率很高,但教科書上偶見其名,試題中往往要求學生遷移應用,給學生化學知識的學習造成了困擾。因此本文意欲提出將碳還原氧化銅這一演示實驗換成更肼還原氧化銅的學生實驗,激發學生學習化學的興趣,發揮初中階段化學教育的啟蒙作用。為學生高中化學學習提供先行組織者,發展學生的化學學科素養。

