人血清淀粉樣蛋白A磁微粒化學發光免疫分析定量檢測方法的建立及性能評價 *
丁蒙蒙,李 奎,于 林,李雙法
(鄭州安圖生物工程股份有限公司,鄭州 450016)
血清淀粉樣蛋白A(human serum amyloid A,SAA)是1976年從血清中分離鑒定出的一類高度保守的急性期蛋白家族成員,也是一種存在于血漿中的脂結合蛋白[1]。通常被認為是炎癥反應的主要蛋白之一[2],人體內正常情況下SAA含量是極低的,在細菌或病毒感染時迅速升高。近年來的研究結果表明:SAA在細菌、病毒感染,慢性炎性(類風濕性關節炎、糖尿病、肥胖、動脈粥樣硬化、慢性阻塞性肺疾病),腫瘤等疾病中均有升高,與傳統的感染標志物外周血白細胞計數(peripheral blood white blood cell count,WBC)和C反應蛋白(C-reactive protein,CRP)相比,SAA的優勢在于病毒感染期靈敏度高,升高時間較其他標志物早,而且升高幅度大[3]。因此在感染早期,SAA聯合CRP檢測,能提高鑒別細菌或病毒感染的可靠性[4-5]。目前用于檢測SAA的方法主要有透射比濁法、散射比濁法、乳膠增強免疫比濁法和酶聯免疫吸附法(enzyme-linked immunoSorbent assay,ELISA),關于磁微粒化學發光法未見報道,因此本研究旨在建立一種快速、準確檢測SAA的磁微粒化學發光法,并對其檢測性能進行研究,現報道如下。
1 材料與方法
1.1 研究對象 選取駐馬店中心醫院2018年5~10月疑似細菌或病毒感染患者300例,100例來自正常人體檢樣本。
1.2 試劑與儀器
1.2.1 試劑:基因工程重組SAA抗原、抗SAA小鼠單克隆抗體對(SAA1,SAA2)購自鄭州伊美諾生物技術有限公司;校準品稀釋液為50 mmol/L pH 7.4 TB緩沖液,含有1 mg/dl Casein,0.2 ml/dl P-300;磁珠包被緩沖液為20 mmol/L pH 7.4 PBS緩沖液;封閉液為50 mmol/L pH 7.4 TBS緩沖液,含有2 mg/dl BSA,0.2 ml/dl P-300;對比試劑:西門子試劑盒,血清淀粉樣蛋白A(散射比濁法)測定試劑盒;SAA國際標準品(NIBSC 92/680)購買自英國NIBSC公司。
1.2.2 主要儀器:Auto Lumo A2000 Plus全自動化學發光測定儀(鄭州安圖生物工程股份有限公司)。
1.3 方法
1.3.1 雙抗體夾心法抗體制備
1.3.1.1 包被抗體的制備:取磁珠包被緩沖液300 μl,加入300 μg的磁珠原液反復吹打,置于磁珠分離器上吸取上清后,添加碳二亞胺活化液,室溫反應30 min~1 h,然后加入鼠抗人SAA捕獲抗體偶聯2 h或過夜,偶聯結束后,置于磁珠分離器上吸取上清,加入乙醇胺溶液進行封閉30 min,吸取上清后加入封保液,混勻后置于磁珠分離器,棄上清,重復3~5次后,最后加入封保液定容至3 ml,置于2~8℃保存。
1.3.1.2 辣根過氧化物酶標記SAA抗體的制備:采用過碘酸鈉法標記SAA抗體并用半飽和硫酸銨法純化并透析,取上清加入50ml/dl甘油于-20℃保存。
1.3.2 SAA校準品的制備:使用校準品稀釋液稀釋SAA國際參考品(NIBSC 92/680),濃度分別為200,100,50,25,5mg/L,校準品稀釋液為0 mg/L,同時SAA校準品高點濃度為200 mg/L。
1.3.3 試劑盒的性能指標
1.3.3.1 空白限:準備5份接近0值的臨床樣本,每個樣本重復3次,連續測定4天,按照CLSI EP17-A2的方法進行結果分析,計算空白限。
1.3.3.2 精密度:
1.3.3.2.1 分析內變異:分析內變異是指在同一次分析測定中測定結果的變異情況。按照CLSI EP5-A2的方法分別準備臨床精密度樣本高、中、低濃度三份,各重復測定20次,計算分析內變異。
1.3.3.2.2 分析間變異:分析間變異(也叫天間變異)是指在不同次的分析測定中測定結果的變異情況。按照CLSI EP5-A2的方法,制備臨床精密度樣本高、中、低濃度3份,每天各檢測2次,每次2個重復,連續檢測20天,計算分析間變異。
1.3.3.3 線性:根據CLSI EP06-A文件進行線性范圍的建立。具體方法如下:準備10份濃度約為300 mg/L的臨床高值樣本和1份濃度接近于0的臨床低值樣本按照不同比例混合,制備出10組系列濃度的樣本,作為線性樣本進行測定,計算線性范圍。
1.3.3.4 準確度:用標準品稀釋液稀釋國際標準品,稀釋到線性范圍內的3個濃度樣本。每個樣本重復檢測2次,計算每個樣本檢測濃度與理論濃度的偏差。
1.3.3.5 回收率:根據CLSI EP09文件進行試劑盒的回收率評估。具體方法如下:選擇高值樣本3份,按照1∶9的比例分別加入到3份低值樣本/基質樣本中,制成回收樣本,加入高值樣本的體積不得超過總體積的10%,每個回收樣本重復檢測3次求均值,計算回收率。回收率R=[ C×(V0+VS)-C0×V0]/(CS×VS)×100% ,其中V0為低值樣本的體積,VS為高值樣本的體積,C為回收樣本的檢測濃度,C0為低值樣本的檢測濃度,CS為高值樣本的檢測濃度。
1.3.3.6 鉤狀效應:將SAA抗原加入SAA校準品稀釋液中,配制成系列梯度HOOK樣本(理論濃度分別為10 000,8 000,4 000,2 000 mg/L)進行測定。
1.3.3.7 方法學比對:根據CLSI EP09-A2文件,與對比試劑均在相同條件下進行平行檢測,具體方法如下:分別用本文方法和西門子檢測系統(散射比濁法)同時進行檢測,每份樣本重復3次檢測,計算均值,并進行線性擬合和統計學分析。
1.4 統計學分析 線性擬合采用Excel軟件進行,性能評價按照EP文件的實驗要求,實驗結果采用SPSS20.0軟件進行統計學分析。
2 結果
2.1 空白限 對得到的60個數據進行分析,該檢測方法的空白限為0.1 mg/L。
2.2 精密度 見表1。該方法學的分析內精密度均不高于5%,分析間精密度不高于10%。
2.3 線性 10組回歸方程的相關系數r均大于0.990,10組樣本中每個樣本的實際測得濃度與理論濃度的相對偏差均小于2%,因此本研究建立的SAA檢測方法的線性范圍為2~200 mg/L。
2.4 準確度 用標準品稀釋液稀釋國際標準品,得到線性范圍內的3個濃度樣本。3個稀釋樣本的實測濃度與理論濃度的偏差分別為5.18%,4.94%和6.64%,其偏差均小于試劑盒允許偏倚15%。
2.5 回收率 見表2。10個樣本的回收率在95%~114%之間,符合要求。

表1 分析內、分析間精密度檢測結果
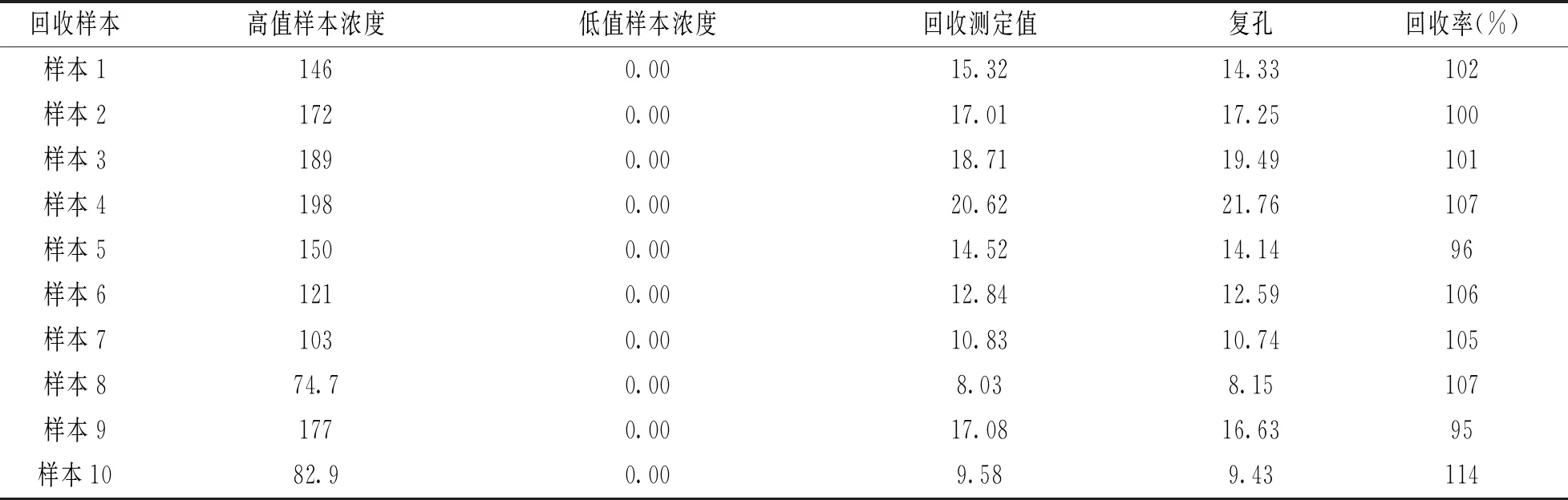
表2 回收率的測定(mg/L)
2.6 鉤狀效應 對濃度為10 000 mg/L的樣本進行測定,結果顯示其信號值回算的濃度值均大于200 mg/L,說明采用本方法學檢測,樣本中SAA濃度高達10 000 mg/L時,未出現鉤狀效應。
2.7 方法學比對 兩種方法同時檢測100例臨床血清(其中60例為細菌或病毒感染患者血清,40例為正常人血清)進行SAA測定,以西門子試劑SAA檢測值為X軸,以安圖磁微粒化學發光試劑SAA檢測值為Y軸,線性回歸方程為:Y=1.099 8X-2.673 9,相關系數(r2)為0.983 4,見圖1。

圖1 相關性擬合曲線
3 討論
SAA屬于一種急性時相反應蛋白,人體中主要在肝臟中合成,在急性時相反應中,由白細胞介素1(interleukin,IL-1)、白細胞介素6(interleukin-6,IL-6)和腫瘤壞死因子α(tumornecrosis factor-α,TNF-α) 刺激誘導產生,這些細胞因子可以與糖皮質激素協同作用以增強SAA的產生[6]。SAA是反映感染性疾病早期炎癥的重要指標,在炎癥或感染急性期48~72 h內迅速升高,并在疾病的恢復期下降,與CRP相比,具有更高的敏感性[7]。現有的研究結果表明,SAA參與了多種疾病如心腦血管疾病、細菌、病毒感染、動脈粥樣硬化、冠心病、急性移植排斥反應、腫瘤、類風濕性關節炎等,并在疾病的發生和發展中起著重要的作用。因此,SAA磁微粒化學發光法的建立具有重要的意義。
SAA檢測方法主要包括免疫比濁法、膠體金法、ELISA,熒光層析法等[8]。免疫比濁法由于儀器的要求高以及原理的缺陷,造成免疫比濁法的檢測結果線性短,檢測結果不準確,而且易受血脂的影響。膠體金法適用于床旁檢驗,并且可以檢測全血,但該方法不利于樣本批量處理。ELISA測定具有較高的靈敏度,但操作過程繁瑣,每次測值均需要繪制標準曲線,準確度誤差大,測定時間較長,儀器昂貴且需要經過一定專業培訓的人員進行操作。化學發光法作為新一代標記免疫測定方法具有高靈敏度、高精密性、易操作等優點,可以很好地滿足臨床科室對感染性疾病快速、準確診斷的需求。
本研究采用磁微粒化學發光免疫檢測法,基于雙抗夾心法原理,搭配全自動免疫檢測儀,靈敏度高、精密度好、線性范圍寬、臨床相關性好,具有一定的臨床應用價值。

