關節腔注射透明質酸鈉對去卵巢大鼠骨關節炎的影響
張興 廖瑛,* 周君 曾亞華 成果 王甜甜 鄧程遠 鐘培瑞
1.南華大學附屬第一醫院骨科,湖南 衡陽 421001 2.南華大學附屬第一醫院康復科,湖南 衡陽 421001
骨性關節炎(osteoarthritis,OA)是關節紊亂的最常見形式,其特征是關節軟骨退化、軟骨下骨重建、關節邊緣反應性新骨形成,從而引起關節疼痛和僵硬,最終導致關節功能障礙而影響生活質量[1]。OA的發病率已成為世界范圍內日益嚴重的健康問題[2]。而關節腔注射透明質酸(hyaluronic acid, HA)因可減輕OA疼痛,并能改善關節活動,保護軟骨是其治療OA最常見的機制[3]。因此探尋透明質酸對OA治療的相關作用機制研究,將有利于進一步尋找抑制病情發生的作用靶點,為OA預防與治療提供新思路。
骨質疏松癥是人類最常見的骨病[4],以絕經后卵巢產生的雌激素降低致使骨質流失的女性最為多見。雖然對于OA與骨質疏松之間的關聯尚未明確,但有不同的報道表明,在嚴重的髖或膝OA患者中,骨量減少和骨質疏松占的比例很大[5],而在遠離膝關節的部位,縱向骨密度喪失與膝OA軟骨的進行性丟失有關[6]。還有研究表明,在OA伴骨質疏松癥的早期發展過程中,可以檢測到骨的變化,這些變化發生在軟骨下骨和膝OA患者的脛骨內[7]。以往的研究主要集中在使用膝關節不穩定所致的實驗性OA動物模型[8]。然而,這些模型可能不適用于原發性OA,尤其是絕經后OA。已有研究證實,動物去卵巢(ovariectomy,OVX)能夠復制OA合并骨質疏松的體內模型,模擬絕經后OA的病理生理進程[9-10]。因此,本實驗聯合膝關節不穩和OVX,在大鼠體內建立表現OA和骨量丟失的模型,以探究透明質酸對OVX大鼠OA模型關節軟骨及軟骨下骨的影響。
1 材料和方法
1.1 材料
1.1.1實驗動物:3月齡雌性SD大鼠30只,平均體重約為256.7 g,購于湖南省斯萊克景達實驗動物有限公司,動物許可證號:SCXK(湘)2016-0002。實驗動物飼養于南華大學動物實驗室,使用許可證號:SYXK(湘)2010-0006。12 h間隔照明,自由活動,環境溫度為 21~27 ℃,濕度為55%~65%。嚴格依照中華人民共和國《實驗動物管理條例》執行。
1.1.2試劑與儀器設備:試劑:透明質酸鈉(玻璃酸鈉,山東博士倫福瑞達制藥有限公司,批準文號:國藥準字H10960136);CTX-I、TRACP5b、BALP的ELISA 試劑盒(編號號:7E2B2C3、7E2B2C5、7E2B2C9,廣州皓躍生物科技有限公司);奧林巴斯光學顯微鏡(CX41,奧林巴斯,日本);MSE Micro-Centaur Centrifuge 微型臺式離心機(LD5-10B,Sanyo,Japan);Micro-CT(型號:ZKKS-MCT-Sharp,廣州中科愷盛醫療科技有限公司)。
1.2 實驗方法
1.2.1實驗分組與造模:將30只SD雌性大鼠采用隨機統計學分成 3 組,每組10只,分別為:假手術組、OVX-ACLT 組(去卵巢-橫斷雙側膝關節前交叉韌帶骨關節炎組)、治療組(去卵巢-橫斷雙側膝關節前交叉韌帶骨關節炎+透明質酸鈉治療組)。參照文獻[11]:OVX-ACLT 組及治療組均采用去卵巢+橫斷大鼠的雙膝關節前交叉韌帶方法(OVX-ACLT術)建立骨質疏松合并OA動物模型。術后每只動物予青霉素4萬U肌肉注射2周,預防性抗感染治療。術后2周,治療組:雙側膝透明質酸鈉50μg[12]關節腔注射,每周 1 次,共治療12 周;ACLT 組:雙膝等量生理鹽水,關節腔注射,每周 1次,共治療12 周;假手術組:不做任何特殊處理。實驗期間所有的大鼠均是自由活動和攝食飲水。
1.2.2標本采集及處理:每組實驗動物于治療12周后取血,頸椎脫臼法處死,留取標本。眼眶靜脈叢取血約3~5 mL,血液予以離心機離心后,取上層血清,保存于約-80 ℃冰箱中。取左側脛骨近端,鈍性分離軟組織,生理鹽水反復沖洗后,切片后行番紅固綠HE染色。取右側脛骨近端置于 40 g/L多聚甲醛中固定,保存送檢。
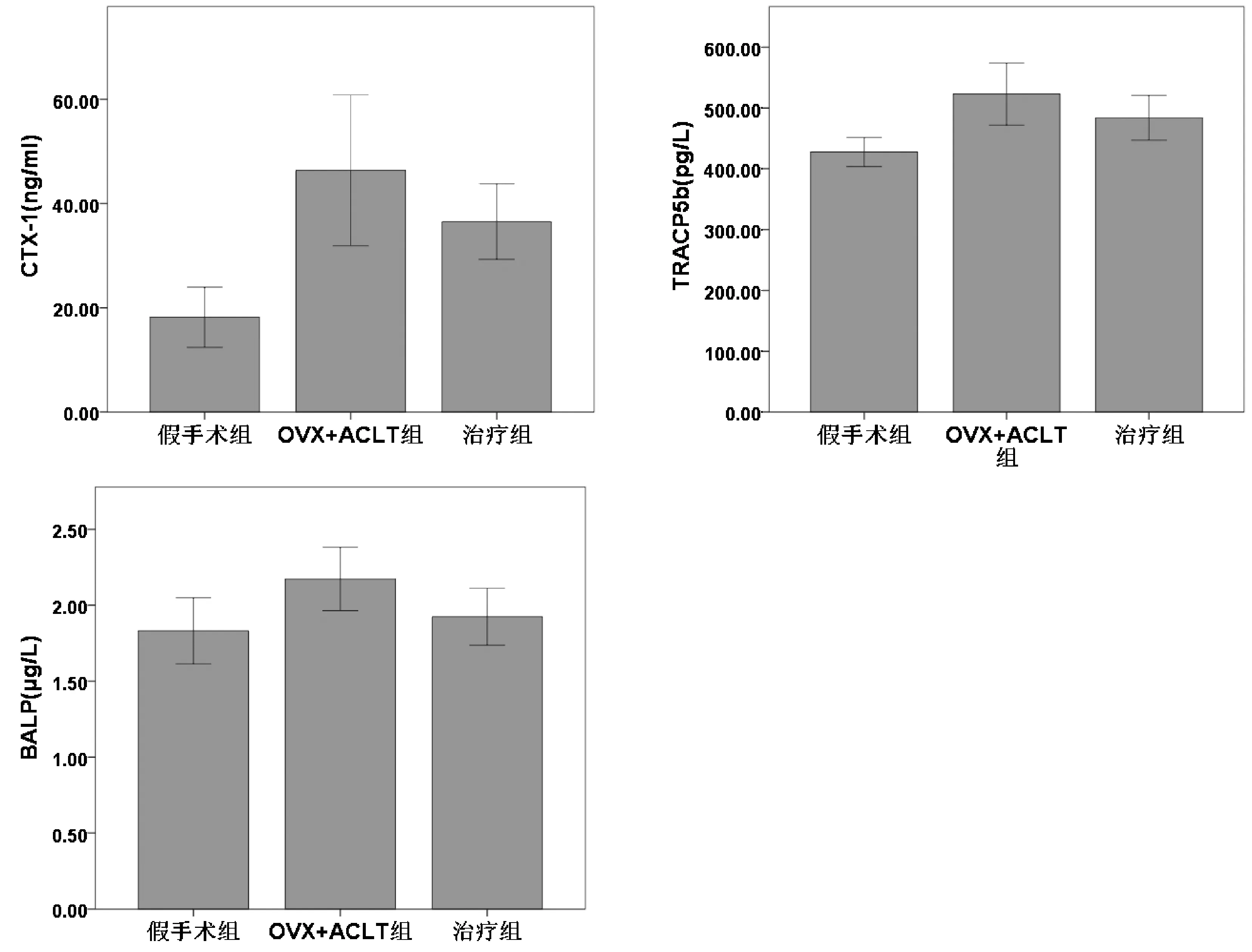
圖1 3組CTX-I、TRACP5b、BALP濃度比較Fig.1 Comparison of CTX-I, TRACP5b, and BALP concentrations among the three groups
1.2.3血清 CTX- Ⅰ、TRACP5b、BALP檢測:使用ELISA測定 CTX- Ⅰ、TRACP5b、BALP等指標(應用雙抗體一步夾心法酶聯免疫吸附試驗)。
1.2.4組織形態學觀察及 Mankin 評分:對左側脛骨近端軟骨組織切片后行番紅固綠染色。按照改良 Mankin評分標準[13],分別從軟骨組織結構、細胞數量、AB-PAS染色情況、潮線改變等評估關節損傷程度。其中 0~1 分為正常,2~5 分為輕度,6~9 分為中度,10~14 分為重度。
1.2.5Micro-CT技術觀察軟骨下骨:將固定于40 g/L多聚甲醛大鼠右側脛骨近端軟骨下骨取出后置于Micro-CT設備中進行檢測。分別從骨體積分數(bone volume fraction,BV/TV)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁數量(trabecular number,Tb.N)、骨小梁分離度(trabecular separation,Tb.Sp)等方面對軟骨下骨行定量分析。
1.3 統計學處理
2 結果
2.1 3組血清 CTX-Ⅰ、TRACP5b、BALP濃度比較
術12 周與假手術組比較,OVX-ACLT組中CTX-I、TRACP5b、BALP水平顯然高于假手術組(P<0.01、P<0.05、P<0.05);治療組中CTX-I、TRACP5b、BALP水平顯然低于OVX-ACLT組(P<0.05、P<0.05、P<0.05)。見圖1。
2.2 光鏡下3組軟骨形態學及軟骨Mankin評分比較
假手術組:軟骨細胞與基質分布均勻,潮線清晰連續,軟骨表層光滑,軟骨層面完整。OVX-ACLT組:軟骨細胞與基質分布紊亂,潮線模糊不完整,軟骨表層破壞,軟骨組織缺失,裂隙增寬。治療組:軟骨組織結構排列尚有一定序列,可見潮線完整連續,軟骨表層輕度粗糙,關節軟骨輕微變窄。3組Mankin評分比較:OVX-ACLT組較假手術組明顯增高(P<0.01);治療組較OVX-ACLT組明顯減低(P<0.01)。見圖2、表1。
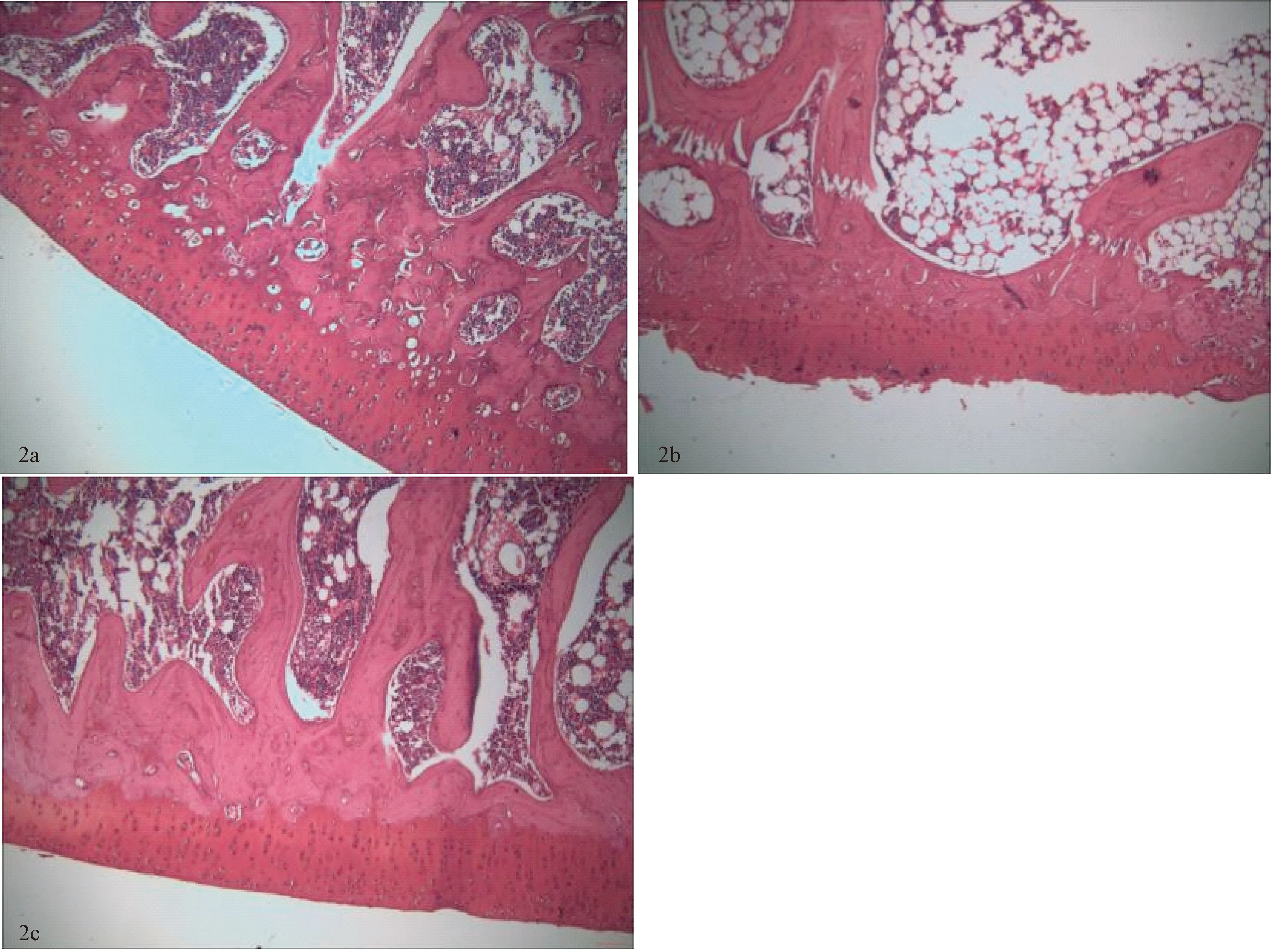
圖2 3組軟骨組織形態學比較(番紅染色 ×10)Fig.2 Comparison of cartilage tissue morphology among the three groups (saffron-stained, 10×)a.Sham-operated group; b.ACLT group;c.Treatment group.

組別Mankin評分假手術組0.96±0.71OVX-ACLT組8.89±1.67?治療組2.56±1.42#
注:與假手術組比較,*P<0.01;與 OVX-ACLT組比較,#P<0.01。
2.3 3組脛骨近端軟骨下骨Micro-CT比較及骨量分析
通過脛骨近端軟骨下骨Micro-CT比較及骨量分析可見:治療后12周,OVX-ACLT組的BV/TV、Tb.N值較假手術組明顯降低(分別P<0.01、P<0.01),而Tb.Sp值較假手術組明顯增高(P<0.01),Tb.Th兩組對比差異無統計學意義(P>0.05)。治療組的BV/TV、Tb.N值較OVX-ACLT組明顯增高(分別P<0.01、P<0.01),而Tb.Sp值較OVX-ACLT組明顯減低(P<0.01),Tb.Th兩組對比差異無統計學意義(P>0.05)。見圖3、圖4。
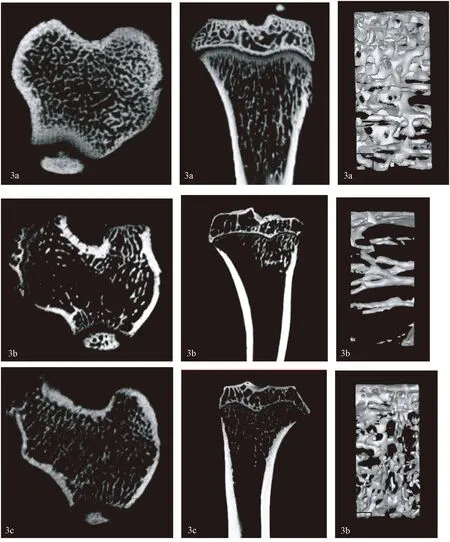
圖3 軟骨下骨顯微CT圖像a.假手術組 b.OVX-ACLT組 c.治療組。Fig.3 Image of subchondral bone under micro-CTa.sham-operation group; b.OVX-ACLT group; c.treatment group.
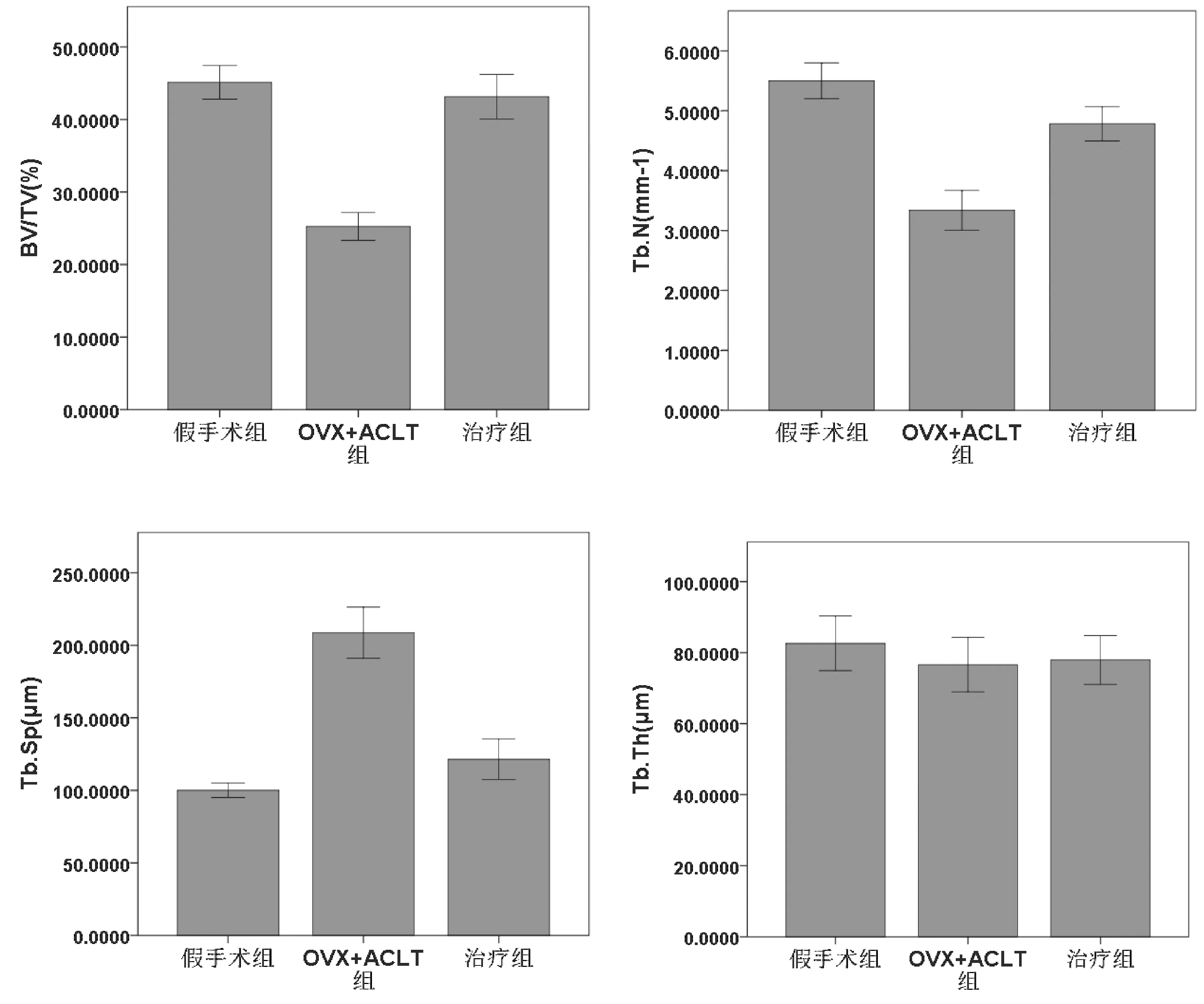
圖4 3組脛骨近端軟骨下骨定量分析Fig.4 Quantitative analysis of subchondral bone of the proximal tibia in the three groups
3 討論
OA現在被認為是一種全局性的關節衰竭,涉及關節的所有組織:軟骨、滑膜和軟骨下骨[14]。近年來,許多研究集中在軟骨下骨在該病病理生理特征中的作用。軟骨下骨是幾種動態形態改變的場所,涉及一個重建進程[15]。在OA中,軟骨下骨表現為骨吸收和骨形成的加速期[16],這些變化與成骨細胞代謝的改變有關,從而導致可溶性介質的異常生成。這種由骨細胞產生的介質可以通過骨軟骨界面影響深層軟骨細胞[17]。臨床上,癥狀性OA患者軟骨下骨層面MRI上顯示更多的骨質病變,從而強化了軟骨下骨的中心作用假說。因此,軟骨下骨細胞可作為治療OA和減少軟骨降解的靶點。為了評價軟骨下骨成骨細胞在OA過程中的作用,我們將在大鼠體內建立表現OA和骨量丟失的模型(即OVX-ACLT),為透明質酸治療OA機制提供新的科學證據。
臨床和流行病學研究表明,絕經后女性因雌激素水平的急劇下降,致使OA的發病率和嚴重程度均增加[18]。在基礎實驗中已有證據表明,動物前交叉韌帶橫斷結合去卵巢完全可以建立OA合并骨質疏松的體內模型,并模擬絕經后OA發生、發展的病理過程[11,19]。而且Bellido等[20]研究發現,OVX-ACLT模型組的軟骨損傷程度明顯高于單純ACLT橫斷OA模型組。本實驗發現OVX-ACLT組軟骨Mankin評分較假手術組的顯然增高,鏡下可見軟骨細胞與基質分布紊亂,潮線模糊不完整,軟骨表層破壞,軟骨組織缺失,裂隙增寬,表明軟骨嚴重受損。而通過Micro-CT圖像顯示:OVX-ACLT組軟骨下骨較假手術組明顯骨小梁連接稀疏、結構錯亂、分布面積窄,同時骨量分析可看出OVX-ACLT組BV/TV、Tb.N值較假手術組明顯減低,而Tb.Sp顯然增高,提示OVX-ACLT組骨組織密度減低,說明存在骨質疏松現象。與此同時,OVX-ACLT組中血清TRACP5b、BALP值明顯高于假手術組,而TRACP5b、BALP可作為骨質代謝變化的敏感指標[21-22],其值往往與骨密度表現為負相關性,表明OVX-ACLT組骨量丟失。本實驗通過大鼠前交叉韌帶橫斷與去卵巢成功建立OA合并骨質疏松的體內模型,并模擬了絕經后相關OA的病理生理過程。
骨質疏松主要以骨量的丟失、骨微結構破壞為主,本實驗發現軟骨下骨已存在骨質疏松現象。而軟骨下骨作用于軟骨的主要功能是為軟骨吸收應力、緩沖震蕩防止軟骨損傷和撐持軟骨形狀使其受力勻稱,從而影響軟骨細胞的代謝等[23]。當骨質疏松發生時,致使軟骨下骨骨代謝重建失常,削弱了對軟骨吸收應力的能力,導致過量的應力傳導使軟骨損傷,從而促進了OA的發病進程[24]。已有研究報道,骨質疏松致使軟骨下骨骨量的丟失,會加速軟骨的損傷,對OA的發生及發展起到重要作用[15,25]。因此在OA發生及進展中軟骨下骨的異常改變發揮重要作用,其可作為OA預防及治療的新靶點[26]。
透明質酸為大分子鏈狀糖胺多糖,廣泛分布于軟骨細胞和滑膜細胞中,作為關節軟骨的潤滑劑,屏障和緩沖劑,可防止軟骨損傷或變性,從而延緩OA的進程[27]。國內外大量的研究,已基本明確HA對軟骨的保護及修復作用[3,28]。另有研究表明,HA能穿透OA軟骨外植體并與軟骨細胞結合[29]。Hiraoka等[30]發現熒光透明質酸在兔OA模型關節內注射后,被發現穿透軟骨下骨。在OA關節中,軟骨和軟骨下骨之間出現血管化和微裂紋,允許物質直接在軟骨和軟骨下骨之間移動[31]。Mladenovic等[32]發現HA可能調控RANKL/RANK/OPG信號通路影響軟骨下骨的骨吸收和骨形成,從而影響軟骨下骨骨重建,維持軟骨下骨中破骨細胞和成骨細胞的代謝動態平衡,使軟骨下骨保持正常的生物力學性能,從而抑制關節軟骨退變。同時,HA還可以通過與CD44結合來抑制基質金屬蛋白酶-13(matrix metalloproteases 13,MMP-13)的表達來保護軟骨下骨的微結構,從而抑制軟骨退變[30,32]。CTX-Ⅰ是膠原蛋白降解的衍生物,它也是骨代謝指標重要指標之一,可間接反映軟骨下骨的活性。本實驗發現,OVX-ACLT組CTX-I水平較假手術組顯然增高,而治療組較OVX-ACLT組顯然降低,與此同時,治療組中TRACP5b、BALP值也較OVX-ACLT組減低,說明通過關節腔注射HA后可防止軟骨下骨骨量過分的丟失,維持軟骨下骨強度,為關節軟骨提供生物力學支撐。而在Micro-CT圖像顯示:治療組脛骨近端軟骨下骨較OVX-ACLT組骨小梁連接緊密、結構規律、分布面積廣,在骨量分析可看出治療組BV/TV、Tb.N值較OVX-ACLT組明顯增高,而Tb.Sp顯然降低,說明關節腔注射HA可以改善軟骨下骨的骨質疏松現象,改變軟骨下骨顯微結構,減少軟骨的應力負荷。此外,通過關節腔注射HA改善軟骨下骨后,治療組較OVX+ACLT組中軟骨Mankin評分顯然減低,有效的抑制了軟骨退變。
綜上,利用SD大鼠前交叉韌帶橫斷與去卵巢可成功建立OA合并骨質疏松的體內模型,并模擬絕經后相關OA的病理生理過程。本實驗通過關節腔注射HA治療OA可有效地改善骨小梁的結構,增強軟骨下骨硬度和強度,使軟骨下骨的順應性加強,從而減少軟骨的應力吸收,防止軟骨的損傷。雖然對于HA具體如何作用軟骨下骨達到治療OA的效果機制尚未明確,但軟骨下骨在OA的發生、發展的病理變化中扮演著重要角色,其可作藥物治療OA潛在靶點。

