淺析白鎢分解的理論與工藝
陳升 戴林明 熊慶 李俊榮 周澤平 林銘


摘要:本文論述了白鎢分解的幾種工藝,總體來說包括NaOH分解工藝、Na2CO3高壓浸出工藝等難溶性鈣鹽堿法浸出工藝以及使用HCl浸出、HNO3浸出生成固體鎢酸的可溶性鈣鹽的酸法浸出工藝。另外還介紹了硫磷混酸協(xié)同分解工藝和NaF分解工藝等其他能夠有效浸出白鎢的工藝。目前白鎢分解工藝中均存在各種各樣的問題,現(xiàn)在急需開發(fā)出一種清潔高效的分解工藝來實(shí)現(xiàn)鎢行業(yè)可持續(xù)發(fā)展的目標(biāo)。
Abstract: This paper discusses several processes for the decomposition of white tungsten. In general, it includes the NaOH decomposition process, the Na2CO3 high-pressure leaching process and other insoluble calcium salt alkali leaching processes, and acid leaching process using HCl leaching and HNO3 leaching to form soluble calcium salt of solid tungstic acid. In addition, the synergistic decomposition process of sulfur-phosphorus mixed acid and NaF decomposition process and other processes capable of effectively leaching white tungsten are also introduced. At present, there are various problems in the decomposition process of white tungsten, and it is urgent to develop a clean and efficient decomposition process to achieve the goal of sustainable development of the tungsten industry.
關(guān)鍵詞:白鎢礦;堿分解;酸分解;平衡常數(shù)
Key words: scheelite;alkali decomposition;acid decomposition;equilibrium constant
中圖分類號:TF841? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻(xiàn)標(biāo)識碼:A? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文章編號:1006-4311(2019)26-0148-03
0? 引言
我國是鎢資源大國,鎢礦儲(chǔ)量占世界儲(chǔ)量的60%。在鎢資源的儲(chǔ)量中,白鎢礦(CaWO4)占比約70%,黑鎢礦(FeWO4、MnWO4)占比約20%,其余的10%是黑白鎢混合礦[1]。由于黑鎢礦易于選冶的特性,以及生產(chǎn)技術(shù)水平的限制,自20世紀(jì)70年代以來,我國長時(shí)間將黑鎢礦作為鎢冶煉的首選資源[2]。隨著中國黑鎢資源的逐漸消耗,鎢資源形式也有了較大的變化,白鎢礦、復(fù)雜礦、低品位復(fù)雜中礦在鎢資源中所占的比重越來越大,這也對目前的分解提出了更高的技術(shù)要求。我國諸多學(xué)者也在白鎢礦與復(fù)雜混合鎢礦等鎢資源的分解等方面做了大量和研究。大體的方向主要包括基于生成難溶性鈣鹽的堿法浸出工藝、生成可溶性鈣鹽的酸性浸出工藝以及其他浸出工藝[3]。
1? 難溶鈣鹽堿法浸出
堿法浸出白鎢礦(CaWO4),其本質(zhì)無非是將Ca2+與WO42-分離,而分離的主要手段是降低水相中的Ca2+活度,使Ca2+進(jìn)入固相,WO42-留在液相,使得兩者分離,從而使浸出反應(yīng)能夠向右進(jìn)行[4][5]。其主要反應(yīng)式為:
浸出過程中,Ca2+陽離子與n價(jià)Sn-陰離子形成難溶鈣鹽留在固相中,WO42-進(jìn)入液相,鐵、錳等雜質(zhì)也存留在固相中,從而達(dá)到Ca2+與WO42-分離的目的。
1.1 NaOH分解白鎢工藝
NaOH分解白鎢工藝為工業(yè)應(yīng)用中應(yīng)用最早的方法之一,20世紀(jì)80年代之前NaOH主要應(yīng)用于黑鎢精礦的分解當(dāng)中。其反應(yīng)為:
CaWO4 (s)+2NaOH (aq)=Na2WO4+Ca(OH)2 (s)(2)
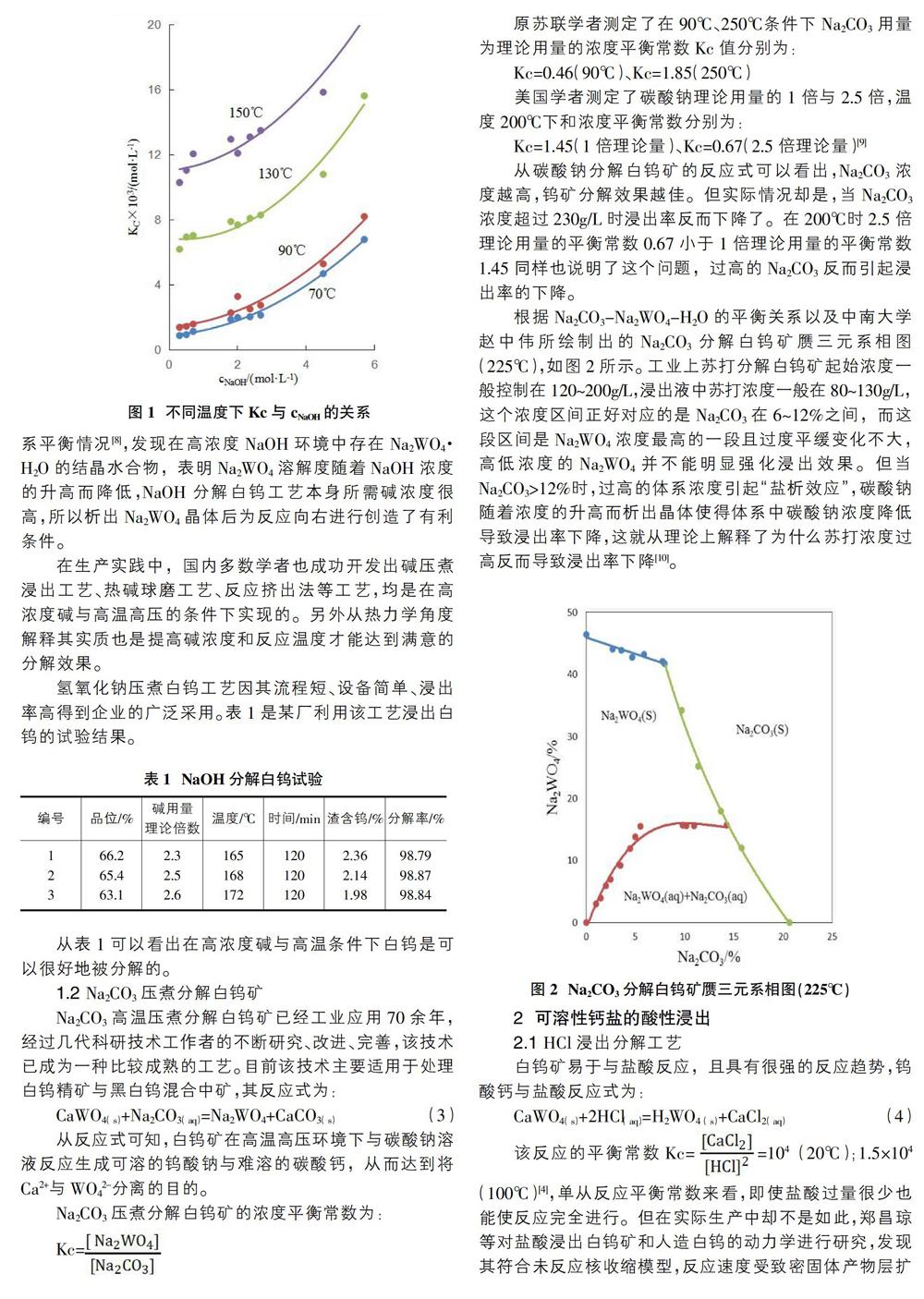
從該反應(yīng)的熱力學(xué)計(jì)算得知,該反應(yīng)平衡常數(shù)Ka=2.5×10-4(25℃);Ka=0.7×10-4(90℃)[3],平衡常數(shù)Ka值很小。并且該數(shù)值中適用于在物質(zhì)活度等于1的條件下即極稀溶液中[6]。基于此理論,國內(nèi)外許多學(xué)者認(rèn)為NaOH是無法分解白鎢礦的。但在工業(yè)實(shí)踐中,反應(yīng)物與生成物的濃度均很高,此種情況平衡常數(shù)應(yīng)根據(jù)物質(zhì)濃度c來計(jì)算才更具實(shí)際意義,其物質(zhì)濃度平衡常數(shù)Kc式中[Na2WO4]為反應(yīng)平衡后的Na2WO4濃度,mol/L;[NaOH]為反應(yīng)平衡后的NaOH的濃度,mol/L。孫培梅等人通過實(shí)驗(yàn)測定了不同溫度和不同氫氧化鈉濃度的條件下白鎢堿分解反應(yīng)的平衡常數(shù)Kc,發(fā)現(xiàn)白鎢礦堿分解反應(yīng)的平衡常數(shù)Kc隨著NaOH的濃度和反應(yīng)溫度的升高而明顯增大[5],如圖1所示,當(dāng)[OH-]為2.0mol/L,反應(yīng)溫度在70、90、130、150℃下的Kc值分別為2.0×10-3、3.3×10-3、7.7×10-3、12.1×10-3[3][7]。
我國學(xué)者李洪桂所研究的Na2WO4-NaOH-H2O三元系平衡情況[8],發(fā)現(xiàn)在高濃度NaOH環(huán)境中存在Na2WO4·H2O的結(jié)晶水合物,表明Na2WO4溶解度隨著NaOH濃度的升高而降低,NaOH分解白鎢工藝本身所需堿濃度很高,所以析出Na2WO4晶體后為反應(yīng)向右進(jìn)行創(chuàng)造了有利條件。
在生產(chǎn)實(shí)踐中,國內(nèi)多數(shù)學(xué)者也成功開發(fā)出堿壓煮浸出工藝、熱堿球磨工藝、反應(yīng)擠出法等工藝,均是在高濃度堿與高溫高壓的條件下實(shí)現(xiàn)的。另外從熱力學(xué)角度解釋其實(shí)質(zhì)也是提高堿濃度和反應(yīng)溫度才能達(dá)到滿意的分解效果。
氫氧化鈉壓煮白鎢工藝因其流程短、設(shè)備簡單、浸出率高得到企業(yè)的廣泛采用。表1是某廠利用該工藝浸出白鎢的試驗(yàn)結(jié)果。
從表1可以看出在高濃度堿與高溫條件下白鎢是可以很好地被分解的。
1.2 Na2CO3壓煮分解白鎢礦
Na2CO3高溫壓煮分解白鎢礦已經(jīng)工業(yè)應(yīng)用70余年,經(jīng)過幾代科研技術(shù)工作者的不斷研究、改進(jìn)、完善,該技術(shù)已成為一種比較成熟的工藝。目前該技術(shù)主要適用于處理白鎢精礦與黑白鎢混合中礦,其反應(yīng)式為:
CaWO4 (s)+Na2CO3 (aq)=Na2WO4+CaCO3 (s)(3)
從反應(yīng)式可知,白鎢礦在高溫高壓環(huán)境下與碳酸鈉溶液反應(yīng)生成可溶的鎢酸鈉與難溶的碳酸鈣,從而達(dá)到將Ca2+與WO42-分離的目的。
Na2CO3壓煮分解白鎢礦的濃度平衡常數(shù)為:
原蘇聯(lián)學(xué)者測定了在90℃、250℃條件下Na2CO3用量為理論用量的濃度平衡常數(shù)Kc值分別為:
Kc=0.46(90℃)、Kc=1.85(250℃)
美國學(xué)者測定了碳酸鈉理論用量的1倍與2.5倍,溫度200℃下和濃度平衡常數(shù)分別為:
Kc=1.45(1倍理論量)、Kc=0.67(2.5倍理論量)[9]
從碳酸鈉分解白鎢礦的反應(yīng)式可以看出,Na2CO3濃度越高,鎢礦分解效果越佳。但實(shí)際情況卻是,當(dāng)Na2CO3濃度超過230g/L時(shí)浸出率反而下降了。在200℃時(shí)2.5倍理論用量的平衡常數(shù)0.67小于1倍理論用量的平衡常數(shù)1.45同樣也說明了這個(gè)問題,過高的Na2CO3反而引起浸出率的下降。
根據(jù)Na2CO3-Na2WO4-H2O的平衡關(guān)系以及中南大學(xué)趙中偉所繪制出的Na2CO3分解白鎢礦贗三元系相圖(225℃),如圖2所示。工業(yè)上蘇打分解白鎢礦起始濃度一般控制在120~200g/L,浸出液中蘇打濃度一般在80~130g/L,這個(gè)濃度區(qū)間正好對應(yīng)的是Na2CO3在6~12%之間,而這段區(qū)間是Na2WO4濃度最高的一段且過度平緩變化不大,高低濃度的Na2WO4并不能明顯強(qiáng)化浸出效果。但當(dāng)Na2CO3>12%時(shí),過高的體系濃度引起“鹽析效應(yīng)”,碳酸鈉隨著濃度的升高而析出晶體使得體系中碳酸鈉濃度降低導(dǎo)致浸出率下降,這就從理論上解釋了為什么蘇打濃度過高反而導(dǎo)致浸出率下降[10]。
2? 可溶性鈣鹽的酸性浸出
2.1 HCl浸出分解工藝
白鎢礦易于與鹽酸反應(yīng),且具有很強(qiáng)的反應(yīng)趨勢,鎢酸鈣與鹽酸反應(yīng)式為:
CaWO4 (s)+2HCl(aq)=H2WO4? (s)+CaCl2 (aq)(4)
該反應(yīng)的平衡常數(shù)Kc=104(20℃);1.5×104(100℃)[4],單從反應(yīng)平衡常數(shù)來看,即使鹽酸過量很少也能使反應(yīng)完全進(jìn)行。但在實(shí)際生產(chǎn)中卻不是如此,鄭昌瓊等對鹽酸浸出白鎢礦和人造白鎢的動(dòng)力學(xué)進(jìn)行研究,發(fā)現(xiàn)其符合未反應(yīng)核收縮模型,反應(yīng)速度受致密固體產(chǎn)物層擴(kuò)散控制[11]。
在反應(yīng)過程中,白鎢礦顆粒與鹽酸反應(yīng)生成固體鎢酸包裹礦物顆粒,影響傳質(zhì)過程和浸出速率,從而導(dǎo)致浸出率下降。因此,為提高浸出率,主要目標(biāo)是削弱鎢酸膜的影響。目前主要的方法是:一方面是提高反應(yīng)溫度,減小鎢礦粒度增加有效反應(yīng)面積,另一方面強(qiáng)化攪拌,破壞阻隔反應(yīng)的鎢酸膜[12]。
在仲鎢酸銨的生產(chǎn)中,對于采用離子交換工藝的企業(yè),目前分解白鎢大多仍然是采用的NaOH分解工藝,但出于堿耗高等壓力,有些企業(yè)會(huì)采用酸堿協(xié)同分解的工藝,好的礦用NaOH分解,雜礦或較差的礦則采用酸法分解制成鎢酸,再利用堿分解線的余堿將鹽酸分解制成的鎢酸溶解制成鎢酸鈉溶液,這種酸堿協(xié)同分解工藝即提高了分解率又降低了堿耗。不過對于現(xiàn)實(shí)工業(yè)實(shí)踐中,鹽酸分解雖然效果比較好,但是酸分解現(xiàn)場操作環(huán)境差,相關(guān)設(shè)備易受腐蝕等問題也同樣困擾著生產(chǎn)企業(yè)。另一方面鹽酸分解對礦源的雜質(zhì)要求也比較高,當(dāng)白鎢礦中砷、硅、鉬、銻等雜質(zhì)元素較高時(shí),鹽酸分解會(huì)與其形成可溶性極好的雜多酸離子而與Ca2+一同進(jìn)入液相[13],從而導(dǎo)致浸出率下降。
2.2 HNO3分解工藝
與鹽酸分解白鎢工藝相同,HNO3同樣具有較高的反應(yīng)趨勢,其反應(yīng)式為:
CaWO4 (s)+2HNO3 (aq)=H2WO4+Ca(NO3)2 (aq)(5)
其平衡濃度常數(shù)為757,與鹽酸分解相比,硝酸分解白鎢的反應(yīng)機(jī)理大致相同,只不過硝酸分解白鎢對設(shè)備耐腐蝕性要求相對較低。同樣的,硝酸分解同樣的也存在鎢酸膜包裹礦物顆粒的問題,解決的方法與鹽酸分解白鎢礦大致相同。
3? 其他浸出工藝
3.1 H2SO4-H3PO4協(xié)同分解工藝
面對目前鎢資源約束趨緊、國家對環(huán)保要求日趨嚴(yán)格,如何實(shí)現(xiàn)低品位,復(fù)雜共伴生鎢資源的高效清潔利用已是一個(gè)關(guān)系到行業(yè)可持續(xù)發(fā)展的重要課題。中南大學(xué)的趙中偉研究的白鎢硫磷混酸協(xié)同分解技術(shù)實(shí)現(xiàn)常壓條件下協(xié)同分解白鎢礦,其分解反應(yīng)式為:
12CaWO4 (s)+H3PO4+12H2SO4=12CaSO4·nH2O(s)+H3[PW12O40] (aq)+12H2O(6)
從硫磷混酸分解白鎢的反應(yīng)式可看出,1mol的磷就能夠絡(luò)合12mol的鎢,只需要很少的磷就能夠高效地浸出白鎢,鈣則以硫酸鈣的形式進(jìn)入渣相,鎢則以可溶性磷鎢雜多酸的形式進(jìn)入到液相中,從而達(dá)到Ca2+與WO42-分離的目標(biāo)[13]。
何利華等人通過試驗(yàn)得出結(jié)論:浸出時(shí)間3~4小時(shí)、硫酸耗量理論量、溫度為80~90℃時(shí),白鎢標(biāo)礦浸出率可達(dá)99%以上。相比傳統(tǒng)的白鎢分解工藝,硫磷混酸協(xié)同分解工藝具有對白鎢原料適應(yīng)性強(qiáng)、絡(luò)合劑磷酸耗量小、浸出效率高、廢水量少等優(yōu)點(diǎn)。
3.2 NaF浸出工藝
在眾多白鎢浸出工藝中,目前主要仍是以鈉體系為主。鈉鹽體系中除傳統(tǒng)的NaOH與Na2CO3之外,NaF也具有較好的浸出效果,反應(yīng)式為[14]:
CaWO4 (s)+2NaF(a q)=Na2WO4 (aq)+CaF2 (s)(7)
NaF分解白鎢具有分解率高,雜質(zhì)元素浸出率低,但出于環(huán)保方面的危害,F(xiàn)-對動(dòng)植物傷害很大,因此此方法并沒有得到應(yīng)用。
4? 結(jié)語
在當(dāng)前眾多的白鎢分解工藝中,難溶性鈣鹽的堿法浸出工藝普遍存在能耗大、成本高等問題。2016年環(huán)保部將仲鎢酸銨(APT)生產(chǎn)過程中堿分解產(chǎn)生的堿分解渣列為危險(xiǎn)廢物后,堿浸鎢渣的處理與去向又將是個(gè)難題。可溶性鈣鹽的酸性浸出工藝又存在對礦源要求高、操作環(huán)境差,設(shè)備腐蝕嚴(yán)重等問題。就目前的鎢資源結(jié)構(gòu)而言,白鎢的占比將變大同時(shí)品質(zhì)也將變差,傳統(tǒng)的生產(chǎn)工藝將面臨嚴(yán)峻的挑戰(zhàn)。除本文所述的這些分解方法外,還有許許多多可以有效分解白鎢的方法,但同樣的存在這樣那樣的問題需要完善與解決。因此,開發(fā)出一種低能耗、經(jīng)濟(jì)、清潔的白鎢處理工藝迫在眉睫,這也是實(shí)現(xiàn)我國鎢工業(yè)資源的可持續(xù)發(fā)展,經(jīng)濟(jì)發(fā)展與環(huán)境保護(hù)相協(xié)調(diào)的重要任務(wù)。
參考文獻(xiàn):
[1]孫延綿.論我國白鎢資源現(xiàn)狀及其開發(fā)利用[J].礦業(yè)研究與開發(fā),2003(S1):69-72.
[2]朱俊.中國鎢資源前景探討[J].中國鎢業(yè),1997(11):13-16.
[3]楊金洪.我國鎢礦物原料NaOH分解的理論與工藝研究進(jìn)展[J].中國鎢業(yè),2009,24(03):28-31.
[4]李停停,鐘祥熙,張威,張津,沈巖柏,魏德洲.白鎢礦浸出工藝現(xiàn)狀及發(fā)展趨勢[J].金屬礦山,2017(10):128-134.
[5]孫培梅,李運(yùn)姣,李洪桂,劉茂盛.白鎢堿分解過程的熱力學(xué)研究[J].中國有色金屬學(xué)報(bào),1993(02):37-39,43.
[6]徐迎春,姜萍.白鎢礦浸出工藝的現(xiàn)狀及發(fā)展方向[J].世界有色金屬,2004(12):21-23.
[7]趙中偉.鎢冶煉的理論與應(yīng)用[M].北京:清華大學(xué)出版社,2013:106-107.
[8]李洪桂,羊建高,李昆.鎢冶金學(xué)[M].長沙:中南大學(xué)出版社,2010:54-55.
[9]萬林生.鎢冶金/現(xiàn)代有色金屬冶金科學(xué)技術(shù)叢書[M].北京:冶金工業(yè)出版社,2011:54-55.
[10]趙中偉.鎢冶煉的理論與應(yīng)用[M].北京:清華大學(xué)出版社,2013:117-118.
[11]鄭昌瓊,李自強(qiáng),張正元.鹽酸分解白鎢精礦動(dòng)力學(xué)初步研究[J].稀有金屬,1980(06):11-17.
[12]He Guixiang,Zhao Zhongwei,Wang Xiaobo,et al.leaching kinetics of scheelite in hydrochloric acid solution containing hydrogen peroxide as complexing agent [J].Hydrometallurgy,2014,144:140-147.
[13]何利華,趙中偉,楊金洪.新一代綠色鎢冶金工藝——白鎢硫磷混酸協(xié)同分解技術(shù)[J].中國鎢業(yè),2017,32(03):49-53.
[14]張啟修,趙秦生.鎢鉬冶金[M].北京:冶金工業(yè)出版社,2007:104-105.
[15]劉玉霞,朱杰勇.云南文山官房鎢礦區(qū)隱伏花崗巖形態(tài)預(yù)測及找礦[J].價(jià)值工程,2014,33(02):294-296.

