病理大切片結合人工智能在胰腺腫瘤診療中的應用前景
蔣慧 邊云 鄭建明
1海軍軍醫大學附屬長海醫院病理科,上海 200433;2海軍軍醫大學附屬長海醫院醫學影像科,上海 200433
【提要】 病理大切片能夠整體、全面地將腫瘤及腫瘤周圍組織完整地呈現在一張切片上,有利于對腫瘤及其周圍微環境進行全面觀察和評估,提高對疾病的全面認識。隨著數字化病理的逐步實現及計算病理的進步,利用人工智能將病理大切片中不同腫瘤細胞的形態和周圍微環境的病理組織形態與各種不同類型的數據包括影像組學、基因蛋白組學、臨床診療數據等聯系起來,更好地實現胰腺腫瘤的精準及個體化診療,這對我國科研工作者來說既是機遇也是挑戰。
病理學是胰腺腫瘤診療中的一門重要學科。病理圖像上呈現的腫瘤真實世界不僅包括腫瘤細胞本身,也包括腫瘤間質、免疫微環境及其周圍背景病理等[1-2],所有這些因素對腫瘤的診斷、治療及預后判斷都至關重要。在過去的10年間,包括基因高通量測序、轉錄組學、蛋白質組學和臨床信息在內的大量跨組學數據的聚合,使得研究人員能夠識別與腫瘤發展相關的基因突變和基因表達特征[3-6]。但腫瘤的異質性特征使人們忽視了從腫瘤局部取樣得出的基因組學數據[7],且通過組織研磨進行分析的結果可能會失去對腫瘤間質反應和腫瘤免疫微環境的理解[8-9]。隨著全載玻片成像掃描(whole slide imaging,WSI)技術的出現,病理圖像正逐步實現數字化,在此基礎上產生的計算病理(computational pathology,CP)和大量擁有分子和組織病理學數據的腫瘤樣本的積累,使研究人員可以研究腫瘤的形態學特征與各種組學數據間的關系,從而彌補由于腫瘤異質性導致的對腫瘤局部活檢樣本作出的基因組學信息評估不足的缺陷,為實現腫瘤的精準醫療奠定基礎[10-11]。
目前計算病理的研究主要集中于組織芯片及傳統小切片上,它的缺點在于無法對腫瘤及其周圍背景病理進行全面的認識和剖析。而病理大切片技術的應用可以解決這一問題,其最大優勢是能夠整體、全面地將腫瘤及其周圍組織完整展現在一張切片上,有利于對腫瘤及周圍微環境的全面觀察與評估,并可與影像圖像進行比對,提高對疾病的全面認識。近年來筆者所在長海醫院胰腺疾病MDT診療團隊在全國率先開展胰腺腫瘤的大組織取材并實現大組織切片的數字化。這一技術的開展有助于全面地觀察胰腺腫瘤的全貌及其毗鄰關系、腫瘤的分布、生長方式等,從而加深對腫瘤及其背景病理的認識。同時病理大切片有利于與影像圖像進行比對,提高了對疾病的全面及本質認識。目前最大的機遇也是挑戰的是利用人工智能(artificial intelligence,AI)將大切片中不同腫瘤細胞的形態和周圍微環境的病理組織形態與各種不同類型的數據包括影像組學、基因蛋白組學、臨床診療數據等聯系起來,對腫瘤作出精準的診斷、治療和預后判斷。
一、人工智能在胰腺腫瘤蘇木精-伊紅染色圖像分析中的應用前景
病理醫師的診斷工作主要依賴于腫瘤組織的蘇木精-伊紅(hematoxylin-eosin, HE)染色圖像,其顯示的腫瘤形態學特征被廣泛應用于診斷和預后評估。胰腺惡性腫瘤中約90%為導管腺癌及其亞型,除了普通的導管腺癌(not otherwise specified, NOS),還可根據組織形態分出7個亞型:腺鱗癌、膠樣癌、印戒細胞癌、未分化癌、伴破骨樣巨細胞的未分化癌、髓樣癌、肝樣癌;而最新2019年第5版WHO消化系統腫瘤分類[12]中又增加了侵襲性微乳頭狀癌亞型;另外還有很多尚未單列出卻已被認識的亞型(圖1)。近幾年備受關注的胰腺無功能性神經內分泌腫瘤在2019年第5版WHO消化系統腫瘤分類中[12]也根據組織和細胞形態的不同在分級的基礎上提出不同形態學亞型,分為嗜酸細胞型、多形性型、透明細胞型及囊狀亞型。這些更新說明胰腺腫瘤的細胞及形態學特征越來越為大家所重視,并與臨床的診療密切相關。筆者在開展病理大切片研究的過程中發現,同一個腫瘤可同時存在超過一種組織學亞型,并且不同的區域形態學、腫瘤間質比及免疫微環境都有差異。因此借助AI,準確地識別出這些組織學亞型及所占百分比,全面評估腫瘤間質比及免疫微環境對實現精準診療具有重要意義。另一方面,除了關注腫瘤本身,腫瘤背景病理的認識也越來越受到重視。有研究發現背景病理中無胰腺上皮內瘤變的胰腺癌患者術后存活率低于有胰腺上皮內瘤變者[13]。2019年胰腺癌及神經內分泌腫瘤(NET)的NCCN指南[14-15]中也提出需要在診斷報告中標注出背景病理,說明胰腺背景病理(圖2)對判斷胰腺腫瘤生物學行為及其預后意義重大。如果能利用AI建立以上這些形態學特征的細分亞型的量化指標,對于精準判定腫瘤預后具有重要意義。同時通過AI還可以識別源自HE染色圖像中包含關于腫瘤及周圍微環境中共存的不同類型的細胞形態學(如核的區域,核的形狀)和空間背景(例如細胞密度)信息[16-18]。而且已有很多研究者的工作[19-26]已成功證明了細胞和組織形態與腫瘤臨床結果之間的聯系。但這些都是基于傳統的小切片及組織芯片所呈現的病理學圖像。腫瘤的真實世界遠超出我們從小切片或組織芯片上看到的,腫瘤的異質性非常明顯,即便是同樣分期分化的腫瘤在病理圖像上都有各自不同的特點。

圖1 胰腺導管腺癌的各種組織學亞型(1A:腸型;1B:泡沫細胞型;1C:透明細胞型;1D:橫紋肌樣特征;1E:大導管型;1F:囊狀乳頭狀型)
目前筆者團隊已實現胰腺腫瘤的大組織取材,并實現病理大切片的數字化。在此基礎上,筆者希望結合AI,通過計算病理對病理大切片所展示的圖像進行全面計算,從而實現高通量空間分析細胞類型及其在腫瘤組織樣本中的位置。圖3、4為筆者團隊制作的胰腺NET的組織大切片,對腫瘤、背景病理及周圍組織(包括脂肪、血管、正常胰腺、淋巴細胞)進行勾畫供計算機學習,目前已建立了很好的上皮間質及不同組分的分割模型。下一步筆者希望利用計算機提取腫瘤和腫瘤周邊的良性區域細胞核的特征,觀察是否比僅僅使用腫瘤信息更加有效地去預測胰腺腫瘤患者的預后;良性區域中的信息是否能提高預測腫瘤復發的準確率。同時通過計算機對病理圖像上這些形態特征進行分層并計算百分比,深度挖掘這些信息,促進對腫瘤細胞及其微環境間相互作用的理解。另外隱藏在這些形態特征背后的潛在的分子基礎,尤其是與關鍵的生物過程相關的分子基礎值得進一步深度挖掘。因此,利用AI將腫瘤及其周圍背景形態學等各種信息融合多種原始數據(如影像、臨床數據、分子數據等),可以對其精準診斷、分析其發展方向及可能的生物學行為,從而為患者制定最優的臨床決策。

圖2 胰腺的背景病理(2A:慢性胰腺炎;2B:IPMN;2C:PanIN;2D:腺泡導管化生;2E:MCN;2F:小葉中心性萎縮)

圖3 胰腺腫瘤上皮間質分割模型

圖4 胰腺腫瘤全片成像掃描多組織區域分割模型
二、人工智能在胰腺腫瘤IHC定量評估中的應用前景
AI在病理圖像定量分析中的應用,最常見的是通過對免疫組織化學(immunohistochemistry,IHC)染色圖像所反應的蛋白質表達情況進行定量評估,它可以使分析結果標準化,減少人工評估時由于視覺限制和認知陷阱引入的偏差。目前已有相應的研究,如在浸潤性乳腺癌的診斷中,病理醫師需要報告雌激素受體和孕激素受體陽性染色細胞的百分比和強度,指導對乳腺癌患者的內分泌治療[27-28],這一過程可以通過對IHC圖像的定量分析得到精確結果,并且在實踐中已被證明優于病理醫師的評估[29-31]。在胰腺NET的診療中,評估腫瘤組織Ki-67熱點區的增殖活性是診療關鍵所在,直接決定腫瘤的分級與治療[12]。但由于NET的異質性較大,不同區域腫瘤的Ki-67增殖指數可以相差很大,而傳統小切片取材因取材局限可能會低估這一值,從而延誤治療。筆者所在團隊通過對胰腺NET病理大切片中Ki-67 IHC圖像重新評估,發現與傳統小切片相比,約10%的患者被低估(結果未發表)。因此在前期工作基礎上,筆者希望借助于AI更精準地對Ki-67的熱點區進行定量評估,進一步明確病理大切片在NET的診斷中的重要性和必要性。另一方面也希望通過計算病理找出提示Ki-67高增殖活性的組織學特征及提示腫瘤生物學行為的新的診斷指標,這樣既解決了精準定量評估的問題,也解決了大切片IHC因抗體消耗量大帶來的患者經濟負擔重而難以在臨床推廣的問題,同時還可以在已有的診斷標準下提出新的診斷指標,更好地去實現個體化診療。
另外隨著腫瘤免疫治療越來越受關注,對相應腫瘤的免疫評分及腫瘤PD-L1伴隨診斷的評判標準也越來越受關注。那么胰腺各類腫瘤的免疫微環境狀態究竟如何?如何對各類腫瘤進行科學的免疫評分?這對于病理科醫師來說也是亟待解決的問題。目前已有研究利用AI定量檢測發現CD8+淋巴細胞的數量和位置對于評估PD-L1陽性和PD-L1陰性的非小細胞肺癌的免疫應答是至關重要的[32]。同時該研究發現胰腺癌標本中腫瘤侵襲性邊緣與腫瘤中心浸潤的CD8+淋巴細胞的密度顯著升高。因此筆者希望后續在本單位開展胰腺腫瘤大切片的基礎上,通過對腫瘤PD-L1、PD-1及各類免疫相關細胞的IHC染色,利用AI對各類細胞進行定量及空間分布的計算,建立對各類胰腺腫瘤進行免疫評分及評估免疫治療療效的模型,從而更好地實現個體化診療。
三、胰腺腫瘤病理組學特征與多組學信息的關聯
目前胰腺腫瘤的診療中依然存在很多瓶頸,如早期胰腺癌和小胰癌的診斷、胰腺炎和胰腺癌術前的準確評判、胰腺癌胰周淋巴結和神經浸潤的術前評估、胰腺癌對新輔助治療的反應評估等。筆者希望在AI的幫助下,將胰腺腫瘤的病理形態學信息與基因分子信息、解剖和功能影像信息相互對比融合,從而發現人眼不易察覺的細節和主觀經驗難以總結的規律,以此推動多組學交叉研究的產生,充分發揮各自的優勢和綜合效應。病理組學作為疾病診斷的金標準,可清晰描述腫瘤的形態及微環境狀態;影像組學的無創性使它應用更加廣泛;基因組學可用于腫瘤的分子分型等。這樣的交叉研究不僅能提高疾病診斷的準確性,還能充分利用現有醫療資源,節省研究成本,推動醫學不斷發展。此時病理大切片的優勢就會更加凸顯,因為大切片可以將腫瘤不同形態學及微環境特征與解剖及分子影像信息更好地匹配,有助于在影像上預測腫瘤的生物學行為及對治療的反應。病理科醫師更趨向于充當腫瘤的“心理醫生”,通過各種信息的融合對其進行精準診斷,分析其發展方向及可能的生物學行為,并以此為依據提供個體化及精準化治療(圖5)。
四、結語與展望
AI時代的病理組學不再是傳統意義上的僅局限于病理切片的定量分析,基于AI的病理組學包含多種病理分析任務,如提取細胞形態學特征、背景病理、不同成分的定量、IHC指標量化等,并與腫瘤預后有機地結合在一起,實現腫瘤診療、預后以及病理報告的一體化。病理大切片在胰腺腫瘤病理診斷中優勢明顯,能夠整體而全面地將病變組織呈現。病理大切片技術聯合數字病理圖像分析可以幫助解決精準醫學中的一系列問題,特別是預后及預測患者對治療方案的反應等。因此,未來結合大切片基礎上的病理組學、影像組學及分子結構特征并融合臨床診療數據去構建預測模型將會有很大潛力。
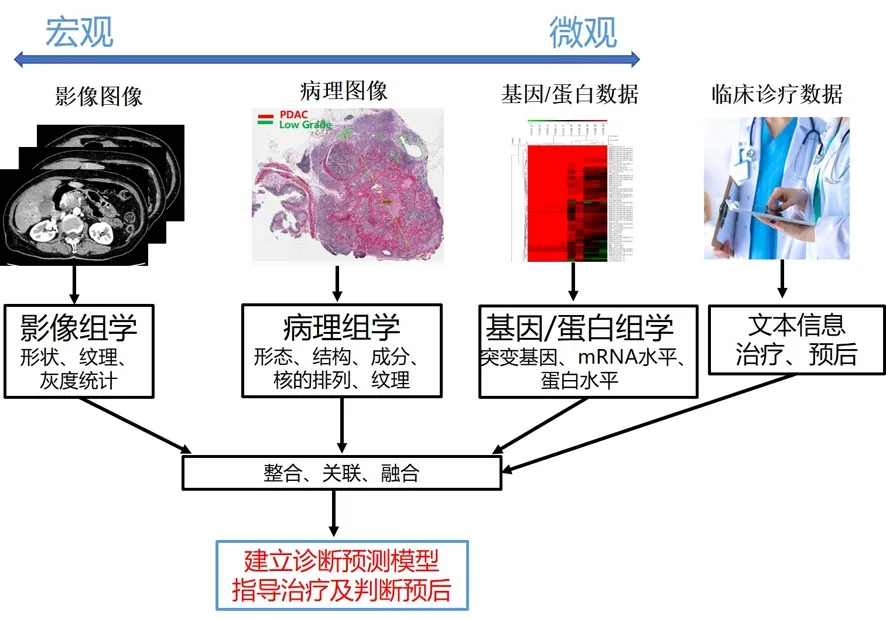
圖5 整合多組學構建預測模型
利益沖突所有作者均聲明不存在利益沖突

