抗菌肽Jelleine-I對(duì)采后柑橘果實(shí)綠霉病的控制作用
李心丹,王文軍,鄧麗莉,2,姚世響,2,曾凱芳,2,*
(1.西南大學(xué)食品科學(xué)學(xué)院,重慶 400715;2.西南大學(xué)食品貯藏與物流研究中心,重慶 400715)
柑橘屬蕓香科(Rutaceae)柑橘亞科(Aurantioideac)柑橘屬(Citrus)柑橘亞族(Citrinae)果樹,主要集中分布在中國、美國等地區(qū)[1]。因柑橘果實(shí)柔嫩多汁,富含豐富的糖類、酸類、VC以及礦質(zhì)元素和多種苷類物質(zhì),營養(yǎng)價(jià)值高,而深受消費(fèi)者喜愛[2-3]。我國柑橘以鮮銷為主,在旺季時(shí)需大量貯藏,而采摘后的柑橘果實(shí)在貯藏過程中易受病原菌侵染而發(fā)生大量腐爛現(xiàn)象,造成巨大的經(jīng)濟(jì)損失[4]。其中由指狀青霉(Penicillium digitatum)引起的綠霉病是柑橘貯藏期主要病害之一[5]。在現(xiàn)有柑橘類果實(shí)侵染性病害防治方法中,化學(xué)殺菌劑的使用是最普遍也是最有效的,如苯并咪唑類殺菌劑的代表品種多菌靈以及咪唑類殺菌劑的代表品種咪鮮胺[6]。但化學(xué)殺菌劑的長期使用使環(huán)境及人體健康受到了潛在的威脅,且使病原微生物對(duì)其產(chǎn)生抗性,因而化學(xué)殺菌劑的使用逐漸受到限制[7]。研究者們開始致力于尋找對(duì)人體健康無害的方式和物質(zhì)來代替或減少化學(xué)殺菌劑的大劑量使用。
抗菌肽是由基因編碼、核糖體合成的能夠抵御外界病原菌的多肽,廣泛存在于各種生物體內(nèi),具有廣譜抑菌性[8-9]。抗菌肽可通過與病原微生物的細(xì)胞膜、細(xì)胞壁或胞內(nèi)靶點(diǎn)物質(zhì)作用加速病原菌死亡[10-11]。抗菌肽作用機(jī)制的特殊性使病原菌不易對(duì)其產(chǎn)生抗性。近年來,抗菌肽的高效抑菌性使其在醫(yī)藥業(yè)、農(nóng)業(yè)、食品工業(yè)及畜牧業(yè)受到越來越多的關(guān)注[12-13]。在果蔬采后病害控制方面,研究者通過直接提取、化學(xué)合成以及利用微生物表達(dá)等方式獲取抗菌肽,利用抗菌肽對(duì)病原菌的抑制作用控制果蔬采后病害的發(fā)生[14-19]。其中,陽離子短鏈抗菌肽由于較低的合成成本及優(yōu)良的抗菌性能備受研究者關(guān)注。抗菌肽Jelleine-I(PFKLSLHL-NH2)是一種從蜜蜂(Apis mellifera)的蜂王漿中分離得到的陽離子短鏈抗菌肽,對(duì)細(xì)菌和酵母具有獨(dú)特的抑菌活性[20-22]。但有關(guān)抗菌肽Jelleine-I控制果蔬采后病害的研究報(bào)道尚少,也鮮見將抗菌肽Jelleine-I應(yīng)用于柑橘果實(shí)采后病害控制的相關(guān)研究報(bào)道。本研究旨在探究抗菌肽Jelleine-I對(duì)引起柑橘果實(shí)綠霉病的病原菌P. digitatum生長的影響及可能的作用機(jī)理,并評(píng)價(jià)抗菌肽Jelleine-I對(duì)柑橘果實(shí)采后綠霉病的控制效果,從而拓寬抗菌肽Jelleine-I的應(yīng)用范圍,為控制柑橘果實(shí)采后病害提供新的思路和方法。
1 材料與方法
1.1 材料與試劑
使用固相合成方法于南京金斯瑞公司合成純度大于90%的抗菌肽Jelleine-I,貯藏于-40 ℃冰箱中,使用前先用無菌水配成1 mmol/L的母液,然后稀釋至所需濃度。
指狀青霉(P. digitatum)分離于發(fā)病豐臍果實(shí),并通過分子生物學(xué)方法鑒定。用馬鈴薯葡萄糖瓊脂培養(yǎng)基(potato dextrose agar,PDA)于25 ℃培養(yǎng)病原菌,7 d后收集孢子并用無菌水調(diào)至所需濃度[23]。
實(shí)驗(yàn)所用柑橘品種為豐臍(Citrus Sinensic (L.)Osbeck),11月下旬采摘于重慶市北碚區(qū)馮家槽果園。果實(shí)(可溶性固形物質(zhì)量分?jǐn)?shù)為10.1%,可滴定酸質(zhì)量分?jǐn)?shù)為0.96%)采收后立即運(yùn)回實(shí)驗(yàn)室,挑選成熟度一致、大小均一、無機(jī)械傷、無病蟲害的健康果實(shí)作為實(shí)驗(yàn)材料。
SYTOX Green(SG)熒光染色試劑 美國Invitrogen公司;Calcofluor White(CFW)熒光染色試劑美國Sigma Aldrich公司。
1.2 儀器與設(shè)備
BXM30R立式高壓滅菌鍋 上海博迅實(shí)業(yè)有限公司醫(yī)療設(shè)備廠;SW-CJ-1F超凈工作臺(tái) 蘇凈集團(tuán)安泰有限公司;DHP-9082電熱恒溫培養(yǎng)箱 上海齊欣科學(xué)儀器有限公司;B203生物顯微鏡 重慶奧特光學(xué)儀器有限公司;SYNERGYH1MG全自動(dòng)酶標(biāo)儀 美國BioTek公司;TS100熒光顯微鏡 北京長恒榮創(chuàng)科技有限公司;AvantiTMJ-30I高速冷凍離心機(jī) 美國Beckman公司;DDS-307A電導(dǎo)率儀 上海儀電科學(xué)儀器股份有限公司。
1.3 方法
1.3.1 抗菌肽Jelleine-I對(duì)P. digitatum的離體抑菌作用
實(shí)驗(yàn)參照J(rèn)ia Fengjing等[21]的方法并進(jìn)行一定的修改。用無菌的96 孔微量板進(jìn)行實(shí)驗(yàn),將180 μL 1×104CFU/mL P. digitatum孢子懸浮液(含體積分?jǐn)?shù)5%馬鈴薯葡萄糖液體培養(yǎng)基(potato dextrose broth,PDB))、20 μL抗菌肽Jelleine-I,混合后立即加入96 孔板中,抗菌肽Jelleine-I的終濃度分別為3.12、6.25、12.5、25、50、100 μmol/L。設(shè)無菌水為對(duì)照,置于25 ℃恒溫培養(yǎng)箱中培養(yǎng),48 h時(shí)用酶標(biāo)儀測定其OD600nm。以48 h時(shí)依舊能完全抑制病原菌生長的最低濃度作為最低抑菌濃度(minimum inhibitory concentration,MIC)。并從未見菌絲生長的孔中吸取50 μL液體涂布在PDA培養(yǎng)基上,于25 ℃繼續(xù)培養(yǎng)48 h,以無任何菌落形成的最低濃度為最低殺菌濃度(minimum fungicidal concentration,MFC)。
1.3.2 同孔損傷接種抗菌肽Jelleine-I對(duì)柑橘果實(shí)綠霉病的控制效果
實(shí)驗(yàn)參照Zhou Yahan等[24]的方法并進(jìn)行一定的修改。柑橘果實(shí)隨機(jī)分組,每組15 個(gè)果實(shí),以體積分?jǐn)?shù)2%的次氯酸鈉溶液浸泡2 min后用自來水清洗以除去表面殘留污物,果實(shí)表面赤道部位用體積分?jǐn)?shù)75%乙醇溶液擦拭消毒后,用滅菌打孔器在果實(shí)赤道部位等距打2 個(gè)孔(深3 mm、直徑4 mm)。每孔接種10 μL新鮮孢子懸浮液(1×104CFU/mL),4 h后,每孔接種10 μL抗菌肽溶液(12.5、100 μmol/L)或無菌水(對(duì)照組)。待液體完全吸收后,用聚乙烯薄膜袋(170 mm×140 mm)將果實(shí)單果包裝,置于25 ℃、相對(duì)濕度90%~95%的環(huán)境中貯藏,每天統(tǒng)計(jì)發(fā)病率并測量病斑直徑。
1.3.3 抗菌肽Jelleine-I對(duì)P. digitatum菌絲體細(xì)胞膜透性影響的測定
實(shí)驗(yàn)參考Puig等[25]的方法并進(jìn)行一定的調(diào)整。用體積分?jǐn)?shù)5% PDB配制1×104CFU/mL的病原菌孢子懸浮液,取90 μL加入到無菌的1.5 mL離心管中,25 ℃下培養(yǎng)24 h。然后,加入10 μL抗菌肽溶液,使抗菌肽Jelleine-I終濃度達(dá)到0、6.25、12.5、100 μmol/L,無菌水為對(duì)照,繼續(xù)培養(yǎng)2 h。培養(yǎng)完成后,加入4 μmol/L的SG貯備溶液,使其終濃度達(dá)到0.2 μmol/L,樣品在暗環(huán)境下培養(yǎng)5 min;然后加入1 g/L CFW,使其終質(zhì)量濃度達(dá)到50 μg/mL,樣品繼續(xù)在暗環(huán)境下培養(yǎng)5 min。最后,用純水洗凈菌絲,重懸于體積分?jǐn)?shù)20%甘油溶液,制片并在熒光顯微鏡下觀察。SG的熒光檢測(激發(fā)波長設(shè)置為450~490 nm,發(fā)射波長為515~565 nm)選擇FITC濾光片。CFW的熒光檢測(激發(fā)波長為395 nm,發(fā)射波長為440 nm)選擇DAPI濾光片。
1.3.4 抗菌肽Jelleine-I對(duì)P. digitatum胞外電導(dǎo)率影響的測定
采用微型電導(dǎo)儀測定抗菌肽Jelleine-I對(duì)指狀青霉胞外電導(dǎo)率的影響。實(shí)驗(yàn)參考Zhou Haien等[26]的方法并進(jìn)行一定的修改。100 μL含有1×105CFU/mL病原菌孢子加入到20 mL PDB培養(yǎng)基中,25 ℃、160 r/min振蕩培養(yǎng)48 h。4 000×g離心15 min,水洗3 次,收集菌絲體,重新懸浮于無菌水中。然后加入抗菌肽Jelleine-I溶液,使其終濃度分別為0、6.25、12.5、100 μmol/L。在處理0、0.5、1、2、3、6 h和9 h時(shí)測定胞外電導(dǎo)率,無菌水為對(duì)照。
1.3.5 抗菌肽Jelleine-I對(duì)P. digitatum菌絲體細(xì)胞成分釋放的影響
采用全波長酶標(biāo)儀測定抗菌肽Jelleine-I對(duì)指狀青霉菌絲體胞內(nèi)核酸物質(zhì)釋放的影響。實(shí)驗(yàn)參照Paul等[27]的方法并進(jìn)行一定的修改。100 μL含有1×105CFU/mL病原菌孢子加入到20 mL PDB培養(yǎng)基中,25 ℃、160 r/min振蕩培養(yǎng)48 h。然后4 000×g離心15 min,用磷酸鹽緩沖液(phosphate buffered saline,PBS)(pH 7.0)清洗3 次,收集菌絲體,重新懸浮于PBS(pH 7.0)中。然后加入抗菌肽Jelleine-I溶液,使其終濃度分別為0、6.25、12.5、100 μmol/L。在處理0、0.5、1、2、3、6、9 h時(shí)離心取上清液測定260 nm波長處的OD值,無菌水為對(duì)照。
1.3.6 抗菌肽Jelleine-I溶血性測試
實(shí)驗(yàn)參照Mu?oz等[28]的方法并進(jìn)行一定的修改。將從醫(yī)院獲得的健康成人新鮮血液放入含有肝素鈉的離心管中混勻,1 000×g離心5 min,棄上清液,用0.1 mol/L PBS沖洗3 次,然后重懸于4 倍體積的PBS中即得到紅細(xì)胞懸浮液。取10 μL濃度分別為12.5、25、50、100 μmol/L的抗菌肽Jelleine-I溶液與90 μL紅細(xì)胞懸浮液混合后于37 ℃培養(yǎng)1 h,以0.1 mol/L PBS為陰性對(duì)照,體積分?jǐn)?shù)0.1% Triton X-100為陽性對(duì)照,然后1 000×g離心5 min。轉(zhuǎn)移上清液至無菌的96 孔微量板,用酶標(biāo)儀測定OD540nm。按照下式計(jì)算溶血率。

式中:OD樣、OD陰、OD陽分別表示樣品、陰性對(duì)照、陽性對(duì)照組的OD540nm。
1.4 數(shù)據(jù)統(tǒng)計(jì)與分析
所有實(shí)驗(yàn)重復(fù)3 次。所有數(shù)據(jù)用Excel 2013軟件處理,運(yùn)用Graph Pad Prism 5軟件對(duì)實(shí)驗(yàn)數(shù)據(jù)進(jìn)行分析并作圖;用SPSS 21.0軟件對(duì)數(shù)據(jù)進(jìn)行方差分析,利用Duncan’s多重比較對(duì)差異顯著性進(jìn)行分析,P<0.05表示差異顯著。
2 結(jié)果與分析
2.1 抗菌肽Jelleine-I對(duì)P. digitatum的離體抑菌作用
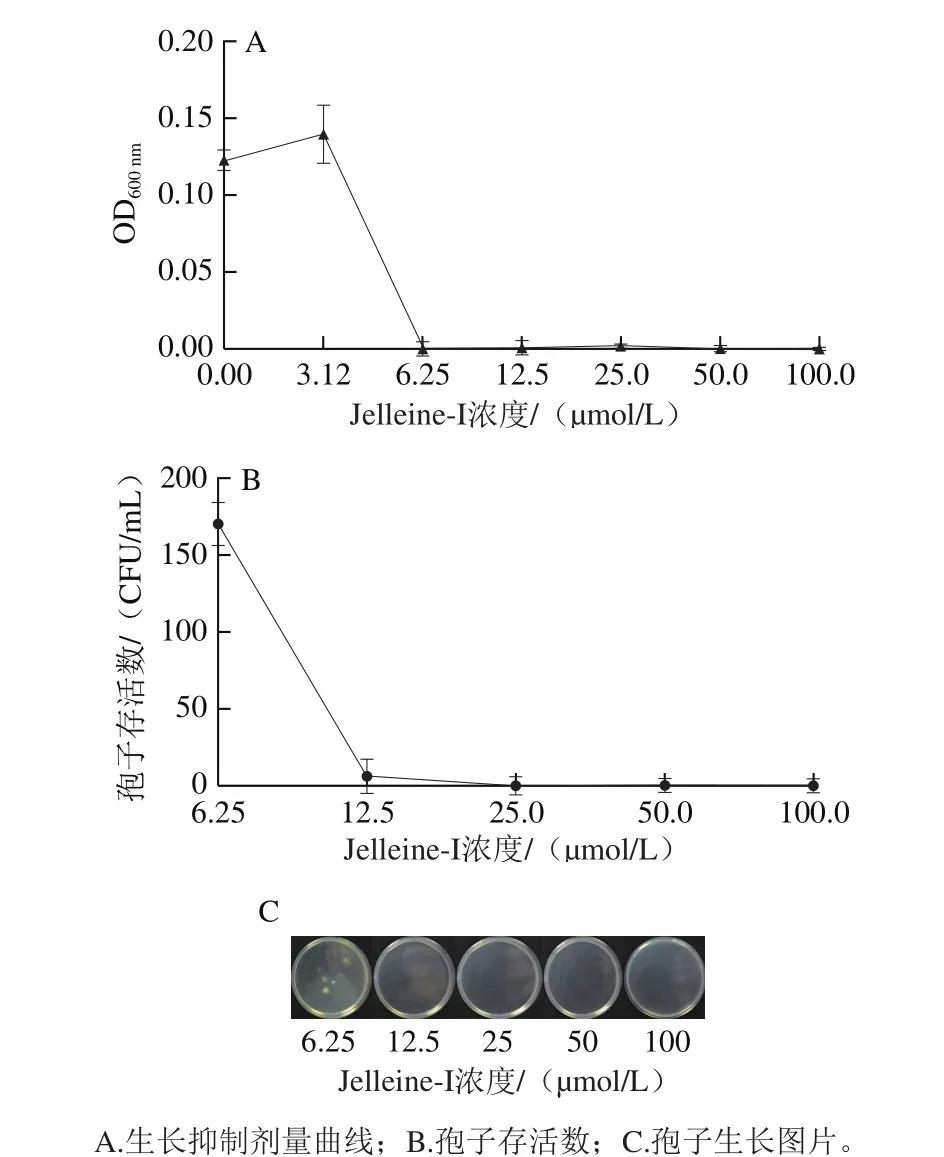
圖1 抗菌肽Jelleine-I對(duì)P. digitatum的離體抑菌作用Fig. 1 Antifungal activity of peptide Jelleine-I against P. digitatum in vitro
由圖1A可知,當(dāng)抗菌肽Jelleine-I濃度高于3.12 μmol/L時(shí),能抑制P. digitatum的生長,且濃度越高抑制作用越強(qiáng)。當(dāng)抗菌肽Jelleine-I濃度為6.25 μmol/L時(shí),P. digitatum的生長受到完全抑制,因此,抗菌肽Jelleine-I的MIC為6.25 μmol/L。由圖1B、C可知,抗菌肽Jelleine-I濃度越大,對(duì)P. digitatum孢子的致死作用越顯著,當(dāng)抗菌肽Jelleine-I濃度達(dá)到12.5 μmol/L時(shí),P. digitatum孢子幾乎不會(huì)存活,因此,抗菌肽Jelleine-I的MFC為12.5 μmol/L。
2.2 抗菌肽Jelleine-I對(duì)柑橘果實(shí)綠霉病的控制效果
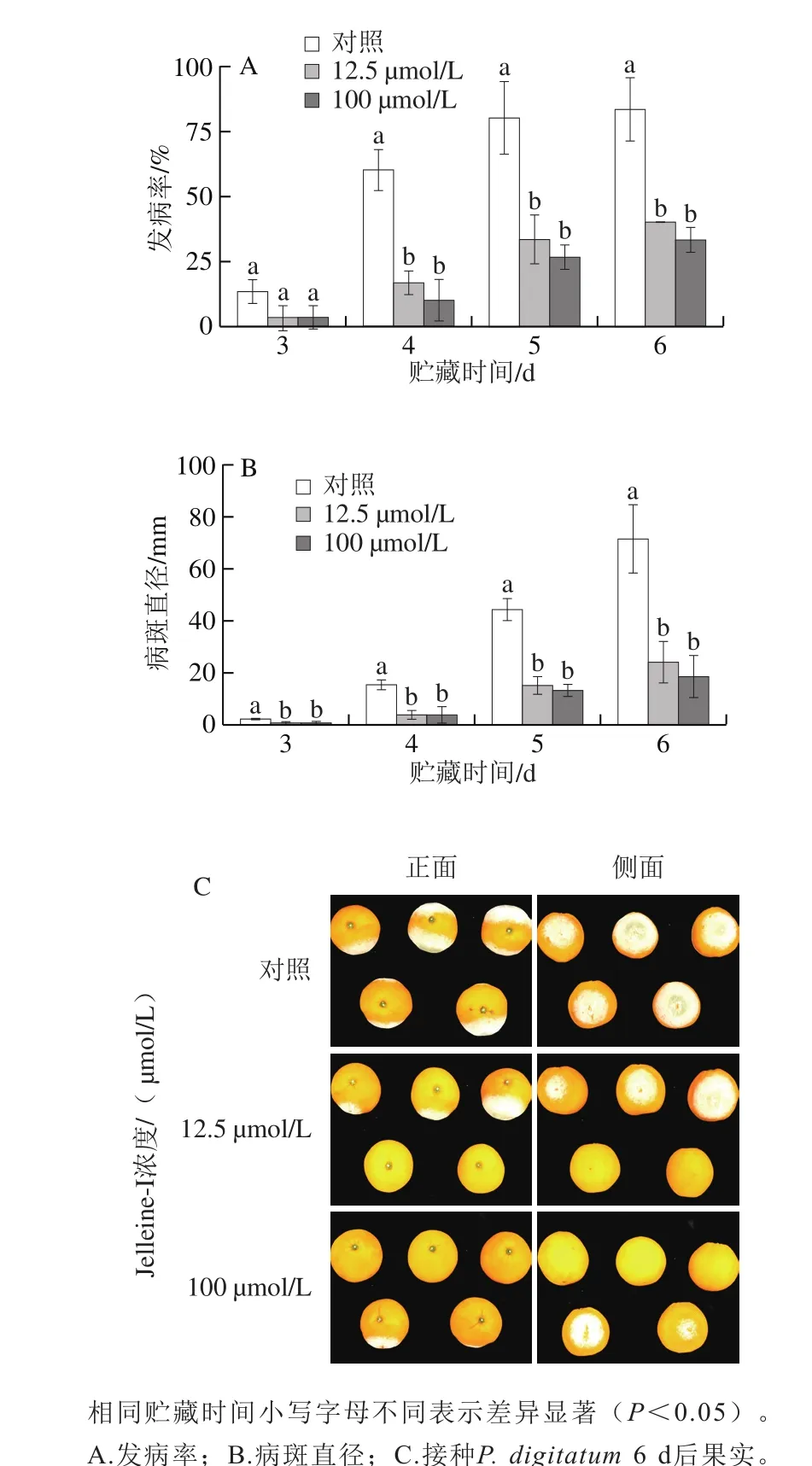
圖2 抗菌肽Jelleine-I對(duì)柑橘采后綠霉病發(fā)病率和病斑直徑的影響Fig. 2 Effect ofJelleine-I on green mold incidence and lesion diameter of citrus fruit
如圖2所示,經(jīng)同孔損傷接種P. digitatum的柑橘果實(shí),在接種后的4~6 d內(nèi),抗菌肽Jelleine-I處理組的發(fā)病率顯著低于對(duì)照組(P<0.05)。且在接種后的3~6 d內(nèi),抗菌肽Jelleine-I處理組的病斑直徑也顯著低于對(duì)照組(P<0.05)。兩個(gè)不同濃度(100、12.5 μmol/L)的抗菌肽Jelleine-I處理組之間在接種后3~6 d內(nèi)發(fā)病率和病斑直徑均無顯著性差異(P>0.05)。
2.3 抗菌肽Jelleine-I對(duì)P. digitatum菌絲體細(xì)胞膜的影響

圖3 抗菌肽Jelleine-I對(duì)P. digitatum菌絲體細(xì)胞膜的影響Fig. 3 Effect of Jelleine-I on membrane permeability of P. digitatum
如圖3所示,實(shí)驗(yàn)利用熒光顯微鏡觀察抗菌肽Jelleine-I處理對(duì)P. digitatum的菌絲細(xì)胞膜通透性的影響。當(dāng)細(xì)胞膜破壞后,SG熒光染色劑可以進(jìn)入細(xì)胞內(nèi)與核酸物質(zhì)結(jié)合,并且呈現(xiàn)出大于未結(jié)合核酸物質(zhì)時(shí)500 倍強(qiáng)度的綠色熒光。但當(dāng)細(xì)胞膜通透性正常時(shí),其不會(huì)進(jìn)入細(xì)胞內(nèi)。CFW染色劑可與真菌細(xì)胞壁成分幾丁質(zhì)、纖維素特異性結(jié)合,故由于細(xì)胞壁結(jié)構(gòu)變化導(dǎo)致的幾丁質(zhì)異常積累可被觀察到。實(shí)驗(yàn)結(jié)果表明,對(duì)照組P. digitatum的菌絲經(jīng)SG和CFW染色后,不會(huì)出現(xiàn)明顯的綠色SG熒光,且藍(lán)色CFW熒光在細(xì)胞間明顯較強(qiáng),表明幾丁質(zhì)在細(xì)胞間積累正常。但是隨著抗菌肽Jelleine-I處理濃度的增大,綠色SG熒光強(qiáng)度變得越來越強(qiáng)。經(jīng)過6.25、12.5 μmol/L的抗菌肽Jelleine-I處理后,菌絲上出現(xiàn)較少量不連續(xù)的綠色SG熒光,藍(lán)色CFW熒光貫穿整個(gè)菌絲,但在細(xì)胞間的藍(lán)色CFW熒光減少。當(dāng)抗菌肽Jelleine-I濃度為100 μmol/L時(shí),菌絲上出現(xiàn)大面積連續(xù)的綠色SG熒光,以及貫穿整個(gè)菌絲的藍(lán)色CFW熒光,但未出現(xiàn)細(xì)胞間的藍(lán)色CFW熒光。
2.4 抗菌肽Jelleine-I對(duì)P. digitatum菌絲體胞外電導(dǎo)率的影響
如圖4所示,隨著處理時(shí)間的延長,對(duì)照組和3 個(gè)不同濃度抗菌肽Jelleine-I處理組的P. digitatum菌絲體胞外電導(dǎo)率都逐漸增大。3 個(gè)不同濃度抗菌肽Jelleine-I處理組的胞外電導(dǎo)率值均顯著高于對(duì)照組(P<0.05)。且在處理時(shí)間內(nèi),100 μmol/L的電導(dǎo)率顯著高于6.25 μmol/L處理組和12.5 μmol/L處理組(P<0.05),但6.25 μmol/L處理組和12.5 μmol/L處理組之間沒有顯著性差異(P>0.05)。在處理9 h后,各組胞外電導(dǎo)率達(dá)到最大,對(duì)照組和6.25、12.5、100 μmol/L 抗菌肽Jelleine-I處理組胞外電導(dǎo)率分別為94.8、174.25、158.3、329.67 μS/cm。

圖4 抗菌肽Jelleine-I對(duì)P. digitatum菌絲體胞外電導(dǎo)率的影響Fig. 4 Effect of Jelleine-I treatment on extracellular conductivity of P. digitatum
2.5 抗菌肽Jelleine-I對(duì)P. digitatum菌絲體細(xì)胞成分釋放的影響
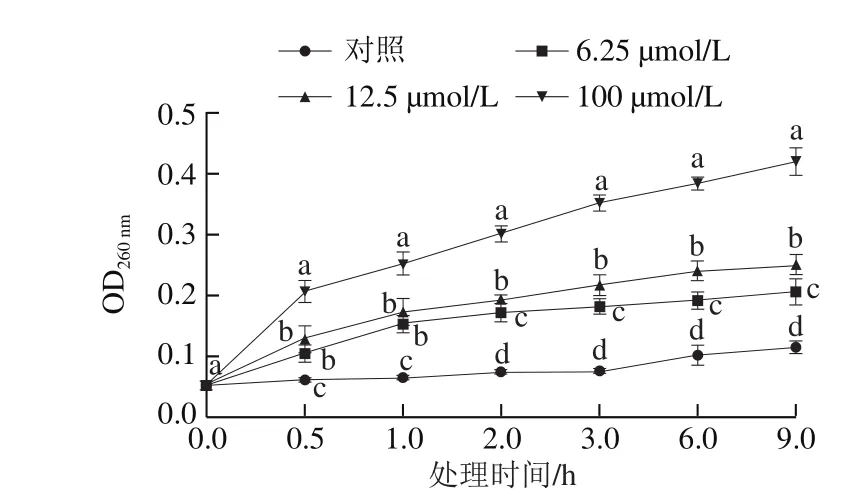
圖5 抗菌肽Jelleine-I對(duì)P. digitatum菌絲體細(xì)胞成分釋放的影響Fig. 5 Effect of Jelleine-I treatment on release of intracellular constituents from P. digitatum
P. digitatum菌絲體細(xì)胞外OD260nm能表征細(xì)胞內(nèi)核酸物質(zhì)的泄漏程度。如圖5所示,隨著處理時(shí)間的延長,抗菌肽Jelleine-I處理組的P. digitatum菌絲體胞外OD260nm明顯增加,且顯著高于相同處理時(shí)間的對(duì)照組(P<0.05)。處理0.5 h時(shí),100 μmol/L抗菌肽 Jelleine-I處理組的OD260nm為0.21,顯著高于12.5 μmol/L處理組(0.13)和6.25 μmol/L處理組(0.11)(P<0.05)。在處理前2 h內(nèi),6.25 μmol/L處理組和12.5 μmol/L處理組之間無顯著性差異(P>0.05),在2~9 h內(nèi),兩處理組間出現(xiàn)顯著性差異(P<0.05)。
2.6 抗菌肽Jelleine-I溶血性檢測結(jié)果
本實(shí)驗(yàn)中,以0.1 mol/L PBS作為陰性對(duì)照,其不會(huì)導(dǎo)致溶血現(xiàn)象;以0.1% Triton X-100作為陽性對(duì)照,其有極強(qiáng)的溶血性。如圖6所示,各實(shí)驗(yàn)濃度抗菌肽Jelleine-I組的溶血率顯著低于0.1% Triton X-100(P<0.05),各濃度抗菌肽Jelleine-I組之間無顯著性差異(P>0.05)。當(dāng)抗菌肽Jelleine-I濃度為12.5、25、50 μmol/L和100 μmol/L時(shí),溶血率分別為0.33%、1.33%、3.34%和2.34%。
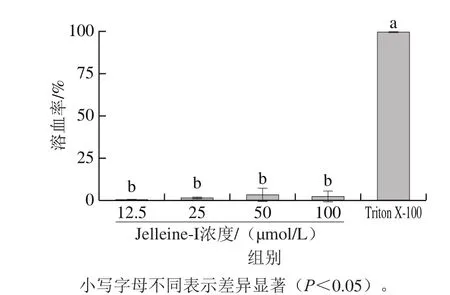
圖6 抗菌肽Jelleine-I的溶血性Fig. 6 Hemolytic activity of peptide Jelleine-I
3 討 論
前人研究認(rèn)為,Jelleine-I對(duì)白色念珠菌(Candida albicans)、金黃色葡萄球菌(Staphylococcus aureus)、枯草芽孢桿菌(Bacillus subtilis)和銅綠假單胞菌(Pseudomonas aeruginosa)等微生物生長有抑菌作用[21-22]。本實(shí)驗(yàn)研究了在離體條件下抗菌肽Jelleine-I對(duì)P. digitatum生長的抑制情況,結(jié)果發(fā)現(xiàn),抗菌肽Jelleine-I能顯著抑制P. digitatum菌絲的生長,且對(duì)P. digitatum孢子有致死作用,其MIC和MFC分別為6.25、12.5 μmol/L。P. digitatum孢子易通過環(huán)境傳播,侵染柑橘果實(shí),導(dǎo)致其發(fā)病[29]。在體內(nèi)條件下,研究了濃度為12.5、100 μmol/L的抗菌肽Jelleine-I對(duì)P. digitatum接種柑橘果實(shí)采后綠霉病發(fā)生的控制效果,結(jié)果發(fā)現(xiàn)Jelleine-I能有效控制柑橘果實(shí)采后綠霉病的發(fā)生,這與其在離體條件下兩個(gè)濃度均能夠?qū)㈡咦油耆珰⑺来嬖谝恢滦浴5?2.5、100 μmol/L 抗菌肽Jelleine-I組之間差異不顯著。
前人研究表明,抗菌肽作用于病原菌細(xì)胞時(shí),先于細(xì)胞表面聚集,進(jìn)而破壞細(xì)胞膜、壁,或者直接進(jìn)入細(xì)胞內(nèi)與胞內(nèi)靶點(diǎn)物質(zhì)相互作用,從而影響病原菌細(xì)胞正常生長繁殖,最終殺死病原菌[12,30-32]。本實(shí)驗(yàn)通過熒光顯微鏡觀察,發(fā)現(xiàn)抗菌肽Jelleine-I能增加P. digitatum菌絲體細(xì)胞膜通透性,同時(shí)破壞P. digitatum細(xì)胞間隔膜,使SG進(jìn)入P. digitatum細(xì)胞內(nèi),發(fā)出強(qiáng)烈綠色熒光,影響CFW染料在細(xì)胞間的積累,減少細(xì)胞間的藍(lán)色CFW熒光,此結(jié)果與大多數(shù)抗菌肽作用相似,如PAF56[23]、BP21[33]、Thanatin、Ponericin W1、Mastoparan-S[34]。細(xì)胞膜在維持細(xì)胞正常生命活動(dòng)方面起著重要的作用[35],當(dāng)細(xì)胞膜損壞時(shí)可能會(huì)增加細(xì)胞膜通透性,引起細(xì)胞內(nèi)一些離子和小分子物質(zhì)泄漏[26,36-38],最終抑制微生物的生長。為評(píng)定細(xì)胞膜及細(xì)胞質(zhì)的不可逆損傷,本實(shí)驗(yàn)測定了Jelleine-I處理后P. digitatum菌絲體的胞外電導(dǎo)率和胞內(nèi)核酸物質(zhì)泄漏量。結(jié)果發(fā)現(xiàn),經(jīng)過Jelleine-I處理的P. digitatum菌絲體的胞外電導(dǎo)率和胞內(nèi)核酸物質(zhì)泄漏量顯著增加,且100 μmol/L Jelleine-I的影響更加顯著。這也再次證明抗菌肽Jelleine-I能改變柑橘果實(shí)綠霉病病原菌P. digitatum菌絲體細(xì)胞膜的通透性,引起細(xì)胞的不可逆損傷。抗菌肽對(duì)正常哺乳動(dòng)物紅細(xì)胞的溶解性是阻礙抗菌肽應(yīng)用的主要障礙之一,但抗菌肽Jelleine-I具有特異性細(xì)胞溶解活性,對(duì)人血紅細(xì)胞幾乎不存在溶解性,具有潛在的應(yīng)用價(jià)值。這與Fontana等[20]的研究結(jié)果一致。
4 結(jié) 論
抗菌肽Jelleine-I能通過增加P. digitatum細(xì)胞膜通透性,引起胞內(nèi)物質(zhì)泄漏,從而表現(xiàn)出對(duì)P. digitatum生長的抑制作用和致死作用;此外,抗菌肽Jelleine-I能有效控制柑橘果實(shí)綠霉病的發(fā)生。進(jìn)一步研究發(fā)現(xiàn),抗菌肽Jelleine-I對(duì)人血紅細(xì)胞有一定的特異性選擇作用。因此認(rèn)為,抗菌肽Jelleine-I在控制柑橘果實(shí)采后綠霉病病害方面具有極大的開發(fā)應(yīng)用價(jià)值。

