噴射參數對微滴噴射細胞效果的影響*
喻梓瑄,張宵敏,周新麗
(上海理工大學醫療器械與食品學院,上海 200093)
1 引 言
目前,玻璃化法的應用范圍主要是卵母細胞和胚胎的保存,保存過程利用多種形式的冷凍載體,如電鏡銅網法(EMG)[1],開放式拉伸麥管法(OPS)[2],半麥管法(Hemi-straw)[3],Cryotop 法[3],石英毛細管法(QMC)[4],冷凍環法(Cryoloop)[3]等。有載體的微滴玻璃化,每次僅可對少量的細胞進行玻璃化保存,且保護劑的加載去除過程操作復雜。微滴噴射玻璃化保存,是把含有細胞的懸液用噴嘴裝置吹打成無序狀態且十分微小的液滴后,直接噴入液氮中進行后續的玻璃化保存。此方法降溫速率高達105℃/min,約為普通麥管降溫速率的40倍,可有效實現玻璃化。Demirci等[5-8]曾提出利用聲學驅動微機械噴射裝置產生微滴,該裝置產生的微滴尺寸極小,但細胞懸浮液濃度過大時,噴嘴極易堵塞。隨后,Demirci等[9]又提出一種開放式無噴嘴噴射系統,然而該裝置不利于懸浮液的穩定噴射。直到Samot等[10]提出一種多噴嘴共流微滴噴射玻璃化保存系統,噴射時氮氣流與細胞懸浮液形成共流,氮氣流將細胞懸浮液離散成微滴并直接噴射至聚乙烯薄片上,薄片用鑷子夾取后放入液氮中進行玻璃化。
微滴玻璃化程度與液滴大小密切相關。Song等[11]通過實驗證實,在超快速冷凍時,當微滴體積小于0.1 μL時,很容易實現玻璃化。Assal等[12]利用Samot等[10]提出的納升級噴射微滴玻璃化保存系統應用于研究紅細胞的玻璃化保存,并探究氮氣流速、懸浮液注射速度、載體薄膜接收位置三個參數對微滴大小的影響。該研究將噴射、凍結、復溫過程的損傷合在一起考慮,并不能看出噴射過程對細胞的損傷程度。除以上三個影響因素外,噴嘴針頭型號和懸浮液濃度也可能對微滴大小和細胞玻璃化效果有較大影響,但未見相關報道。
本研究對氮氣流速、懸浮液注射速度、懸浮液濃度、微滴接收位置和針頭型號等噴射參數設計了單因素試驗,研究噴射參數對微滴大小的影響;同時,通過統計微滴噴射后HepG2細胞的存活率,分析噴射參數對細胞活性的影響;最后,探究了不同噴射參數下微滴尺寸與細胞活性間的關系,以細胞活性作為評價標準,選擇出最佳的噴射參數。
2 材料與方法
2.1 材料與設備
HepG2細胞,上海賽百慷生物技術股份有限公司;胎牛血清FBS,法國BIOSERA公司;DMEM細胞培養基,美國HYCLONE公司;胰酶,美國Sigma公司;D-hanks液,上海勵瑞生物科技有限公司;臺盼藍染色液(2X),上海勵瑞生物科技有限公司;二甲亞砜(Me2SO),德國APPLICHEM公司。
二氧化碳培養箱,MCO-18AC,松下醫療器械有限公司;液氮罐,YDS-50B-125,成都金鳳有限公司;超低溫冰箱,DW-8GL388A,青島海爾特種電器有限公司;光學顯微鏡,CFI60,尼康。
2.2 微滴噴射裝置介紹
微滴噴射裝置見圖1,主要由氮氣流輸送裝置、細胞懸浮液注射裝置、噴嘴三部分組成。工作原理為:氮氣瓶提供氮氣流,流量計調節氮氣流速,通過氮氣輸出管將氮氣輸送至噴嘴敞口端;微注射泵推動微注射器,細胞懸液通過微注射器出口針頭所連接的聚四氟乙烯管輸送至插入噴嘴處的針管。噴嘴由200 μL 的移液器槍頭和 25G/30G 尖口針頭制作而成。
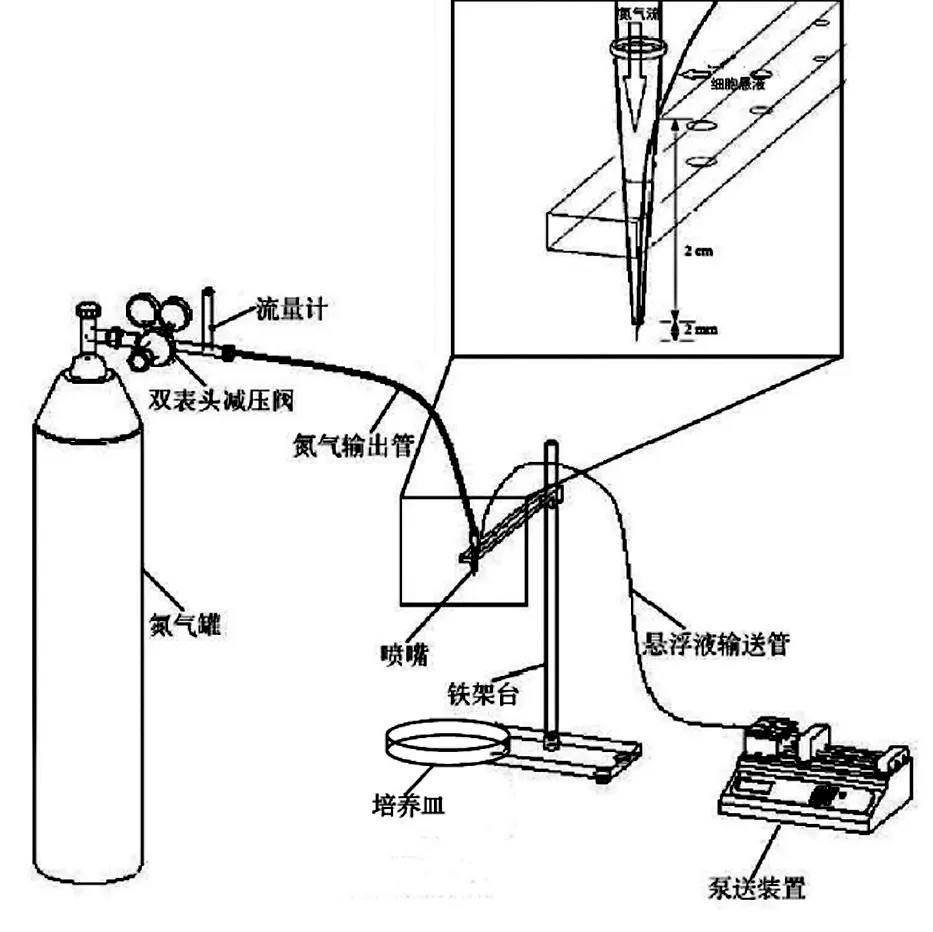
圖1 微滴噴射裝置示意圖Fig.1 Schematic diagram of micro-droplet spray device
圖2為噴嘴制作過程,首先將移液槍槍頭頂端切除2 mm,再取下針頭的不銹鋼針管,最后將針管從距槍頭尖端 2 cm 處側面插入,直至針管露出槍頭尖端 2 mm,將噴嘴固定于鐵架臺上。噴出的細胞用培養皿收集。

圖2 噴嘴制作步驟(a).準備實驗材料;(b).拔出針頭;(c).槍頭切去2 mm;(d).針頭側面插入Fig.2 Step of nozzle fabrication
2.3 微滴噴射單因素實驗設計
將HepG2細胞懸浮于一定濃度的低溫保護劑中進行微滴噴射實驗,研究懸浮液濃度、氮氣流速、懸浮液注射速度、接收位置及噴射針頭型號等五個因素對微滴大小和細胞活性的影響。實驗具體參數如下:氮氣流速分別為2.4 、3.2、4.0 、4.8 L/min, 噴射針頭為25G, 懸浮液濃度為10%Me2SO,懸浮液注射速度為200 μL/min,接收位置為距噴嘴6 cm處;懸浮液濃度分別為0.5%、10%Me2SO,噴射針頭為25G,氮氣流速為3.2 L/min,懸浮液注射速度200 μL/min,接收位置為距噴嘴6 cm處;懸浮液注射速度分別為160、180、200、220 μL/min,噴射針頭為25G, 懸浮液濃度為10%Me2SO,氮氣流速為3.2 L/min,接收位置為距噴嘴6 cm處;懸浮液接收位置分別為距噴嘴6、7.5、9 cm處,噴射針頭為25G, 懸浮液濃度為10%Me2SO,氮氣流速為3.2 L/min,懸浮液注射速度為200 μL/min;噴射針頭型號分別為25G、30G,懸浮液濃度10%Me2SO,氮氣流速為3.2 L/min,懸浮液注射速度為200 μL/min,接收位置為距噴嘴6 cm處。共五組單因素試驗,每組設置三次平行實驗,噴射的微滴用培養皿接收,每次接收時間為5 s,接收到的細胞進行顯微拍照,以及細胞存活率和24 h貼壁率的測定。
2.4 顯微拍照與圖像處理
將接收到噴射微滴的培養皿迅速放至顯微鏡下拍照,獲取放大40倍的微滴照片,每張照片選取三個視野。拍攝的照片用Image J處理軟件對微滴分布情況進行統計。
2.5 細胞存活率及24 h貼壁率測定方法
吸取100 μL重懸的細胞到離心管內,加入100 μL臺盼藍染色液(2X),混合均勻,染色3 min。再吸取10 μL經過染色后的細胞懸液,用血細胞計數板計數藍色細胞數和細胞總數。按式(1)計算細胞存活率。

(1)
將細胞培養瓶放入CO2培養箱培養24 h后,用離心管收集上清液,并用2 mL的D-hanks清洗細胞兩次,離心重懸后死細胞位于上清液及D-hanks清洗液中,活細胞都貼壁。貼壁細胞消化后,裝入離心管中離心重懸。計數出活細胞及死細胞數量。同時觀察細胞的生長情況和形態變化。按式(2)計算細胞24 h貼壁率。

(2)
2.6 統計學分析
采用統計分析軟件 SPSS18.0 對微滴面積和細胞活性進行t檢驗,各處理組間相互比較,P<0.05 即認為差異具有統計學意義,P>0.05表示差異不具有統計學意義。
3 結果與分析
3.1 氮氣流速對微滴噴射的影響
選用25G針頭作噴嘴,10%Me2SO細胞懸液,懸浮液注射速度為200 μL/min,接收位置為距噴嘴6 cm處,氮氣流速分別為2.4、3.2、4.0、4.8 L/min時,微滴噴射的液滴見圖3。由圖可以看出,隨著氮氣流速的增大,微滴尺寸明顯減小,單個視野內微滴數明顯增多,且微滴均勻性更好。說明氮氣流速對微滴大小具有極其顯著的影響,因此,可通過增加氮氣流速來減小微滴體積。
表1為不同氮氣流速下噴射的微滴大小及細胞活性的統計結果。從表中可以看出,氮氣流速對微滴尺寸有顯著影響,且對細胞活性具有顯著影響。當其從2.4 L/min增加到3.2 L/min時,細胞存活率有所增加;繼續增大氮氣流速,當氮氣流速從3.2 L/min繼續增至4.8 L/min時,細胞活性卻呈下降趨勢。氮氣流速為3.2 L/min時,細胞活性達到(90.17±2.10)%,而氮氣流速為4.8 L/min噴射時,細胞存活率僅為(70.86±3.76)%。隨著氮氣流速增大,氮氣流對細胞的剪切力也隨之加大,容易對細胞造成機械性損傷。當設置氮氣流速為3.2 L/min時,此時細胞活性最高,微滴直徑也小于100 μm,可確定為適宜的氮氣流速。

圖3 氮氣流速對微滴大小的影響(a).氮氣流速2.4 L/min; (b).氮氣流速3.2 L/min;(c).氮氣流速4.0 L/min; (d).氮氣流速4.8 L/minFig.3 Effect of nitrogen flow rate on droplet size表1 氮氣流速對微滴噴射的影響Table 1 Effect of nitrogen flow rate on micro-droplet spray

氮氣流速(L/min)微滴直徑(μm)細胞存活率(%)2.4193.45±81.75a80.63±2.44bc3.299.77±19.92b90.17±2.10a4.073.83±17.06c81.40±2.43b4.829.65±8.73d70.86±3.76cd
注:同列標有不同小寫字母表示組間差異具有統計學意義(P<0.05),標有相同小寫字母表示組間差異不具有統計學意義(P>0.05)。
3.2 懸浮液濃度對微滴噴射的影響
表2為不同懸浮液濃度時,微滴噴射的微滴大小及細胞活性。由表可知,當懸浮液濃度增加時,懸浮液尺寸明顯減小,細胞活性略有增加,各組間并不存在顯著性差異。原因是Me2SO存在一定的黏性,在一定范圍內,增加懸浮液黏度,可減小產生的微滴尺寸。同時,細胞活性無顯著性差異說明懸浮液中Me2SO濃度增加在噴射過程中并未對細胞產生明顯滲透損傷。考慮到慢速冷凍HepG2細胞一般也采用10%Me2SO作為低溫保護劑,故選用10%Me2SO作為低溫保護劑加載細胞。

表2 懸浮液濃度對微滴噴射的影響Table 2 Effect of suspension concentration on micro-droplet spray
注:同列標有不同小寫字母表示組間差異具有統計學意義(P<0.05),標有相同小寫字母表示組間差異不具有統計學意義(P>0.05)。
3.3 懸浮液注射速度對微滴噴射的影響
表3為不同懸浮液注射速度下,微滴噴射的微滴大小及細胞活性。從表中數據可以看出,當懸浮液注射速度由160 μL/min增至200 μL/min時,微滴體積隨懸浮液注射速度增大而減小,當注射速度繼續增至220 μL/min時,微滴尺寸有所增大,但各組間沒有顯著差異。但懸浮液注射速度對細胞活性卻具有顯著性影響,當懸浮液注射速度為200 μL/min時,此時細胞存活率明顯高于其他組。可能是當細胞懸浮液和氮氣流構成共流時,將懸浮液注射速度設置為200 μL/min,氮氣流速設置為3.2 L/min,二者流速較匹配,此時產生的微滴尺寸較小,且對細胞造成的剪切力損傷最小,故最優的懸浮液注射速度可確定為200 μL/min。

表3 懸浮液注射速度對微滴噴射的影響Table 3 Effect of suspension injection rate on micro-droplet spray
注:同列標有不同小寫字母表示組間差異具有統計學意義(P<0.05),標有相同小寫字母表示組間差異不具有統計學意義(P>0.05)。
3.4 微滴接收位置對微滴噴射的影響
表4為距噴嘴不同位置處接收的微滴大小及細胞活性。從表中數據可知,當接收距離從6 cm增至9 cm時,微滴直徑隨著接收距離的增大而減小,細胞存活率也減小。分析原因可能是隨著接收距離增大,微滴越不容易出現重疊現象,因此微滴尺寸越小,同時,接收距離增大,微滴擁有的勢能增大,轉化的動能便增大,由此造成的薄片接觸性損傷就越大,因此細胞活性會減小。當距離噴嘴6 cm處接收微滴時,此時得到的細胞活性最高,考慮到操作的方便性,接收位置不可過分接近噴嘴,故選擇在距噴嘴6 cm處接收細胞。
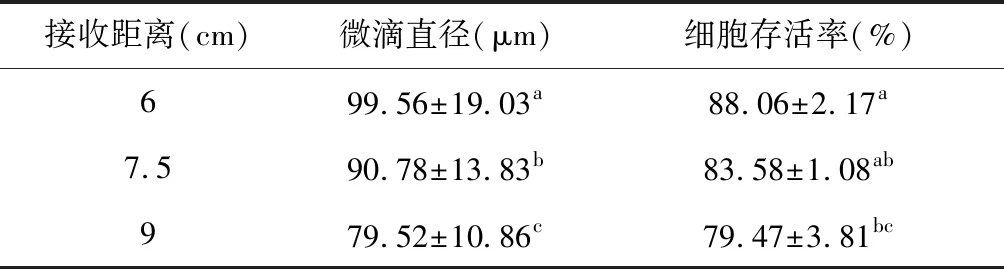
表4 接收位置對微滴噴射的影響Table 4 Effect of receiving position on micro-droplet spray
注:同列標有不同小寫字母表示組間差異具有統計學意義(P<0.05),標有相同小寫字母表示組間差異不具有統計學意義(P>0.05)。
3.5 針頭型號對微滴噴射的影響
表5為選用不同型號針頭噴射的微滴大小及細胞活性。結果顯示,30G針頭噴射的微滴尺寸明顯較25G噴射的微滴尺寸小,且微滴的均勻性更良好。由表中數據可知,采用30G針頭作噴嘴時,噴射出的微滴尺寸顯著小于25G噴嘴,且細胞活性顯著高于25G組。說明減小針頭孔徑到30G,并未對細胞造成更大的擠壓、剪切損傷。

表5 針頭型號對細胞活性的影響Table 5 Effect of needle type on cell activity
注:同列標有不同小寫字母表示組間差異具有統計學意義(P<0.05),標有相同小寫字母表示組間差異不具有統計學意義(P>0.05)。
4 總結與展望
通過單因素實驗研究懸浮液濃度、氮氣流速、懸浮液注射速度、微滴接收位置以及噴射針頭的型號等五個因素對微滴大小和細胞活性的影響。以細胞活性最高作為評估標準,確定最優的噴射參數為:選用30G針頭作噴嘴,10%Me2SO細胞懸液,氮氣流速為3.2 L/min,懸浮液注射速度為200 μL/min,接收位置為距離噴嘴6 cm處。采用此條件噴射的微滴半徑明顯小于100 μm,能夠有效實現玻璃化。
本研究僅通過微滴噴射培養皿接收后的液滴大小和細胞存活率,對微滴噴射參數進行了優化,并未將細胞噴射入液氮完成完整地玻璃化保存過程,對于細胞微滴噴射玻璃化后的效果還需要進一步驗證。僅以HepG2細胞為模型進行研究,該方法可以作為其他種類小體積細胞微滴噴射玻璃化保存的參考。另外,該微滴噴射系統如能解決大量收集的問題,即可實現小體積細胞高通量保存,滿足臨床應用的需求。

