利拉魯肽改善糖尿病心肌病大鼠心臟脂質異位沉積的效果和機制研究
蔡歡,何玉秀,劉靜芹,馮然,劉濤,李勛
糖尿病心肌病(diabetic cardiomyopathy,DCM)是繼發于糖尿病的一種獨立于冠心病和高血壓的心肌病,其病理機制目前仍不明確。選擇有心血管保護作用的降糖藥物是臨床研究的迫切任務。LEADER 研究表明,胰高血糖素樣肽(glucagon-like peptide-1,GLP-1)類似物利拉魯肽除了顯著降低血糖和血脂外,還具有心血管保護作用,主要通過降低內質網應激、降低氧化應激水平和心肌細胞自噬發揮心臟保護作用[1-3],但目前少有研究評估該藥物對糖尿病心肌脂代謝紊亂的改善效果。本研究旨在觀察利拉魯肽對DCM 大鼠心肌脂質異位沉積的改善作用,并探索潛在作用機制。
1 材料與方法
1.1 實驗動物及糖尿病心肌病大鼠模型的建立和分組干預
選 取8 周 齡 雄 性Wistar 大 鼠60 只,體 重180~220 g,清潔級,購于河北醫科大學動物實驗中心。隨機選取8 只大鼠作為對照組,普通飼料飼養;其余52 只大鼠給予高糖高脂飲食飼養,4 周后空腹狀態下一次性腹腔注射鏈脲佐菌素(35 mg/kg,溶于pH 4.5 的0.1 mol/L 的檸檬酸鹽緩沖液)制作糖尿病模型[3],對照組大鼠腹腔注射同體積的檸檬酸緩沖液。72 小時后測空腹血糖(FBG),1 周后復測,兩次均≥11.1 mmol/L 認為糖尿病造模成功,然后繼續飼以高糖高脂飲食,連續6 周后,經超聲心動圖檢查選出符合DCM 模型[4]的大鼠,共 24只,隨機分為DCM 組、低劑量利拉魯肽治療組(LL組)、高劑量利拉魯肽治療組(HL 組),每組各8 只。LL 組和HL 組分別給予利拉魯肽0.2 mg/(kg·d)和0.4 mg/(kg·d)皮下注射,對照組和DCM 組給予等體積的生理鹽水皮下注射,每日1 次,共干預8 周。隨后經超聲心動圖檢查心功能后麻醉處死大鼠。干預期間,對照組給予普通飼料,其余三組給予高糖高脂飼料,自由飲水,直至實驗結束。
1.2 實驗方法
1.2.1 大鼠生化指標檢測
干預8 周后,各組大鼠禁食12 h,1%戊巴比妥鈉(35 mg/kg)腹腔注射麻醉大鼠,心臟采血,分離血清,-20℃保存。檢測各組大鼠的FBG、總膽固醇(TC)、甘油三酯(TG)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)和血清空腹胰島素(FINS)水平。計算胰島素抵抗指數(HOMA-IR)和胰島β 細胞功能指數(HOMA-β):HOMA-IR=FBG(mmol/L)× FINS(mIU/L)/22.5;HOMA-β=20× FINS(mIU/L)/[FBG(mmol/L)-3.5]。
1.2.2 大鼠心臟功能檢測
干預8 周后,用1%戊巴比妥鈉(35 mg/kg)腹腔注射麻醉大鼠,固定后用彩色多普勒超聲(Fujifilm,加拿大)進行超聲心動圖檢查。經乳頭肌切面掃描左心室短軸切面,記錄M 超圖線,測量左心室射血分數(LVEF)、左心室短軸縮短分數(LVFS)、每搏輸出量(SV)等指標;由心尖部左心室長軸切面記錄二尖瓣血流頻譜,測左心室舒張早期最大血流/二尖瓣心房收縮期最大血流比值(E/A)以及等容舒張時間(IVRT)。所有測量數值通過3 個連續心動周期的平均值獲取。
1.2.3 大鼠心肌組織游離脂肪酸和二酰甘油含量測定
干預8 周后,各組大鼠取心尖部位組織50 mg左右,制作10%勻漿,4℃條件下3500 轉/min 離心15 min,吸取上清液,比色法測定游離脂肪酸(FFA)和二酰甘油(DAG)的含量。
1.2.4 標本處理及電鏡標本制備
各組大鼠處死后,迅速取出心臟,用冰鹽水沖洗干凈,濾紙吸干水分后稱重并計算心臟重量指數[心臟重量(mg)/體重(g)]。取5 mm 左右心肌組織,石蠟包埋,進行蘇木素伊紅(HE)染色。左心室中部取1 mm3組織,放入2.5%戊二醛中制備透射電鏡標本。其余部分放入凍存管中-80℃冰箱保存。
1.2.5 熒光定量PCR 檢測
對大鼠心肌組織腺苷單磷酸活化蛋白激酶(AMPK)、B 型利鈉肽(BNP)、白細胞分化抗原36(CD36)、叉頭框轉錄因子1(FOXO1)、過氧化物酶增殖物激活受體α(PPARα)等脂代謝相關基因進行熒光定量PCR 檢測。提取心肌組織總RNA,測定RNA 濃度。用First Strand cDNA Synthesis Kit 試劑盒(Thermo,美國)進行逆轉錄反應,操作方法按照試劑盒說明書進行。之后采用SYBR Green 熒光法(Roche,瑞士)進行實時熒光定量PCR 反應。用于PCR 擴增的引物序列見表1。結果通過相關基因表達/內參β微管蛋白(β-tublin)表達的相對量來表現。

表1 逆轉錄PCR 擴增的特異性引物序列表
1.2.6 蛋白免疫印跡法檢測
30 mg 心肌組織提取細胞總蛋白,測定蛋白濃度。每孔加入20 μg 蛋白進行SDS-PAGE 電泳,加入一 抗、CD36(1:1 000,Abcam)、AMPK(1:1 000,Abcam)、FOXO1(1:1000,Proteintech)、磷 酸 化AMPK(p-AMPK,1:1 000,Abcam)、磷酸化FOXO1(p-FOXO1,1:1 000,Abcam)、β-tublin(1:1 000,Santa),4℃過夜;之后加入1:3 000 稀釋的二抗,室溫孵育2 h,化學發光法(ECL)顯示。采用Image J軟件對結果進行圖像分析,β-tublin 作為內參,比較各組條帶的光密度值。
1.3 統計學方法
采用SPSS 20.0 軟件進行統計學分析,通過ShaPiro Wilk 進行正態分布檢驗,正態計量資料以均數±標準差()表示。多組間比較采用單因素方差分析,用Bonferroni 校正。P<0.05 為差異有統計學意義。
2 結果
2.1 各組大鼠血清生化指標比較(表2)
干預8 周后,與對照組比較,DCM 組大鼠FBG、FINS、HOMA-IR、TG 和LDL-C 水平顯著升高,HOMA-β 顯著降低(P均<0.05),TC、HDL-C水平差異無統計學意義(P>0.05);與DCM 組相比,LL 組和HL 組大鼠FBG、HOMA-IR、TG、LDL-C水平顯著降低,FINS、HOMA-β 顯著升高(P均<0.05),HL 組大鼠HDL-C 水平明顯升高(P<0.05),3 組大鼠TC 水平比較差異無統計學意義(P>0.05);與LL 組相比,HL 組大鼠HOMA-β、HDL-C 水平顯著升高(P均<0.05),其余指標差異無統計學意義(P均>0.05)。
2.2 各組大鼠心功能和心臟重量指數比較(表3)
干預8 周后,與對照組相比,DCM 組大鼠心臟重量指數明顯增加(P<0.01),LL 組和HL 組大鼠心臟重量指數均顯著降低(P均<0.01),HL 組比LL 組降低更明顯(P<0.05)。超聲心動圖檢查結果顯示,與對照組相比,DCM 組大鼠LVEF、LVFS 和SV 均顯著降低,E/A 比值明顯升高,IVRT 顯著延長(P均<0.05);與DCM 組相比,LL 組和HL 組大鼠E/A 比值均明顯降低(恢復到正常范圍),LVEF 均顯著增加(P均<0.01),LVFS、SV 和IVRT 差異均無統計學意義(P均>0.05);LL 組與HL 組大鼠在E/A 比值、LVEF、LVFS、SV、IVRT 等方面的差異均無統計學意義(P均>0.05)。
表2 各組大鼠血清生化指標比較(n=8,)
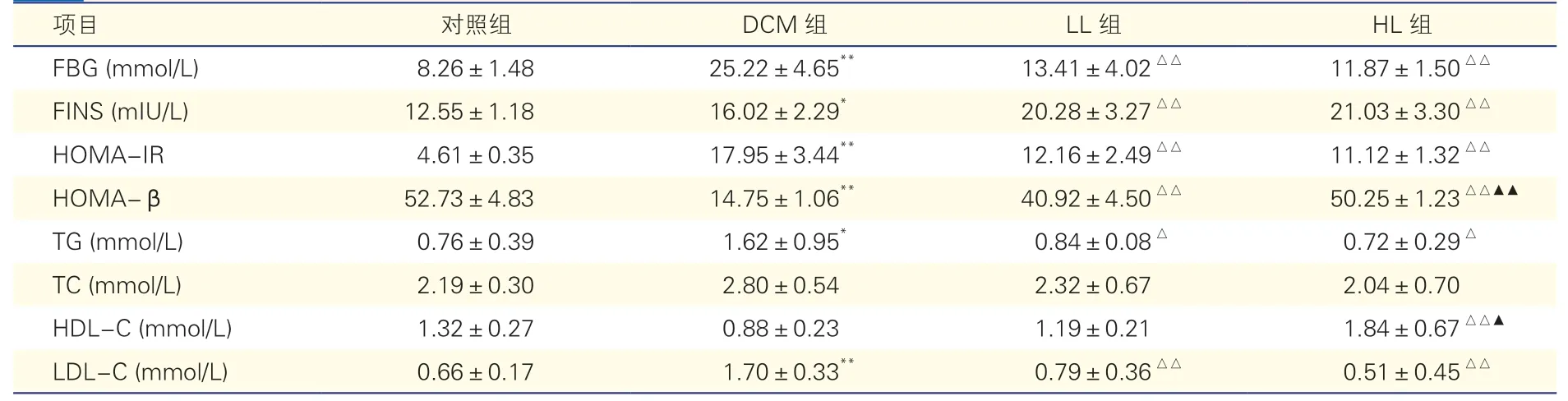
表2 各組大鼠血清生化指標比較(n=8,)
注:DCM 組:糖尿病心肌病組;LL 組:低劑量利拉魯肽治療組;HL 組:高劑量利拉魯肽治療組。FBG:空腹血糖;FINS:空腹胰島素;HOMAIR:胰島素抵抗指數;HOMA-β:胰島β 細胞功能指數;TG:甘油三酯;TC:總膽固醇;HDL-C:高密度脂蛋白膽固醇;LDL-C:低密度脂蛋白膽固醇。與對照組比較* P<0.05**P<0.01;與DCM 組比較△P<0.05△△P<0.01;與LL 組比較▲P<0.05▲▲P<0.01
表3 各組大鼠心功能及心臟重量指數比較(n=8,)
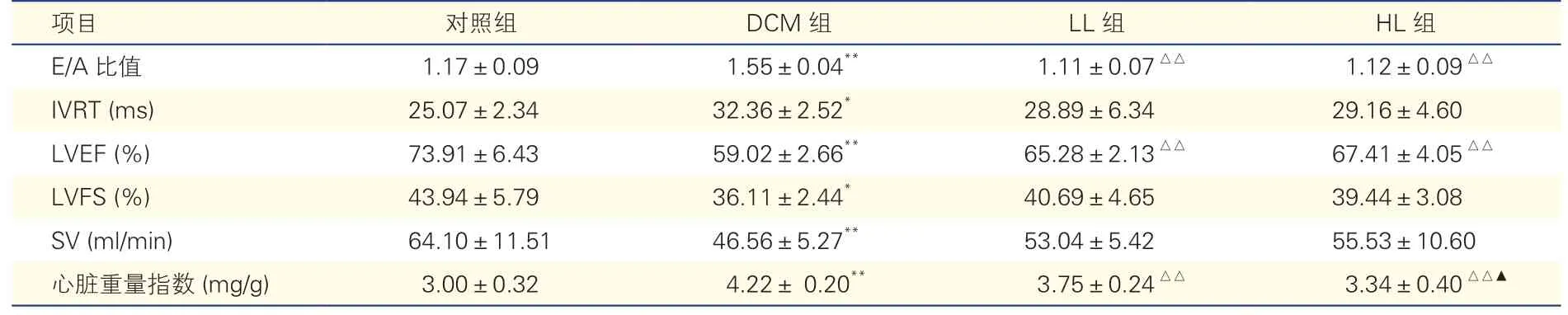
表3 各組大鼠心功能及心臟重量指數比較(n=8,)
注:DCM 組:糖尿病心肌病組;LL 組:低劑量利拉魯肽治療組;HL 組:高劑量利拉魯肽治療組。E/A:左心室舒張早期最大血流/二尖瓣心房收縮期最大血流比值;IVRT:等容舒張時間;LVEF:左心室射血分數;LVFS:左心室短軸縮短分數;SV:每搏輸出量。與對照組比較*P<0.05**P<0.01;與DCM 組比較△△P<0.01;與LL 組比較▲P<0.05
2.3 各組大鼠心肌組織形態及超微結構比較(圖1)
HE 染色后光鏡下觀察各組大鼠心肌組織形態可見:對照組大鼠心肌細胞排列整齊、致密,心肌纖維間鏈接緊密,染色均勻,未見肌纖維溶解;DCM 組大鼠心肌有較明顯的心肌纖維損傷和斷裂,心肌纖維排列紊亂,肌纖維間隙明顯增寬,組織間隙有血細胞堆積;經利拉魯肽干預后,LL 組和HL組大鼠心肌纖維排列較整齊,無斷裂、紊亂,心肌充血減少,細胞形態大體完整,HL 組效果明顯優于LL 組。
透射電鏡下觀察各組大鼠心肌細胞超微結構可見:DCM 組大鼠心肌細胞超微結構紊亂,肌絲溶解,排列紊亂,間質膠原纖維增多,大量脂滴堆積于線粒體旁和肌絲之間,心肌間有大量溶解空泡,線粒體數量減少,正常形態結構改變,線粒體嵴減少;與DCM 組比較,LL 組和HL 組大鼠心臟肌絲排列整齊,可見明顯Z 線,線粒體數量增加,體積增大,脂滴堆積明顯減少。
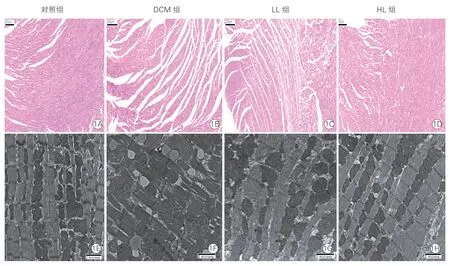
圖1 各組大鼠左心室心肌組織形態及超微結構比較
2.4 各組大鼠心肌游離脂肪酸和二酰甘油水平比較
干 預8 周 后,DCM 組 大 鼠 心 肌 內FFA[(72.21±18.11)μmol/L vs(51.40±11.14)μmol/L]和DAG[(0.62±0.18)ng/ml vs(0.39±0.10)ng/ml]水平與對照組相比均顯著升高(P均<0.01);與DCM組相比,LL 組與HL 組大鼠心肌內FFA[兩組分別為(48.60±7.27)μmol/L 和(47.71±10.67)μmol/L]和DAG[兩組分別為(0.38±0.07)ng/ml 和(0.37±0.10)ng/ml]水平均顯著降低(P均<0.01),但LL 組與HL組比較差異均無統計學意義(P均>0.05)。
2.5 各組大鼠心肌組織中過氧化物酶增殖物激活受體α 和B 型利鈉肽mRNA 表達水平比較
干預8 周后,熒光定量PCR 檢測結果顯示,DCM 組大鼠心肌組織中PPARα 和BNP 的 mRNA表達水平顯著高于對照組(相對表達水平分別為8.40±1.76 和12.37±3.02,P均<0.01),LL 組與HL 組大鼠心肌PPARα(相對表達水平分別為1.27±0.37 和2.81±0.36)和BNP(相對表達水平分別為2.50±0.54 和2.17±0.99)的 mRNA 表達水平均顯著降低(P均<0.01),但LL 組與HL 組之間差異均無統計學意義(P均>0.05)。
2.6 各組大鼠心肌組織中腺苷單磷酸活化蛋白激酶、叉頭框轉錄因子1、白細胞分化抗原36 mRNA 和蛋白表達水平比較(圖2~4)
干預8 周后,DCM 組大鼠心肌組織中AMPK 的mRNA 表達水平均略低于對照組,但差異無統計學意義(P>0.05);LL 組和HL 組大鼠心肌組織中AMPK 的mRNA 表達水平均高于DCM 組(三組相對表達水平分 別 為4.83±0.72、5.68±0.76 和0.77±0.09,P均<0.01),但LL 組和HL 組間差異均無統計學意義(P均>0.05);各組大鼠心肌組織中AMPK 蛋白表達水平的差異無統計學意義(P>0.05)。與對照組比較,DCM組大鼠心肌AMPK 活性(p-AMPK/AMPK 蛋白表達水平比值)受抑制,LL 組和HL 組大鼠心肌AMPK 活性較DCM 組均有不同程度升高,但LL 組和HL 組之間的差異無統計學意義(P>0.05,圖2)。
DCM 組大鼠心肌組織中FOXO1 的mRNA(相對表達水平為7.33±1.71)和蛋白水平較對照組均顯著升高,LL 組和HL 組大鼠心肌組織中FOXO1的mRNA(相對表達水平分別為1.79±0.17 和1.64±0.33)和蛋白表達水平較DCM組均顯著下降(P均<0.01),但LL 組和HL 組之間差異均無統計學意義(P均>0.05,圖3)。
與對照組相比,DCM 組大鼠心肌組織中CD36的 mRNA(相對表達水平為8.22±2.76)和蛋白表達水平顯著增加(P均<0.01)。LL 組和HL 組大鼠心肌組織中CD36 的 mRNA(相對表達水平分別為3.05±0.79 和3.08±0.84)和蛋白表達水平均顯著低于DCM 組(P均<0.01),但LL 組和HL 組之間的差異均無統計學意義(P均>0.05,圖4)。
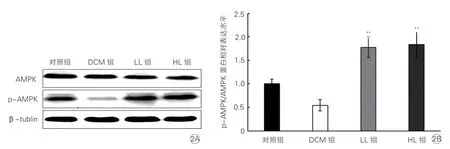
圖2 各組大鼠心肌組織中AMPK 蛋白表達水平比較
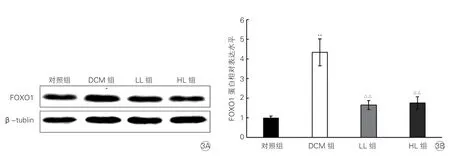
圖3 各組大鼠心肌組織中FOXO1 蛋白表達水平比較
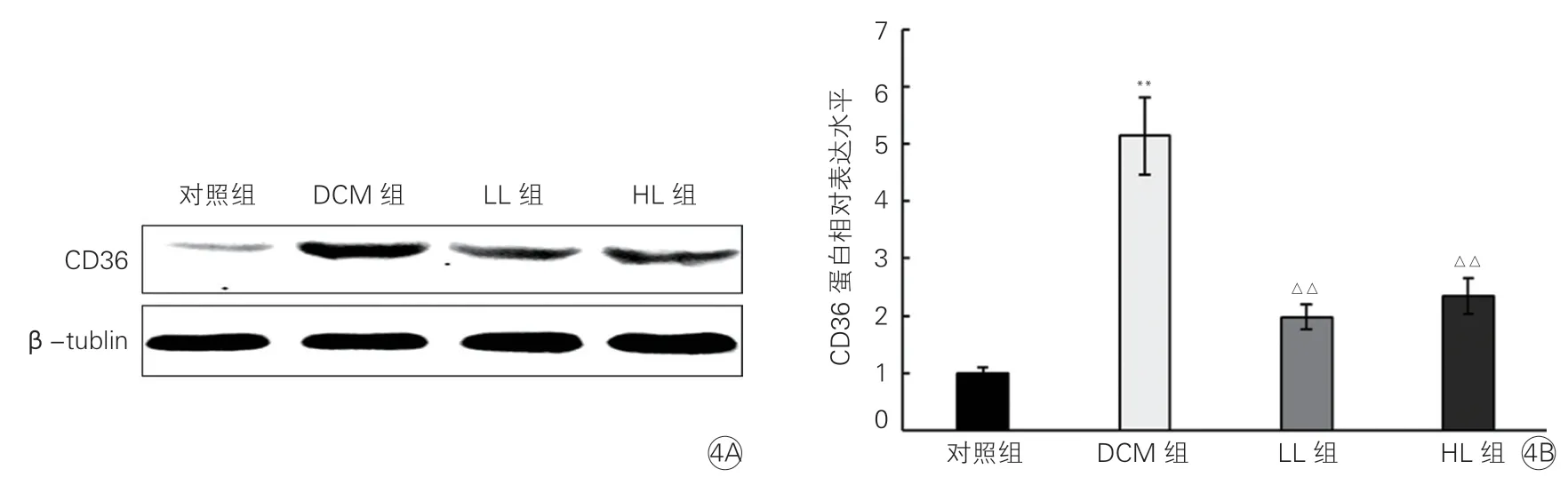
圖4 各組大鼠心肌組織中CD36 蛋白表達水平比較
3 討論
糖尿病是當今社會面臨的一個嚴重健康問題,也是心力衰竭的重要危險因素之一[5]。本研究發現DCM 早期表現為左心室舒張功能受損,DCM 大鼠心臟E/A 比值<1、IVRT 延長,此階段心臟出現代償性肥厚[6]。干預8 周后,DCM 大鼠收縮功能和舒張功能同時出現異常,即E/A 比值>1.5,LVEF 顯著降低,此階段舒張功能嚴重損害,心肌僵硬性增加,導致心臟充盈受限,出現擴張型心肌病的血流動力學改變[7]。同時,DCM 大鼠出現高血糖、高血脂、胰島素抵抗、胰島素敏感性降低等現象。因此,在DCM 的發生、發展過程中,控制血糖、血脂具有重要意義。
利拉魯肽是一種腸促激素[8],通過刺激血糖水平依賴的胰島素分泌、擬胰島素作用以及抑制胰高血糖素的分泌,從而達到降糖效果[9]。相比于其他降糖藥物,利拉魯肽可以提高LVEF,提高心肌梗死后的存活率,具有心臟保護作用[10]。本研究應用利拉魯肽治療8 周后,LL 組和HL 組大鼠的高血糖、高血脂和胰島素抵抗均顯著改善,心功能得到提高。這與Kraljevic 等[11]的研究結果部分一致。本研究還發現,HL 組比LL 組大鼠的HDL-C 水平改善更顯著,說明較高劑量利拉魯肽的調脂作用更佳。
心肌脂質異位沉積是DCM 的一個標志性指標,標志著DCM 進入比較嚴重的階段。在該階段,心肌細胞周圍堆積大量脂滴,心臟重量增加,僵硬性增加,進而影響心室的收縮功能[12]。本研究表明,DCM 大鼠心臟重量指數增加,HE 染色光鏡和透射電鏡檢查結果顯示,DCM 大鼠心肌纖維斷裂,心肌纖維周圍出現大量脂滴堆積,說明糖尿病大鼠心室出現以脂質異位堆積為特點的心室重構。心肌細胞內FFA 增加所造成的脂毒性使膜相關離子通道和泵功能發生改變,從而直接損害心肌的收縮功能[13]。本研究發現,DCM 組大鼠心肌內FFA 和DAG 水平明顯高于對照組大鼠,說明脂毒性物質在心肌內大量堆積,也直接證實了以上組織形態學的實驗結果。HL 組大鼠經利拉魯肽干預8 周后,心臟重量指數降低,心臟超微結構顯著恢復,這與Liu 等[14]的研究結果一致,高劑量利拉魯肽對心肌形態的改善效果優于低劑量利拉魯肽。兩種劑量的利拉魯肽均可降低DCM 大鼠心肌內脂質異位堆積,減輕脂毒性。
本研究還顯示,DCM 大鼠心肌內PPARα 和BNP 的mRNA 水平升高,說明DCM 大鼠心肌出現脂代謝紊亂以及有心力衰竭的表現。PPARα 與DCM 糖脂代謝紊亂有密切聯系,PPARα 通過上調FFA 轉運相關蛋白和脂質合成相關酶的表達,增加心肌對FFA 的攝取,促進心肌內脂質堆積[15]。FFA作為PPARα 的配體,可激活PPARα。本研究中,利拉魯肽顯著降低DCM 大鼠心肌組織中FFA 水平,從而抑制了PPARα 的激活,緩解了DCM 大鼠心肌脂代謝紊亂。BNP 是心力衰竭的重要指標,糖尿病與BNP 正相關[16]。本研究顯示,利拉魯肽可顯著下調DCM 大鼠心肌BNP mRNA 的表達水平,逆轉心衰進程,這與此前的臨床研究結果一致[17]。
DCM 有多種發病機制,糖脂代謝紊亂是基礎,長期高血糖和胰島素抵抗直接導致心肌細胞能量代謝紊亂。AMPK 是細胞內的能量感受器,可以在缺氧、葡萄糖缺乏等情況下激活,之后磷酸化其下游蛋白,改變細胞能量代謝[18]。AMPK 可以調節很多蛋白,FOXO1 是AMPK 重要的下游分子,參與多種細胞生物學的信號轉導及調控。有研究指出,FOXO1 的慢性激活是導致DCM 的原因之一[19]。當心肌細胞特異性抑制FOXO1 的活性時,高脂飲食誘導的心肌肥厚以及心功能降低和胰島素敏感性下降等現象可得到逆轉[20]。心肌細胞敲除FOXO1 后,心肌代謝從以FFA 代謝為主轉變為以葡萄糖代謝為主,心肌內脂質堆積減少[21]。當處于糖尿病或肥胖狀態時,心肌內脂質增多會加強FOXO1 的核聚集以及CD36從胞質中轉運到細胞膜上,增強心肌對FFA 的攝取,加劇心肌內脂質堆積[22]。本研究通過將DCM 大鼠與正常大鼠比較,發現FOXO1 活性在DCM 大鼠心肌內顯著升高,同時AMPK 活性受到抑制;經利拉魯肽干預8 周后,大鼠心肌組織中AMPK 活性顯著提高,FOXO1 活性降低,CD36 向細胞膜移位減少,減少心肌細胞對脂肪酸的攝取,降低心肌內脂質堆積。
綜上,DCM 導致心肌內AMPK 活性下降,從而上調FOXO1 的表達,FOXO1 促使脂肪酸轉運載體CD36 表達增加,使長鏈脂肪酸攝取增加,引起細胞凋亡,從而導致心臟功能的損害。利拉魯肽一方面通過作用于胰島細胞上的GLP-1 受體,通過環磷酸腺苷(cAMP)信號通路刺激胰島素分泌,降低血糖、血脂和胰島素抵抗,減少循環中脂肪酸含量,從而減少心肌細胞對脂肪酸的攝取;另一方面直接作用于心肌脂代謝相關因子,通過激活AMPKFOXO1-CD36 信號通路改善DCM 大鼠心肌脂質異位沉積,從而改善左心室收縮舒張功能,發揮心臟保護作用。本研究中,高、低劑量利拉魯肽干預對DCM 大鼠的心臟保護作用沒有顯著差異,需進一步探討其原因。

