我國公立醫院人員對干細胞臨床研究知情同意的認知調查*
馬晨光 雷 穎 白莉華 王劍萍 林 云 薛 迪
鑒于干細胞臨床研究的風險較大,遠期和近期收益的不確定性,近來我國加強了干細胞臨床研究的管理[1-2]。本研究旨在分析我國公立醫院干細胞臨床研究相關人員對干細胞臨床研究知情同意書相關內容的重要性認知,為我國規范公立醫院干細胞臨床研究的倫理管理提供參考信息。
1 研究內容與方法
本研究選取了社會經濟發展水平分別處于高、中、低的上海市、天津市和貴州省作為調查的省級行政區域,選擇此3個區域10所首批和第二批通過國家干細胞臨床研究備案的公立醫院進行了干細胞臨床研究相關人員的問卷調查。問卷調查對象為醫院科研部門主要管理者、生物樣本庫(包括干細胞樣本庫)的主要負責人、所有從事或未來可能從事干細胞臨床研究的研究者和臨床醫師、藥物臨床試驗機構和倫理委員會的所有委員。通過此問卷調查,以了解公立醫院人員對干細胞臨床研究知情同意的認知情況。
在對干細胞臨床研究知情同意書內容的重要性進行評價時,本研究采用5分制,即1分為“完全不重要”,5分為“非常重要”。若對評價項目不清楚,則填寫“0”,分析時作為缺失值。本研究采用SAS 9.3軟件進行χ2檢驗、精確Fisher檢驗等統計分析。
2 結果
本研究發放問卷882份,共回收10所公立醫院干細胞臨床研究相關人員的有效問卷882份。
2.1 對干細胞臨床研究知情同意內容重要性的評分
調查顯示,公立醫院人員對干細胞臨床研究知情同意內容重要性評分總體較高(各項目的平均評分為4.02分~4.66分);尤其是對干細胞制劑的質量和干細胞臨床研究過程的質量控制措施的告知重要性評分均值最高(均為4.66分),對研究存在的主要風險(如致瘤/致癌性)、可能產生的不良事件/反應的處理方法和研究風險控制措施的告知重要性評分均值次之(平均為4.60分、4.60分和4.59分),見表1。
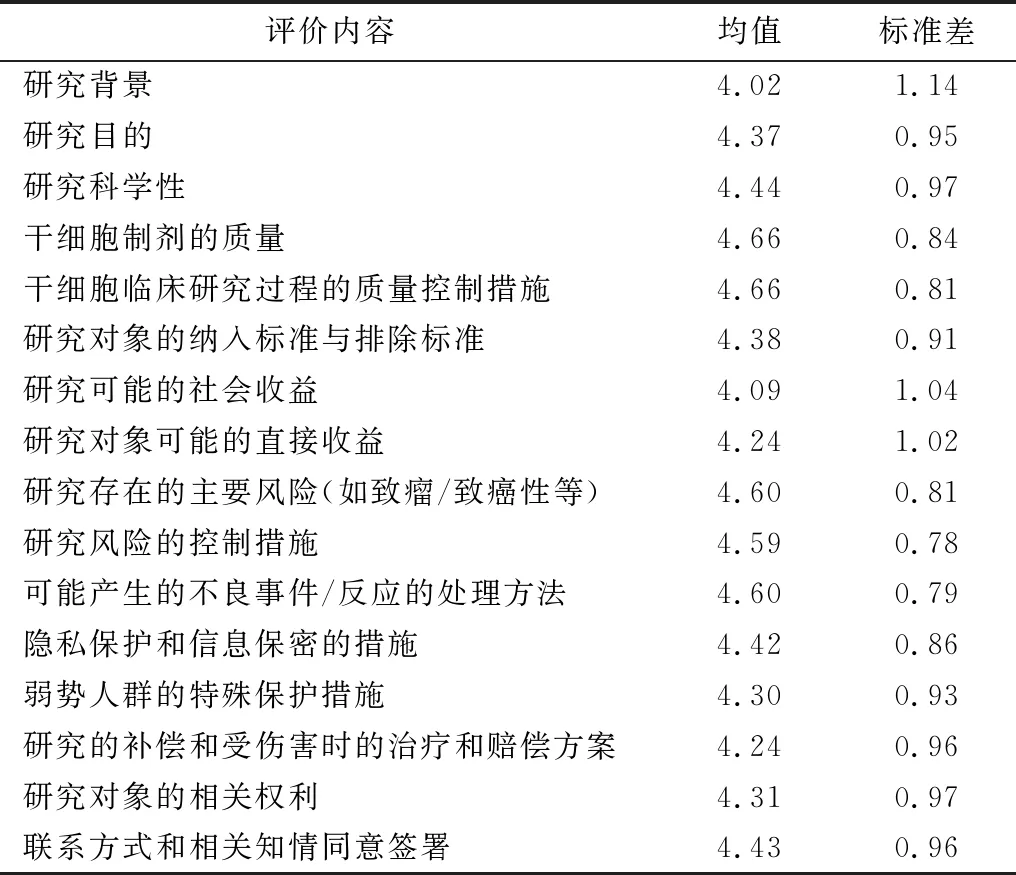
表1 對干細胞臨床研究知情同意內容的重要性評分
2.2 對干細胞臨床研究知情同意形式和退出方式的認知
調查顯示,干細胞臨床研究相關人員中,認為干細胞研究知情同意的最好形式為獨立的知情同意書者占81.07%;認為干細胞及相關生物樣本庫的樣本和信息退出方式為無條件銷毀未使用和正在使用的樣本及相關信息、無條件銷毀未使用的樣本及相關信息、僅銷毀可以追蹤到個人的樣本及相關信息的分別占69.84%、37.84%和29.24%,見表2。
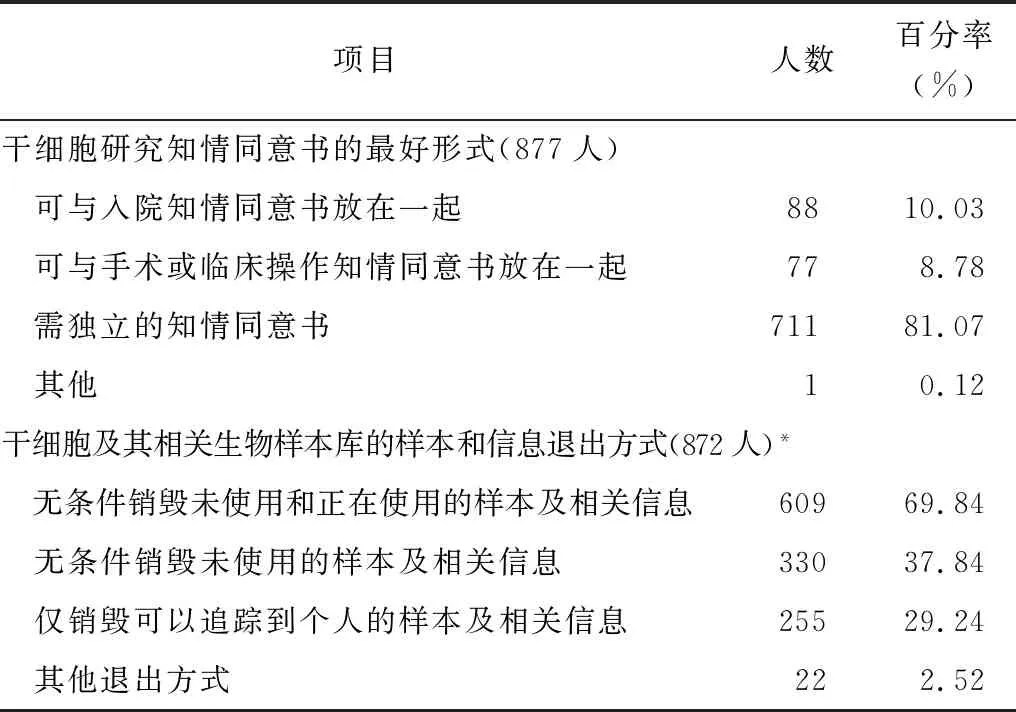
表2 對干細胞臨床研究知情同意形式和退出方式的認知分析
*本項為多選
2.3 視知情同意為干細胞臨床研究主要倫理問題的比例
調查顯示,干細胞臨床研究相關人員中,將夸大研究對象可能獲得的收益、知情同意的方式和過程以及未充分告知研究對象的風險列為前三位干細胞臨床研究主要倫理問題的分別占34.86%、22.15%和21.80%。此外,臨床醫師將夸大研究對象可能獲得的收益作為前三位干細胞臨床研究主要倫理問題的比例相對較高(為38.48%),見表3。
表3將干細胞臨床研究知情同意列為前三位主要倫理問題的比例(多選)
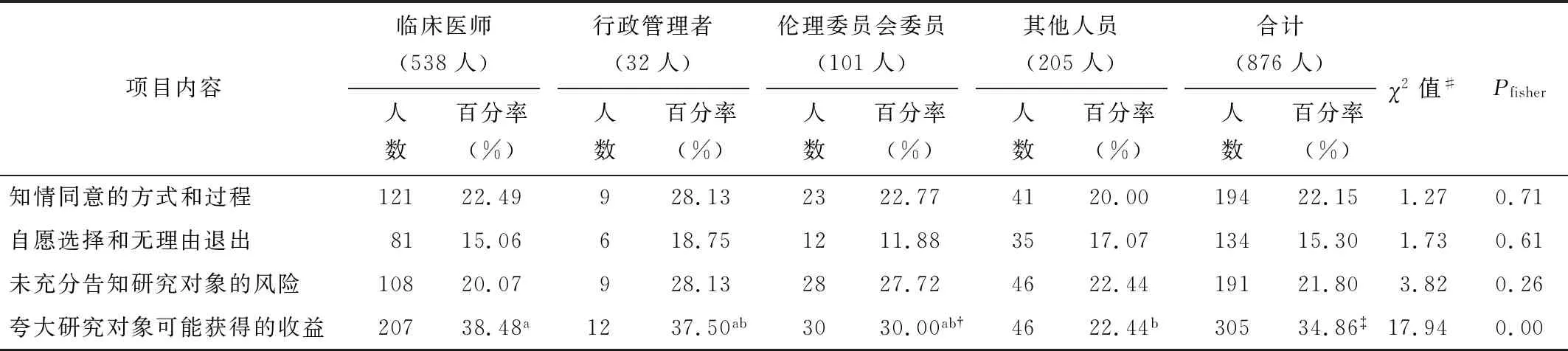
項目內容臨床醫師(538人)人數百分率(%)行政管理者(32人)人數百分率(%)倫理委員會委員(101人)人數百分率(%)其他人員(205人)人數百分率(%)合計(876人)人數百分率(%)χ2值#Pfisher知情同意的方式和過程12122.49928.132322.774120.0019422.151.270.71自愿選擇和無理由退出8115.06618.751211.883517.0713415.301.730.61未充分告知研究對象的風險10820.07928.132827.724622.4419121.803.820.26夸大研究對象可能獲得的收益20738.48a1237.50ab3030.00ab?4622.44b30534.86?17.940.00
注:?此項總人數=100;此項總人數=875;#組間兩兩比較取檢驗水準α=0.05/4=0.0125;標有相同字母的發生率類別間差異無統計學意義
3 討論與建議
3.1 干細胞臨床研究知情同意需特別告知的內容
與其他臨床研究不同,干細胞制劑質量直接與干細胞臨床研究的風險密切相關,并且干細胞臨床研究的質量控制和風險控制措施對降低干細胞臨床研究風險意義重大[1,3-4]。本研究也發現,公立醫院人員對干細胞制劑的質量、研究存在的主要風險(如致瘤/致癌性等)、研究過程質量控制、研究可能產生的不良事件/反應的處理方法和風險控制措施的告知重要性評分均較高(4.5分以上)。這提示,未來在干細胞臨床研究知情同意書的審核中,需關注干細胞制劑質量、研究主要風險(如致瘤/致癌性)和研究過程的質量與風險控制措施的告知,讓受試者對干細胞臨床研究的安全性有更深入的了解,以使他們能在充分知情的情況下,自愿地選擇。
3.2 對干細胞臨床研究知情同意要求的認知存在不足
調查發現,雖然81.07%的被調查人員認為干細胞臨床研究需有獨立的知情同意書,但仍有少部分人員認為可與入院知情同意書或與臨床手術/操作知情同意書放在一起。這提示目前我國干細胞臨床研究的部分相關人員還缺乏對知情同意實施過程的正確認知,這可能會導致醫務人員在獲得研究對象知情同意時存在不規范的現象[5-6]。此外,近70%的被調查人員認為干細胞臨床研究對象或生物樣本捐獻者退出時,可無條件銷毀未使用和正在使用的樣本及相關信息,不足40%的人認為可無條件銷毀未使用的樣本及相關信息或僅銷毀可以追蹤到個人的樣本及相關信息。這提示相關醫務人員對干細胞研究與生物樣本捐獻者知情同意退出方式認知不足。
3.3 知情同意是干細胞臨床研究倫理審核的重點之一
知情同意是醫學臨床研究中十分重要的環節,在臨床研究實踐活動中,醫務人員充分告知研究對象相關信息,使他們充分理解信息,并真正行使自主選擇的權利,才能實現真正意義上的知情同意[7-8]。由于干細胞臨床研究與應用存在較大臨床隱患和特殊風險,撰寫良好的知情同意書可以充分告知研究對象研究具有的主要潛在風險和預期收益,尊重和保護患者的合法權益[8-9]。本研究發現,34.86%的被調查人員將夸大研究對象可能獲得的收益列為前三位干細胞臨床研究的倫理問題,且臨床醫師此比例相對較高(38.48%)。因此,干細胞臨床研究的倫理審核應更關注知情同意書內容的審核,以充分保護受試者的權益。

