宮頸錐切術后病理因素預測病變殘留的價值探討
鄭小冬 楊 潔 胡仙清 陳晶晶 葉 艷 潘嘉佳
子宮頸癌發生率和病死率分別居女性全身惡性腫瘤的第3位和第4位[1]。宮頸浸潤癌在發病前要經歷較長的癌前病變階段。近年來,宮頸癌前病變以及微小浸潤癌患者診斷率不斷上升,而且患者呈明顯越來越年輕化趨勢。宮頸錐切術作為治療宮頸癌前病變和微小浸潤癌的標準診治手段,保留子宮功能,且能提供病變組織標本供病理學檢查。宮頸錐切術后病理結果是錐切術后后續處理的一個重要依據。如何根據病理結果進行處理目前尚無共識。本研究旨在探討病理各因素預測病灶殘留的價值,為宮頸錐切術后如何根據病理結果進行進一步分層處理提供臨床資料。
對象與方法
1.研究對象:選擇2016年4月~2017年12月于溫州市人民醫院因宮頸上皮內瘤變及微小浸潤癌行初治宮頸錐切術共789例,將其中住院行二次手術,符合以下標準患者共97例進入研究。(1)入選標準: ①患者術前經組織學證實的宮頸病變(高級別或持續存在的CINⅠ)及微小浸潤癌;②患者于筆者醫院門診行宮頸環形電切術(loop electrosurgical excision procedure,LEEP)或者住院行普通電刀錐形切除術[2];③術后6個月內住院補充行2次手術(包括重復宮頸錐切術、全子宮切除術)。(2)排除標準:①宮頸錐切術后確診為Ⅰ A1伴脈管瘤栓、ⅠA2或浸潤癌;②術后半年后因復發行二次手術患者;③臨床資料不完整。
2.臨床及病理資料收集:收集記錄患者年齡、生育史、是否絕經;有無接觸性出血或絕經后出血、宮頸細胞學結果、高危HPV檢測結果及宮頸搔刮情況;初次錐切方式;初次錐切術后病理資料:切緣情況、是否累及腺體、病理診斷和活檢病理比較情況;再次手術方式及術后病理情況等。
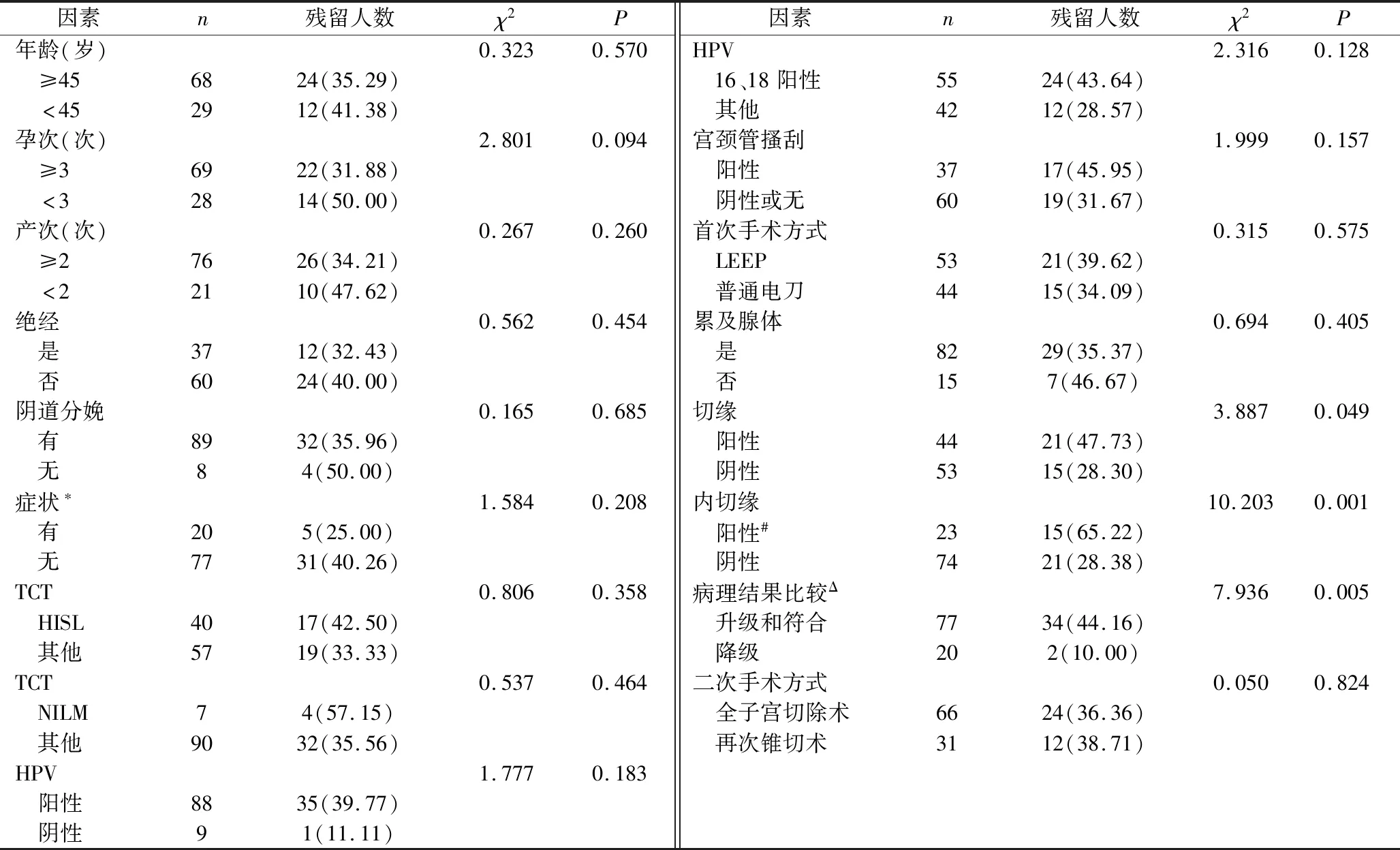
3.診斷標準:(1)切緣陽性[3]:宮頸錐切標本邊緣,可見病變或距離病變與切緣 4.手術標本送檢后處理:病理科將錐切組織以所標記的點數為參照,平均分為12份,按順時針方向分別命名為“點”至“點”。標本制片并染色后由病理科2位副主任醫師以上專家仔細閱片并診斷,如兩位醫生有相反結論,則由第3位病理醫生進一步判斷。 1.臨床資料總體情況:因宮頸上皮內瘤變及微小浸潤癌于筆者醫院行初治宮頸錐切術共109例,剔除升級為ⅠA2以上6例,剔除二次手術超過6個月6例,符合標準共97例。患者年齡49.56±9.72(27~73)歲,其中≥45歲68例;絕經37例;孕次≥3次69例;產次≥2次76例;無陰道分娩史8例;無妊娠史1例;有接觸性出血或絕經后出血20例;TCT結果為NILM7例,為HSIL40例;HPV陽性88例,其中HPV16陽性54例,HPV18陽性1例;首次手術行LEEP 53例,行普通電刀錐切術44例;2次手術行再次普通電刀錐切術31例,全子宮切除術66例。 2.病理資料情況:宮頸搔刮陽性37例;首次術前CIN1級4例;CIN2級27例,CIN3級64例, 微小浸潤癌2例;初次術后升級19例,升級為ⅠA1期2例,均無脈管瘤栓;符合58例,降級20例,其中降級為CIN1級及以下14例;切緣陽性44例,其中內切緣陽性23例;累及腺體82例;97例患者初次術后殘留36例(殘留組),其中CIN1級11例,總殘留率37.11%,無殘留病變61例(無殘留組)。 3.臨床及病理因素與病變殘留的單因素分析結果:殘留組平均年齡為19.61±10.28歲,非殘留組平均年齡為49.52±9.46歲,差異無統計學意義(t=-0.042,P>0.05)。同時比較各因素分類后比較殘留率。孕次≥3次病例病變殘留率31.88%(22/692),低于孕次<3次病例病變殘留率50.00%(14/28),但差異無統計學意義(χ2=2.801,P=0.094)。切緣陽性病例病變殘留率47.73%(21/44),高于切緣陰性病例殘留率28.30%(15/53),且差異有統計學意義(χ2=3.887,P=0.049);進一步分析切緣情況,發現內切緣陽性病例(內切緣陽性組)病變殘留率65.22%(15/23),高于切緣陰性病例病變殘留率27.27%(15/55)和其他切緣陽性病例病變殘留率31.57%(6/19),差異有統計學意義(χ2=10.315,P=0.006),而后兩者比較差異無統計學意義(χ2=0.129,P=0.720),將后兩者合并為內切緣陰性組。初次術后病理升級、符合及降級病例病變殘留率分別為47.36%(9/19)、43.10%(25/58)和10.00%(2/20),差異有統計學意義(χ2=8.047,P=0.018),但前兩者比較差異無統計學意義(χ2=0.106,P=0.745),將前兩者合并(升級和符合組)與降級組進行進一步分析(表1)。 表1 97例患者臨床及病理因素與病變殘留的單因素分析結果 [n=97,n(%)] *接觸性出血或絕經后出血;#包括單純內切緣陽性及內切緣和外切緣或基底均陽性;Δ首次術后病理與活檢病理比較;TCT.液基超薄細胞學檢查;HISL.高度鱗狀上皮內瘤變;NILM.未見上皮內病變細胞和惡性細胞;HPV.人乳頭瘤病毒;LEEP.環形電切術 4.殘留相關因素的Logistic多因素回歸分析結果: 因變量為有無病變殘留,自變量分別為孕次、切緣情況、內切緣情況、首次錐切術后病理比較結果,賦值情況見表2,進行向前逐步篩選Logistic回歸,發現內切緣陽性、升級和符合為病變殘留的獨立高危因素,并得出回歸方程:LogitP=-2.303+1.323X3+1.685X4(表3),此最終模型,經Hosmer和Lemeshow檢驗后,其統計量的觀測值為3.152,P值為0.207,模型擬合優度較好。 宮頸上皮內瘤變(cervical intraepithelial neoplasia, CIN)是宮頸癌的癌前病變, 根據細胞異型程度和病變范圍可分為1、2和3級,反映了宮頸癌發生、發展的連續過程。CIN的病理診斷級別越高,表明鱗狀上皮受累越深,有研究表明,病變級別越高,其跳躍性、多中心生長的生物學特性越明顯[4]。因此,建議對高級別CIN患者首先采取宮頸錐切術。美國國立綜合癌癥網絡2019宮頸癌治療指南提出ⅠA1 期建議先行宮頸錐切術。 表2 各因素Logistic回歸分析時賦值情況 *包括單純內切緣陽性及內切緣和外切緣或基底均陽性;#首次術后病理與活檢病理比較 表3 Logistic多因素逐步回歸分析結果 (n=97) *包括單純內切緣陽性及內切緣和外切緣或基底均陽性病例 自1815年Lisfranc首次使用宮頸錐切術治療宮頸病變以來,宮頸錐切的技術與方法不斷發展,早期僅有冷刀錐切,近年來高頻電波刀的LEEP、普通電刀錐切。有研究報道宮頸錐切對CIN的治愈率達87%~98%,此外,宮頸錐切也是診斷早期宮頸癌分期的重要手段。有研究報道宮頸錐切術后仍有15%左右的患者術后存在病變殘留或復發風險[5]。宮頸錐切術后是否需要二次手術應根據患者年齡、生育要求、隨診條件、醫療資源、錐切病理結果等決定,應遵循個性化的原則并征得患者的知情同意。其中宮頸錐切術后病理結果是決定錐切術后是否需要二次手術的重要因素。探討錐切術后病理因素對病灶殘留的預測價值對于進一步分層處理具有重要臨床意義。本研究對于病理因素中切緣狀態、是否累及腺體及術后病理與活檢病理比較情況與病灶殘留的關系進行了初步探討。 錐切術后標本切緣狀況預測術后病灶殘留的臨床價值,國內外的各種研究很多,但結果并不統一。研究發現切緣陽性為病灶殘余的獨立高危因子。Bekkers 等[6]報道,60%~82%宮頸錐切術后宮頸病變切緣呈陽性者有殘存病變,而切緣呈陰性者,僅 8%~24%有殘存病變。Baloglu 等[7]研究發現,切緣陽性可以用來預測 CIN 患者術后病變殘留或復發的發生。Lubrano等[8]研究發現,切緣狀態是病變殘留/復發的獨立危險因素(OR=2.7, 95%CI:1.5~4.7,P=0.001)。Kong等[9]認為宮頸錐切術后宮頸病變切緣呈陽性,可影響患者預后,被認為是 CIN 持續或復發的危險因素。 周萍等[10]通過對10篇研究報道共1620例病例資料進行匯總,得出結論:切緣陽性的患者其病灶殘留率較陰性者明顯高出數倍,差異有統計學意義。然而,也有少數研究者認為錐切切緣陽性不是病灶殘余或術后復發的獨立危險因素,二者沒有發現有直接聯系。Sim?es等[11]研究結果也提示,切緣陽性患者在隨訪過程中有 60%~80%未發現病變。同時,也有研究發現切緣陰性并不代表宮頸中無殘留病灶。Schneider等[12]發現,75例CIN錐切術后切緣陰性患者二次手術后,病灶殘留率為16%(12/75)。Hamontri等[13]研究了142例CIN錐切后切緣陰性病例發現,術后病灶殘留率為14.7%(21/142)。另有研究者對不同切緣陽性與殘留的關系也進行了研究,結果也頗有爭議。Boonlikit等[14]通過多元回歸分析發現內切緣累及是殘留或復發的獨立危險因素,而外切緣與殘留或復發的相關性無統計學意義。Reich 等[15]研究結果顯示內切緣呈陽性者的宮頸病變更為隱蔽,更易被漏診,而且術后病變殘留率與宮頸病變復發率均較高,故對于宮頸內切緣呈陽性患者,臨床需提高警惕。李寒松等[16]多因素Logistic回歸分析結果表明,內切緣陽性是病變殘留的高危因素。本研究前期回顧性研究發現內切緣陽性為病變殘留的高危因素[17]。 本研究在原來研究基礎上開始收集病理進行前瞻性分析,病理例數增加至97例,結果顯示切緣陽性病例病變殘留率47.73%(21/44),高于切緣陰性病例病變殘留率28.30%(15/53),差異有統計學意義(χ2=3.887,P=0.049),但排除混淆因素后提示切緣陽性不是病灶殘留的獨立危險因素。進一步分析發現內切緣陽性病例病變殘留率65.22%(15/23),明顯高于其他切緣病例病變殘留率28.38%(21/74),差異有統計學意義(χ2=10.203,P=0.001)。回歸分析結果顯示,內切緣陽性為病變殘留的獨立預測因素,OR=3.754(95% CI:1.352~10.425,P<0.05),對病灶殘留具有一定預測價值,此結果與Boonlikit等研究基本一致。 目前對于錐切病理與活檢病理比較結果對于病灶殘留的預測價值研究不多。有研究報道對于宮頸錐切術后病理結果升級的患者往往需要二次手術。本研究結果顯示升級病例殘留率47.36%(9/19),符合病例殘留率為43.10%(25/58),升級和符合的殘留率明顯高于降級殘留率10.00%(2/20),符合和升級為病灶殘留的獨立危險因素,OR=5.395(95% CI:1.138~25.582,P<0.05),對病灶殘留具有一定預測價值。 據相關文獻報道,CIN錐切術后病灶殘留率差別較大,0~85.7%不等,本研究切緣陽性術后殘留率為47.73%,明顯高于賴愛欒等[18]文獻中顯示的切緣陽性術后病灶殘余率為 17.9%。這與本研究病灶殘留的定義采用有病變殘留包括CIN1級病變有關。本研究結果顯示年齡、孕產次、生育史、術前HPV感染類型、TCT結果、宮頸搔刮、腺體受累、首次和二次手術方式等均與病灶殘留無明顯相關性,也與既往研究不盡相同。臨床病理因素對病灶殘留的預測價值的各研究結果并不統一,這與病灶殘留的定義、入選病例的標準及研究對象數量有差異有關。 綜上所述,本研究結果顯示內切緣陽性且病理符合或升級的病例殘留率高,因此建議補充二次手術。病理降級殘留率低,僅為10.00%,可選擇密切隨訪,但本研究殘留病例中降級僅2例,仍需要后續增加更多病例的研究進一步支持。宮頸錐切術作為治療宮頸癌前病變并保留子宮功能,錐切術后的后續處理需要尋找更多更可靠的預判因素,以助于確保理想的預后前提下,盡可能減少創傷,提高患者的生存質量,避免二次過度治療。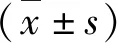
結 果
討 論



