有機過氧化物的穩定性研究進展
唐小華,惠菲,查飛,吳思宇,周友三
(1.西北師范大學 化學化工學院,甘肅 蘭州 730070;2.蘭州助劑廠有限責任公司,甘肅 蘭州 730079)
有機過氧化物是H2O2中一個或兩個H被有機官能團取代后的產物,通式為R—O—O—R1,依據所含官能團可分為過氧化羧酸、烷基過氧化物、過氧化酮、酯類過氧化物、酰類過氧化物[1]。有機過氧化物在高分子材料領域中應用較廣,主要用作高分子化合物單體引發劑、高分子化合物交聯劑以及降解劑,是制備高分子材料的關鍵性原料。由于分子中含有 —O—O—鍵,具有不穩定性和強氧化性,在遇熱、撞擊、摩擦,或在摻雜酸、堿、金屬、橡膠等情況下,都易分解。近年來,由有機過氧化物引發的事故見表1,如何降低有機過氧化物安全性危害一直是安全領域的研究重點[2],因而對有機過氧化物的穩定性研究顯得尤為重要。
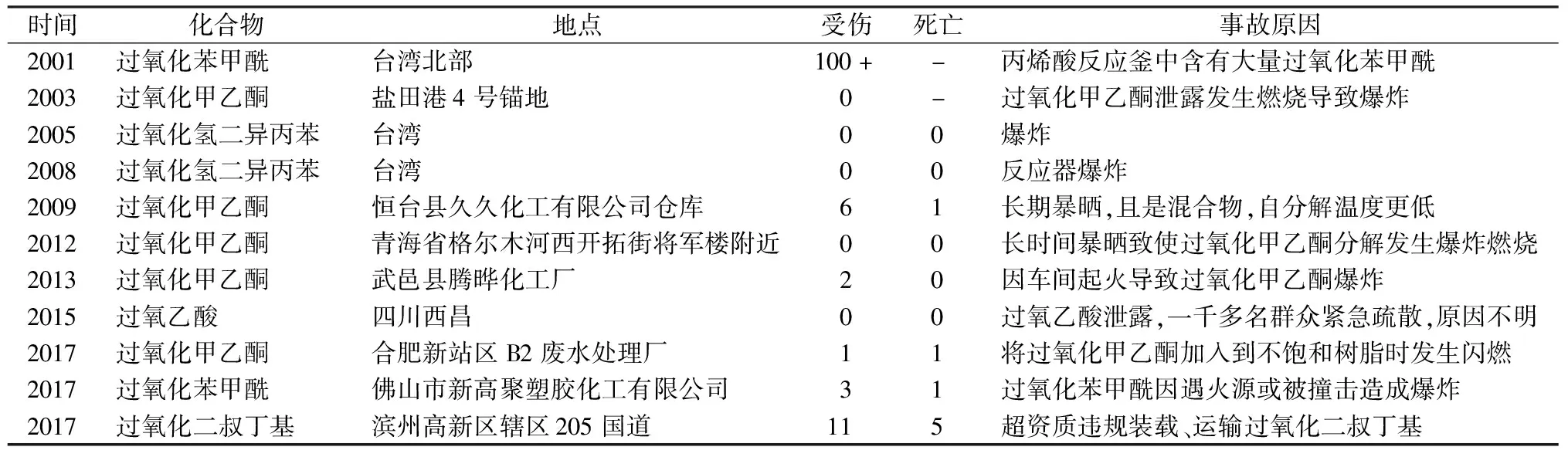
表1 近年來有機過氧化物的熱爆炸事故Table 1 Thermal explosion accident of organic peroxide in recent years
注:“-”表示未知。
1 有機過氧化物的熱分解
1.1 熱分解機理
有機過氧化物中的 —O—O—鍵長而弱,極不穩定,遇熱易分解,隨溫度升高,熱分解加劇。研究表明,在特定的溫度下,有機過氧化物熱分解發生自由基的連鎖反應。過氧化氫異丙苯的熱分解機理見圖1[3],反應進程為:有機過氧化物→自由基→分解產物+熱量[4]。反應釋放大量熱,若熱量不能及時移走,反應溫度急劇上升,反應速率加快將引發爆炸。
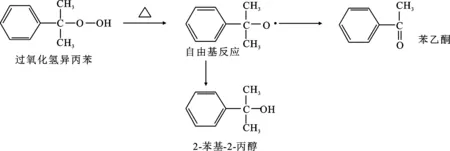
圖1 過氧化氫異丙苯的熱分解機理Fig.1 Thermal decomposition mechanism of cumene hydroperoxide
1.2 熱分解的研究方法
有機過氧化物熱分解的研究方法主要通過檢測有機過氧化物放熱反應,收集放熱參數來進行熱動力學分析,還可運用預測法對有機過氧化物建立預測模型。
1.2.1 定量性質-結構相關性(QSPR)法 QSPR研究方法是依據化合物性能與分子結構密切相關原理,通過理論計算結合統計學方法,建立有機化合物的物理化學性質與其結構之間的定量關系。研究的基本步驟包括:數據的獲取和整理,分子結構的構建、優化,分子結構描述符的計算、選取,預測模型的建立和評價[5]。
QSPR模型可模擬特殊類別物質的危險特性,如含能材料的撞擊和爆炸極限、活性化學物質的自反應危險性預測等,該方法可彌補實驗研究的一些不足,因而受到學者的廣泛關注及應用。依據定量結構-性質相關性的原理,結合有機過氧化物的分子結構與其熱分解的內在聯系,選擇合適的預測模擬模型進行參數預測,常用的建立模型的方法有多元線性回歸(MLR)[6]、主成分回歸法(PCR)[7]、人工神經網絡法(ANN)[8]、偏最小二乘法(PLS)、支持向量機法(SVM)[9]、最小二乘支持向量機(LS-SVM)[10]以及投影尋蹤回歸(PPR)等,在有機過氧化物研究領域中,MLR和SVM模型應用最多[11],主要用來預測有機過氧化物的自加速分解溫度(SADT)。
呂志果[12]、潘勇等[13]采用QSPR方法,分別建立PLS與GA-MLR(遺傳-多元線性回歸模型)預測有機過氧化物的SADT,研究顯示,兩種模型在SADT的預測方面均具有較好的穩定性及預測能力。游波[14]對比研究了MLR、PLS、SVM模型對有機過氧化物參數起始分解溫度T0和分解熱ΔH的預測能力,結果表明,模型預測精度順序依次為SVM>PLS>MLR,同時證明同種模型的預測精度與影響參數的因子個數有關,因子個數越少越精確。馬繼濤[15]通過有機過氧化物分子描述符(46種),建立了最佳多元線性回歸(B-MLR)和SVM模型,同時運用Williams圖,對模型的應用域進行分析,研究表明,兩種預測模型都可應用于有機過氧化物的SADT預測。
1.2.2 熱分析動力學法 熱分析是借助熱分析儀器,獲取實驗數據,結合相關理論對有機過氧化物的熱分解進行動力學和熱力學計算,獲得反應級數n、活化能Ea和指前因子A等反應動力學參數,由此判定其熱穩定性及危險性。
動力學研究比較多,已有多種熱分析動力學處理方法。目前熱分析方法還有等溫法和不等溫法,不等溫法按動力學方程形式分為微分法和積分法,其基本形式一般是基于Arrhenius方程計算;按加熱速率方式可分為單個掃描速率法和多重掃描速率法(等轉化率法)。在這些方法中,有機過氧化物的Ea、A值計算常采用等轉化率法[16],這歸因于等轉化率法的推算不涉及多種假設,完全基于實驗數據,可信度高。常用的等轉化率法有Friedman法、Ozawa法和Kissinger法等。
薛巖[17]采用Friedman法得到過氧化苯甲酸叔丁酯(tert-butyl peroxide benzoate,簡稱TBPB)的Ea及A隨轉化率的曲線,并得出Ea的范圍為42~135.5 kJ/mol,A的范圍為0.25~33.5。黃艷軍等[18]采用Friedman等轉化率法求得過氧化氫異丙苯(cumene hydroperoxide,簡稱CHP)在不同溫升速率下的Ea值,并得出在分解過程中,Ea介于52~91 kJ/mol之間。
田映韜[19]通過Friedman法、Ozawa法、ASTM E698方法對4種不同濃度的MEKP及純品MEKP、TBPB、2,5-二甲基-2,5-二(叔丁基過氧基)乙烷[2,5-dimethyl-2,5-di(tert-butylperoxy)hexane,簡稱DHBP]的差示掃描量熱儀(DSC)數據進行動力學分析,結果表明,3種方法所得4種不同濃度的MEKP的Ea取值基本一致,用3種方法計算3種純品過氧化物的Ea值大小順序為DHBP>TBPB>MEKP。方將來[20]在探究不同雜質對過氧化苯甲酰(benzoyl peroxide,簡稱BPO)的熱分解影響時,采用Kissinger法與Ozawa法計算純BPO的Ea值相似分別為213.88,209.42 kJ/mol,通過加和平均得出純BPO的Ea值,同理求出混合雜質時BPO的Ea值。
2 催化分解
2.1 金屬分解
錳、鐵、銅等金屬化合物在常溫下對有機過氧化物都具有較強的催化分解作用,特別是變價的過渡重金屬離子。羧酸過氧化物在金屬存在下的分解歷程見圖2[21],從羧酸的分解反應能夠看出,分解生成了活潑自由基,自由基又進一步促進反應。在整個分解過程中,金屬離子只發生價態的互相轉變,自身卻不會消耗,因此只需存在微量金屬離子,就會加速羧酸過氧化物的分解。
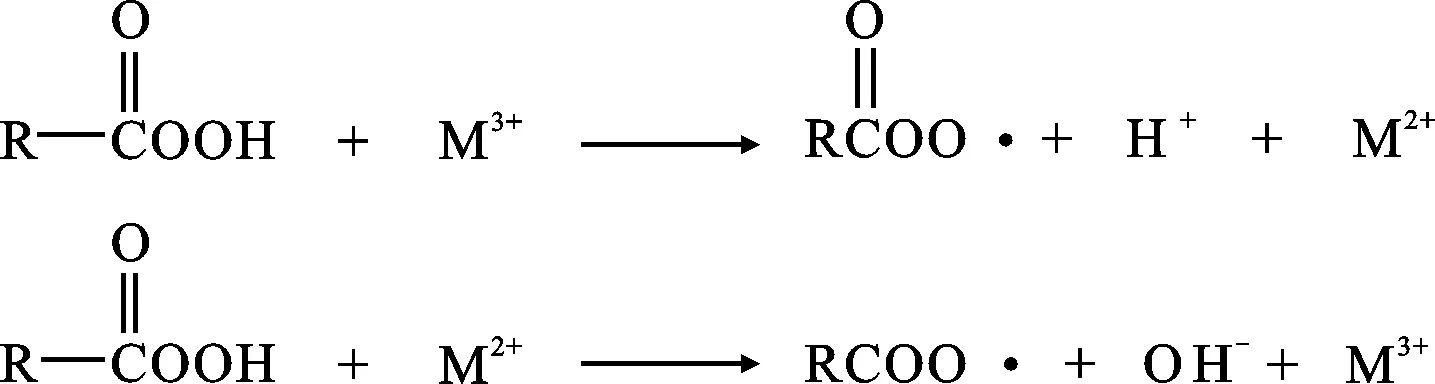
圖2 羧酸過氧化物的金屬分解機理Fig.2 Metal decomposition mechanism of carboxylic acid peroxide
Uchida等[22]首先用DSC研究了9種有機過氧化物分別在玻璃樣品池、不銹鋼樣品池和鍍金樣品池的熱分解反應,結果顯示鍍金樣品池對氫過氧化物的分解具有顯著的影響,在此基礎上該團隊采用C80微量量熱儀檢測分析了CHP、CHP與Au、CHP與Au2O3的等溫反應曲線,由放熱曲線可以明顯的看出,CHP與Au2O3在反應一開始就有極強的放熱峰出現,說明Au3+催化分解作用強烈,同時色譜結果顯示,不同金屬催化分解產物不同。
Ron-Hsin Chang等[23]則研究了FeSO4、FeCl3對MEKPO熱穩定性的影響,DSC和泄放面積組合儀(VSP2)數據分析可知,MEKPO與氯化鐵、亞硫酸鐵混合,起始放熱溫度均降低,放熱曲線均出現兩個明顯的放熱峰,表明鐵離子能促進MEKPO的分解,反應過程復雜。Wei Meng[24]使用自動壓力跟蹤絕熱量熱計(APTAC)檢測了不同濃度的Fe2O3對MEKPO的量熱分析,結果顯示,在低濃度下(<0.3%),MEKPO穩定性受Fe2O3的影響不大,然而,在中高濃度范圍(即10%)下,MEKPO的熱穩定性明顯下降。
Mei-Li You等[25]使用DSC研究了80% CHP與ZnBa2、CuBa2、FeBa2混合的熱分解反應,研究表明,加入金屬化合物,CHP的分解熱沒有明顯變化,但T0由105 ℃分別降低到95,75,74 ℃,Cu2+、Fe2+對CHP的穩定性影響較大;采用TAM III研究CHP分別在80,90,100,110 ℃等溫條件下與金屬化合物混合的反應,研究表明,在任何等溫條件下,CHP與FeBa2混合達到最大速率時間(TMRios)最短,時間在0.34~0.43 h之間,與ZnBa2的混合,在100,110 ℃時的TMRios分別為0.42,0.41 h。
2.2 酸堿分解
酸和堿都可加速有機過氧化物的分解,尤其是強酸強堿,原因是強堿釋放的氫氧根離子和強酸釋放的氫離子會攻擊有機過氧化物的過氧鍵(O—O),加速自由基的生成,釋放大量熱,有機過氧化物在強酸堿介質中,甚至發生歧化反應[26]。因此,酸性或堿性催化劑的存在也會增大有機過氧化物的危險性。如過氧化甲乙酮的酸催化反應機理[27]見圖3所示:
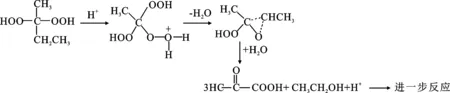
圖3 過氧化甲乙酮的酸分解機理Fig.3 Acid decomposition mechanism of methyl ethyl ketone peroxide
我國有機過氧化物的合成,多采用無機酸作為催化劑,這使得收集到的產物呈酸性,需要用堿中和至中性,中和不當(過量或少量)都會使有機過氧化物顯堿性或酸性,對有機過氧化物的穩定性存在安全隱患。Li等[27]采用微量量熱儀(C80D)研究了不同濃度(1%,3%和5%)的硫酸對MEKPO的影響,結果顯示,隨著H2SO4濃度的增加,MEKPO的穩定性顯著下降,T0接近環境溫度。Tseng等[28]通過熱反應檢測儀(TAMⅢ)檢測了純BPO與硫酸、氫氧化鈉混合的熱動力及熱危險參數,結果表明,BPO熱分解遵循自催化反應模式,H2SO4的加入會降低BPO的穩定性,相反,NaOH能夠提高BPO的穩定性。Chen等[29]利用DSC分別測試了80%的CHP、CHP(80%)與硫酸、氫氧化鈉混合時的熱分解過程,結果表明,當CHP分別與NaOH、H2SO4混合后,T0從80 ℃下降至40,53 ℃,說明CHP對氫氧化鈉更敏感。
Chou等[30]利用DSC探討了NaOH混入CHP后,T0從80 ℃下降至40 ℃,同時CHP的放熱峰從單峰變為雙峰,說明NaOH的加入會引發二次放熱反應,危險性更大。Hou等[31]用DCS在異丙苯溶液中測量了80%的CHP與NaOH、t-BuONa、KOH、LiOH和NH3(水溶液)的熱分解情況,由熱分解曲線和數據可以看出,CHP與OH-混合后,T0顯著降低,反應過程變得復雜,加劇了熱危害性并增加了傳遞CHP的危險風險。
Tseng等[32]則利用DSC研究了MEKPO與HNO3、NaNO3的混合反應危險性,發現HNO3會顯著提高MEKPO反應的危險性,而與NaNO3混合反應推遲,具有更高的穩定性。You等[33]使用DSC對95%的過氧化月桂酰(lauroyl peroxide,簡稱LPO)分別與1,2,6,12 mol/L的HNO3混合進行測試,結果顯示,LPO與硝酸混合發生強烈的放熱現象,12 mol/L HNO3在實驗過程中有非常強的二次放熱峰,表明發生二次劇烈反應,造成高度危害,并在分解產物中發現了爆炸性產物1-硝基十二烷。
近期,查飛課題組采用12-磷鎢酸[34]催化制備的有機過氧化物,也存在產物呈酸性的困擾。因此,有機過氧化物混合酸堿物質的風險較大,應引起有機過氧化物穩定性研究者的廣泛關注。
2.3 水分解
蔣慧靈等[35]利用絕熱加速量熱儀研究了TBPB在不同含水量條件下的放熱情況,研究表明,少量的水可以加速TBPB的分解,隨著含水量的增加,水的汽化吸收了反應系統的熱量而對反應有一定的冷卻和抑制作用。魏彤彤[36]研究了含30%水的BPO的熱分解過程,結果同樣顯示,水的加入提高了BPO的自加速分解溫度,并降低了熱分解的劇烈程度。
王傳虎[37]則研究了不同水質對過氧乙酸(PAA)的影響,檢測表明,不同水質配制的過氧乙酸中,雙蒸水的穩定性最好,去離子水、蒸餾水次之,地下水配制的穩定性最差,出現這種結果可能是與各種水中含有的不同的金屬離子和雜質有關。金滿平等[38]用C600微量量熱儀測試了水對CHP的影響,其結果表明,隨著水含量的增加,T0和最大放熱溫度(Tmax)呈U型曲線關系,混有20%左右含水量CHP的分解作用最明顯。
2.4 有機過氧化物/有機物分解
何潔[39]使用加速量熱儀(ARC)和快速篩選儀(RSD)探究了叔丁基過氧化氫(tert-butyl hydroperoxide,TBHP)分別與過氧化二叔丁基(DTBP)、BPO的混合熱危險性,結果顯示:TBHP和BPO的混合,出現了二次放熱峰,危險性比TBHP和DTBP混合高。Lin[40]采用差示掃描量熱法(DSC)探究了31%的MEKPO和99%的丙酮在3種加熱速率下的放熱情況,結果表明,丙酮可以提高MEKPO的Ea和T0,從反應的TMR圖和數據也可以看出,丙酮明顯降低了MEKPO的熱危險性。Liu S H等[41]采用DSC和TAMⅢ探究了純的BPO及與苯甲酸、苯、苯酚混合的熱分解情況,結果表明,3種有機物都會增加BPO的熱分解危險性。方將來等[20]探究了甲苯對BPO的熱分解過程和危險性,由T0、Ea可看出,甲苯對BPO的分解起促進作用。
不同有機過氧化物混合,穩定性與其自身因素有關,混合后的有機過氧化物的穩定性,比單一的低;與其他有機物混合,可促進有機過氧化物的分解(除MEKP與丙酮的混合,會提高MEKP的穩定性)。
3 其它分解因素
有機過氧化物的穩定性除了與混有的雜質有關外,還與物料層厚度、罐徑大小等因素有關。王慧欣[42]對DTBP的物料厚度展開研究,結果表明,物料層越厚,其SADT越低,越不利于存儲和運輸;黃艷軍[18]采用C80微量量熱儀探索了儲罐內徑對CHP穩定性的影響,結果顯示,儲罐內徑越大,SADT越低;江美麗等[43]研究表明,儲罐的壁厚及其內半徑對有機過氧化物的SADT也有一定的影響。
4 有機過氧化物的穩定劑
在儲運過程中,純的有機過氧化物易分解,因此在運輸和儲存有機過氧化物時需添加穩定劑,減敏性的稀釋劑成為首選。常用的稀釋穩定劑有硅酸鈉、8-羥基喹啉、碳酸鈣、焦磷酸鈉等,不同穩定劑對不同的有機過氧化物的作用效果不同,因此,不同有機過氧化物與稀釋穩定劑的相互匹配也隨之受到關注。王傳虎等[37]在186 g/L的過氧乙酸中加入不同的穩定劑(尿素、EDTA、水楊酸、磷酸、順丁烯二酸、8-羥基喹啉、焦磷酸鈉),并在常溫中儲存180 d后檢測,結果表明,8-羥基喹啉穩定作用最好,焦磷酸鈉次之。魏彤彤[44]借助ARC檢測了純的過氧化環己酮以及加入等質量的4種有機物(鄰苯二甲酸二辛酯、鄰苯二甲酸二丁酯、環己醇、正己酸)后的熱危險參數,結果顯示,鄰苯二甲酸二辛酯對過氧化環己酮的減敏效果最佳。
過氧乙酸(PAA)的稀釋穩定劑不易配伍,趙勇[45]篩選了8-羥基喹啉、焦磷酸鈉和自制的STB作為穩定劑,跟蹤檢測了在25 ℃日光照射條件下PAA的分解情況,結果顯示,3種穩定劑都大大提高了PAA的穩定性,其中自制的STB效果最佳,過氧乙酸的平均日分解不到0.07%,月分解為2.2%。
劉雄民[46]采用小型密閉壓力容器(MCPVT)跟蹤測試了BPO-H2O、DCP-CaCO3、DTBP-IPS(石蠟油)、TBPB-IPS四種有機過氧化物有無稀釋穩定劑的熱反應壓力效應,結果表明,揮發性的稀釋穩定劑使分解產生的最大壓力(Pmax)值增大,非揮發性的稀釋穩定劑則能降低Pmax,但兩類穩定劑均降低了熱分解速度。
5 結束語
有機過氧化物中的 —O—O—鍵長而弱,極不穩定,遇熱易分解,隨溫度升高,熱分解加劇。有機過氧化物的熱危險性研究手段主要是通過分解熱動力學,獲得動力學危險參數,其中QSPR法是一種有效的熱穩定性模型。
金屬、酸堿、水、有機物和有機過氧化物對有機過氧化物均具有催化分解能力,有機過氧化物在合成、運輸和儲存時可通過添加穩定劑和稀釋劑監督其分解,增加安全性。
未來有機過氧化物危險特性的研究,可從物質結構性質出發,通過建模分析來彌補實驗方法的不足,進一步減少事故發生。

