胸腔鏡肺段切除術治療I期非小細胞肺癌的近遠期療效觀察
王進,戚劍偉,火旭東,王文才
(東南大學附屬鹽城第三人民醫院胸外科,江蘇 鹽城 224000)
肺癌的發病率和死亡率居中國惡性腫瘤排行榜第1位,其中非小細胞肺癌(non-small cell lung cancer,NSCLC)作為肺癌的常見類型,占比達80%~90%,臨床表現為咳嗽、痰中帶血或咯血、胸痛、胸悶等非特異性癥狀[1]。隨著國民對肺癌防治意識的提高及影像學和內鏡檢查技術的不斷完善,越來越多的早期NSCLC被診出,為臨床治療和預后改善提供了重要條件。I期NSCLC患者病變范圍相對較小,病變未侵襲胸腔重要器官和未發生遠處轉移,及時接受手術切除治療可取得生存質量[2]。肺葉切除術+系統淋巴結清掃是目前公認治療早期NSCLC的“金標準”術式,隨著電視胸腔鏡手術的不斷完善和臨床推廣應用,胸腔鏡下肺葉切除(VATS)的手術療效值得肯定,美國國立綜合癌癥網絡(NCCN)頒發的癌癥指南也推薦VATS可作為早期NSCLC的標準術式[3]。隨著“微創外科理念”的深入發展和手術經驗的不斷積累,胸腔鏡下肺段切除術應運而生,手術原則是兼顧腫瘤根治效果和最大限度的保留健康肺組織,為患者創造術后快速康復的有利條件。但目前肺段切除術在臨床應用并不廣泛,和VATS術相比是否具有顯著優勢尚需大量研究論證。本研究旨在探討胸腔鏡下肺段切除術在I期NSCLC患者治療中的應用價值。現報告如下。
1 資料和方法
1.1 一般資料
共納入東南大學附屬鹽城第三人民醫院2014年3月至2016年3月收治85例I期NSCLC患者,根據接受的手術方式不同分為胸腔鏡下肺段切除術(n=39,肺段組)和肺葉切除術(n=46,肺葉組)。肺段組中,男性患者24例,女性15例;年齡46~72歲,中位年齡62歲;左肺23例,右肺16例;腺癌24例,鱗癌13例,其他2例;腫瘤直徑0.62~2.96 cm,平均(1.68±0.51)cm;IA期 21例,IB期18例。肺葉組中,男性28例,女性18例;年齡45~73歲,中位年齡62歲;左肺25例,右肺21例;腺癌29例,鱗癌14例,其他3例;腫瘤直徑0.64~2.95 cm,平均(1.69±0.53)cm;IA期 27例,IB期19例。
納入標準:經影像學、細胞學、組織病理活檢確診為I期NSCLC,功能狀態Karnofsky評分≥70分,具備手術切除機體條件,腫瘤直徑≤3 cm,保留完整的臨床及隨訪資料。排除標準:入組前有放化療治療史,胸部疾病手術史,合并心、肝、腎等器質性病變或其他惡性腫瘤者,肺葉或肺段切除術禁忌癥等。兩組NSCLC患者一般資料比較,差異均無統計學意義(P>0.05)。
1.2 方法
所有NSCLC患者手術均由本院具有≥3年胸腔鏡下肺葉或肺段切除術經驗的醫師操作,常規雙腔氣管插管全身麻醉,健側單肺通氣,取側臥位。按照常規“三孔法”操作步驟熟練設計觀察孔(長度1.0~1.5 cm)和主(長度2.0~3.0 cm)、輔助操作孔(長度1.0~2.0 cm)。肺葉組:即常規VATS步驟,先對病灶進行探查了解具體位置,手術醫師熟練行單向式肺葉切除和淋巴結清掃等操作,留置引流管后關閉胸腔。肺段組:探查病灶具體位置后解剖游離相應肺段和血管以及支氣管等組織,用直線切割縫合器切斷。切斷段支氣管前應先夾閉,通過麻醉師鼓肺和觀察病變肺段坍塌、萎縮表現,確定可切除肺段的邊界,切割縫合器處理段間裂并行淋巴結探查清掃,切緣距離≥2 cm。術中將肺葉間、段間淋巴結和切除的肺段送至病理檢查,若送檢淋巴結或肺段切除邊緣陽性,則改行系統性的肺門、肺葉切除術以及縱膈淋巴結清掃。兩組術后均給予常規抗生素預防感染,手術護理均相同等。
1.3 觀察指標
統計兩組NSCLC患者手術時間、術中出血量、淋巴結清掃、胸腔引流、住院時間、手術并發癥等圍手術期指標。分別于術前、術后2周采用德國耶格公司JAEGER MSDIFFU-SION肺功能儀檢測用力肺活量(FVC)、第1秒用力肺活量(FEV1)、最大通氣量(MVV)等肺功能指標。通過門診復查、電話隨訪、微信和上門拜訪等形式隨訪3年,記錄兩組無瘤生存率和總生存率。
1.4 統計學分析
選用SPSS 20.0軟件,并發癥率用[n(%)]表示,組間相較行χ2檢驗,其他圍手術期指標和肺功能指標為計量資料,組間相較行LSD-t檢驗,同組手術前后比較行重復測量方差分析,以P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者手術臨床指標比較
所有患者均成功完成手術,無中轉手術者,圍手術期無死亡病例。兩組在手術時間、術中出血量、淋巴結清掃個數方面比較,差異無統計學意義(P>0.05),但肺段組胸腔引流時間、引流總量以及住院時間均少于肺葉組,差異有統計學意義(P<0.05)。見表1。
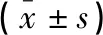
表1 兩組患者I期NSCLC患者手術臨床指標比較
2.2 兩組患者并發癥比較
肺段組術后僅出現肺漏氣和肺部感染各1例,無切口感染、胸腔積液和心房纖顫病例,并發癥率明顯低于肺葉組,差異有統計學意義(P<0.05)。見表2。
2.3 兩組患者手術前后肺功能比較
術后2周,兩組患者肺功能指標FVC、FEV1、MVV和術前比較明顯降低,且肺段組患者的FVC、FEV1、MVV均高于肺葉組,差異均有統計學意義(P<0.05)。見表3。
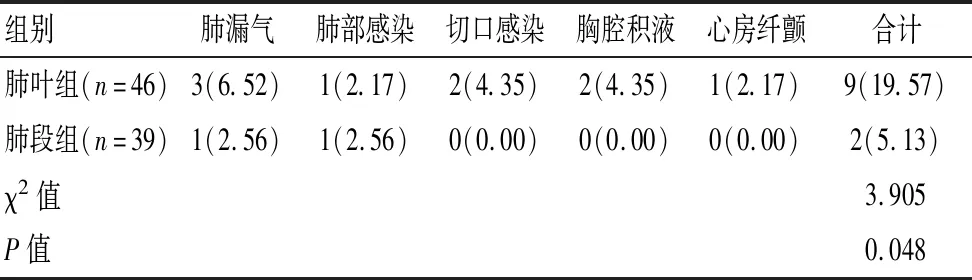
表2 兩組患者手術并發癥率比較[n(%)]
表3 兩組患者手術前后肺功能指標變化比較
*P<0.05,與本組術前肺功能指標比較。
2.4 兩組患者遠期療效比較
隨訪3年顯示,兩組患者無瘤生存率和總生存率均較為接近,差異無統計學意義(P>0.05),見表4。
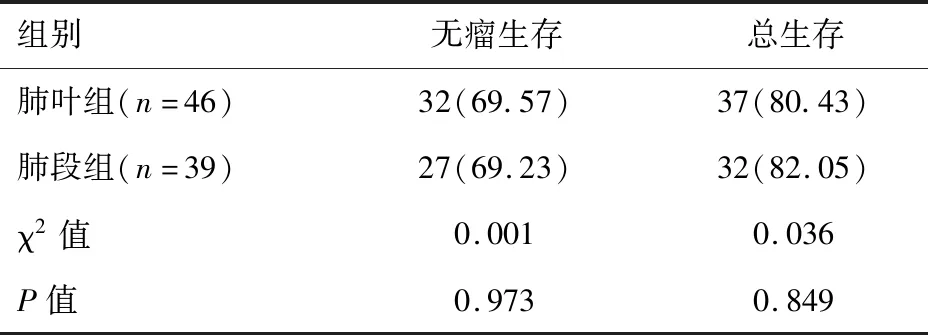
表4 兩組隨訪3年無瘤生存率、總生存率比較[n(%)]
3 討論
受我國人口基數龐大、吸煙和二手煙人群廣、人口老齡化進程加快等影響,我國肺癌發病率呈逐漸上漲趨勢,且老齡患者所占比重較大,造成嚴重的社會疾病負擔[4]。目前,早期肺癌胸已進入微創治療時代,腹腔鏡下肺葉切除術在臨床應用比較成熟,和傳統開胸根治術比較,具有手術微創、并發癥少和術后恢復快等優點,而且二者腫瘤根治效果基本相當[5-6]。但胸腔鏡下肺葉切除也存在些許不足,導致術后肺功能和生活質量下降明顯。而且NSCLC患者中,老年患者較多,此類患者多合并基礎疾病、機體生理功能退化和免疫力下降,手術耐受性和肺順應性降低,部分I期NSCLC老年患者甚至無法耐受VATS而失去最佳手術治療時機[7-8]。
近幾年,以肺段切除和楔形切除術為代表的肺部局限性切除術受到醫學界的高度重視[9],對于肺部惡性腫瘤(如NSCLC患者),肺段切除術和VATS的手術操作均屬于解剖切除,但肺段切除術具有胸腔引流時間、引流量和住院恢復情況明顯優于VATS,而且在手術時間、出血量、淋巴結清掃數量及3年、5年預后生存率方面并無明顯區別。最新NCCN發布的NSCLC臨床實踐指南指出,胸腔鏡下肺段切除術適用于早期NSCLC治療,尤其適用于I期無淋巴結和遠處轉移、心肺功能欠佳、高齡的NSCLC患者[10-11]。
本研究顯示,兩組患者均成功完成手術,無中轉和圍手術期死亡病例,在手術時間、出血量和淋巴結清掃方面接近,和文獻報道[12]存在一定差異。本研究發現肺段組手術時間明顯高于肺葉組,筆者認為這可能和患者個體差異、手術操作欠缺熟練等原因有關。肺段組在胸腔引流量、引流時間、住院時間和并發癥發生率方面均低于肺段組,這與武國棟等[13]研究結論相一致,體現出胸腔鏡下肺段切除能一定程度減輕手術創傷,促進患者手術康復和減少并發癥發生。肺功能檢測顯示,雖然兩組NSCLC患者受手術切除影響,術后FVC、FEV1、MVV均較術前明顯下降,但肺段組術中盡可能保留了健康肺組織和肺功能,有利于術后康復和改善生活質量。有研究發現,IA期NSCLC患者胸腔鏡下肺段切除術在術后3 d有明顯下降,但在術后3個月時接近恢復正常水平。另有報道[14]指出,與肺葉切除相比,肺段切除術的切除范圍小,肺葉膨脹代償作用較小,肺段切除后肺功能受支氣管角度變化的影響輕微,有利于保護肺功能。本研究認為肺段切除術對患者肺功能的保護作用是顯著優于肺葉切除術的。隨訪3年顯示,肺段組無瘤生存率和總生存率分別為69.23%、82.05%,和肺葉組的69.57%、80.43%基本持平,這與劉強[15]研究結論相似,也充分肯定了胸腔鏡下肺段切除的手術療效值得肯定。
目前,胸腔鏡下肺段切除術的適用證尚存在爭議,如2017年NCCN指南推薦腫瘤直徑方面認為應≤2 cm,腫瘤直徑越大則意味著腫瘤分期增加,轉移風險提高,肺段切除的根治概率下降,是患者術后復發、轉移和死亡的關鍵原因[16]。但臨床實際中,許多I期NSCLC患者腫瘤直徑>2 cm,在操作熟練情況下仍可采用此術式。疏楠等[17]對30例早期NSCLC、且腫瘤直徑≤5.0 cm的老年患者行胸腔鏡下肺段切除術,取得滿意手術療效,安全性較好。因此,熟練掌握此術式的操作要點,是擴大適應癥、確保良好手術效果的關鍵。本研究認為,胸腔鏡下肺段切除術有以下技術要點或難點需要重視:(1)腫瘤定位。對于病變位置較深、病變較小且質地無異常的毛玻璃樣結節(GGN),準確定位病變位置和切除范圍存在一定難度,這是需要不斷攻克的難點[18]。(2)把握切緣距離。胸腔鏡下肺段切除追求肺葉的某段或多段聯合切除,因此確定距離病變的切緣距離、確保切緣良性對預防復發尤為重要。目前對切緣距離尚存在爭議,本研究按照NCCN指南推薦肺段切除的切緣距離>2 cm,病理活檢均提示切緣良性。然而,理想的切緣距離仍需大量本探討,本研究認為病灶大小可能是影響切緣距離的重要因素[19]。
此外,目前關于胸腔鏡下肺段切除也有一些新進展,比如單孔胸腔鏡肺段切除術,但國內開展此技術的較少,適應證尚不明確,而且技術操作難度較高,尚需大量研究不斷完善[20]。
綜上,本研究指出胸腔鏡肺段切除術是目前臨床治療I期NSCLC肺癌的有效微創術式,相信經過不斷探索和完善,其應用價值會日益凸顯,讓更多早期NSCLC患者獲益。

