醫院生物等效性試驗過程中方案偏離的分析與改進
阮姝楠,吳旭東
藥物臨床試驗必須遵循《藥物臨床試驗質量管理規范》(GCP)原則、依從倫理委員會批準的試驗方案,任何有意或無意偏離或違反試驗方案的行為叫做方案偏離(Protocol deviation)或方案違背(Protocol violation)[1]。在生物等效性試驗實際實施過程中,應盡量避免或減少方案偏離的發生。因此,研究者及申辦方會制定各環節標準操作規程,建立完善的質量保障體系,涵蓋臨床試驗的全過程,以盡可能減少方案偏離的發生。本文在整理31個生物等效性試驗項目中發生方案偏離的基礎上,分析造成方案偏離現象的原因,并探討可能的解決對策。
1 資料與方法
查閱武漢市金銀潭醫院2018年5月至2019年5月開展的生物等效性試驗項目,統計項目中所涉及的方案偏離種類及受試者例次,分析各類方案偏離發生的原因并探討可能的對策。
2 結果
此次檢查武漢市金銀潭醫院生物等效性試驗31個,其中23個項目出現方案偏離,占項目總數的74.19%。本次31個項目,共涉及受試者1 651例,共發生532例次的方案偏離,見表1。
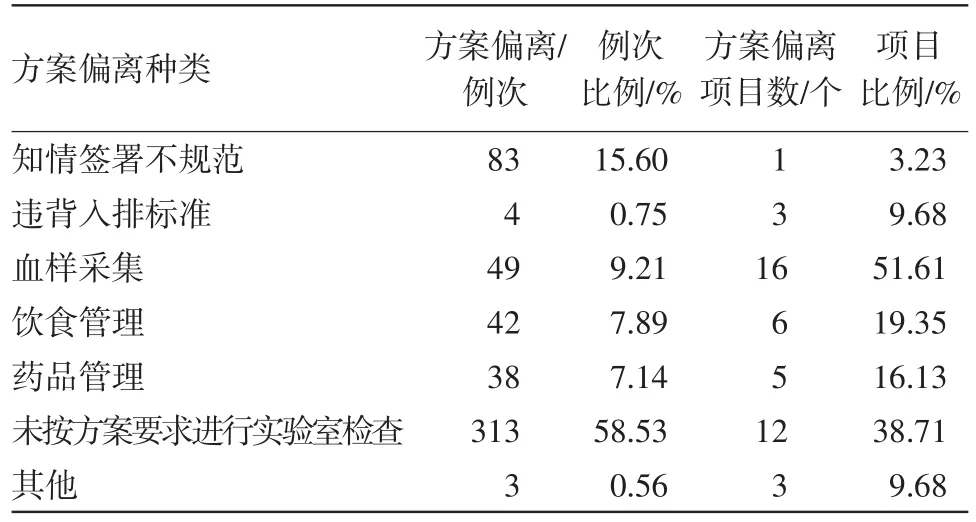
表1 方案偏離種類及數量統計
3 分析
3.1 偏離情況分析
3.1.1偏離情況 在本次抽查的31個生物等效性試驗中,有23個項目出現了方案偏離,占項目總數的74.19%。其中:
(1)與血樣采集相關的方案偏離發生的項目最多,占項目總數的51.61%,而此類又以采血事件超窗發生頻次最多,見表2。
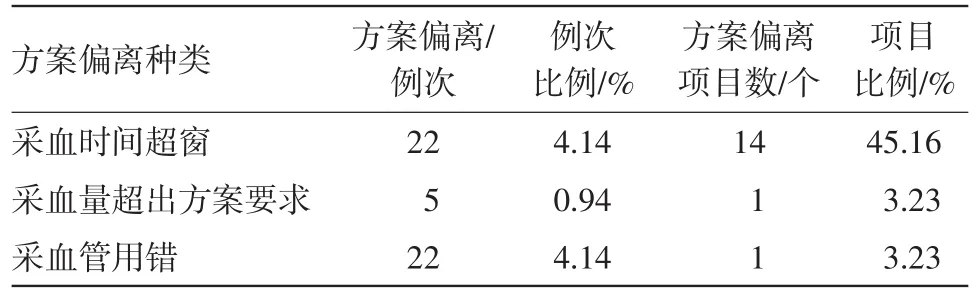
表2 血樣采集方面方案偏離數量統計
(2)其次發生項目數多的就是未按方案要求進行實驗室檢查,占比為38.71%,其中包括未按方案要求的時間進行檢查、研究者主動增加實驗室檢查項等,見表3。
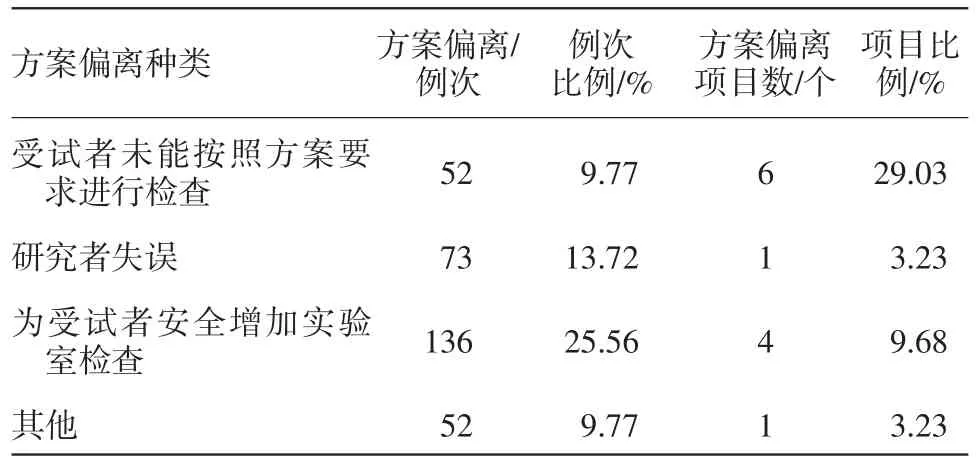
表3 未按方案要求進行實驗室檢查的偏離數量統計
(3)再次則為飲食管理相關的方案偏離,占比為19.35%。
3.1.2偏離情況分析 (1)血樣采集過程相關的方案偏離在生物等效性試驗中比較常見,尤其是在采血時間上超窗。因為天氣寒冷,或者受試者本身血管情況較細或較深,導致研究護士在采血過程中不能按照時間窗的要求進行采血。對于一般的生物等效性試驗,每名受試者單個采血點一般采血量在3~4 mL,在我中心出現過因研究護士未看清采血管刻度而多采0.5~1 mL血量的現象。
(2)另有一個項目,應使用EDTA-K3,但在采血管粘貼標簽準備過程中誤拿成EDTA-K2,導致22例受試者在采集給藥前空白血樣時采血管用錯,采集過程中研究者發現錯誤,在時間窗內及時更換采血管,雖未對試驗造成后果但致使22例受試者多采4 mL血樣,之后針對采血管的準備及核對進行了培訓,加強了CRC黏貼標簽過程中的核對及研究護士在采血前的相應審核,杜絕了此類問題的再次出現。
(3)飲食管理中的方案偏離主要是未遵守給藥后禁食10 h進食晚餐;或是因為方案要求受試者完全進食高脂餐,而受試者因牛奶灑出等原因導致食物不能完全吃下,但進食的總熱量滿足高脂餐的熱量要求故上報了方案偏離[2]。
3.1.3對方案偏離例次的分析 從方案偏離例次進行分析,發生例次最多的是未按方案要求進行實驗室檢查,占比為58.53%。這方面的方案偏離主要為:
①受試者未能按照方案進行實驗室檢查造成的方案偏離,如方案要求受試者在門診篩查當日及出組當日的規定時間留取大便樣本,但因受試者不能按時間要求留取,所以僅一個項目就出現45例次方案偏離;另有一常見現象為受試者未按研究者要求空腹進行體檢,造成方案偏離。
②研究者失誤,某項目中研究者遺漏開具甘油三酯的檢查,在監查過程中發現了此次問題后用遺留樣本進行了檢查,但超出了方案要求的時間,造成73例次受試者出現方案偏離。
③為受試者安全考慮而增加實驗室檢查。如,方案規定在受試者入組當天進行尿妊娠的檢查,而我中心研究醫生考慮因尿妊娠較血妊娠敏感度低且血中HCG是判斷懷孕的金標準[3],因此經與申辦方溝通后,在入組時加做方案未要求的血妊娠檢查。
④其他情況,在進行某項目時,測試手指血糖過程中,發現所有受試者血糖均偏高,在更換其他批次血糖試紙后,血糖測試正常,但測試時間超出了方案要求的時間,為避免此類情況再次發生,在需要使用血糖試紙前與實驗室血糖值進行校對。
此外,藥品管理也較容易發生方案偏離,藥品管理包括藥品接受、分發及儲存過程,具體偏離情況見表4。
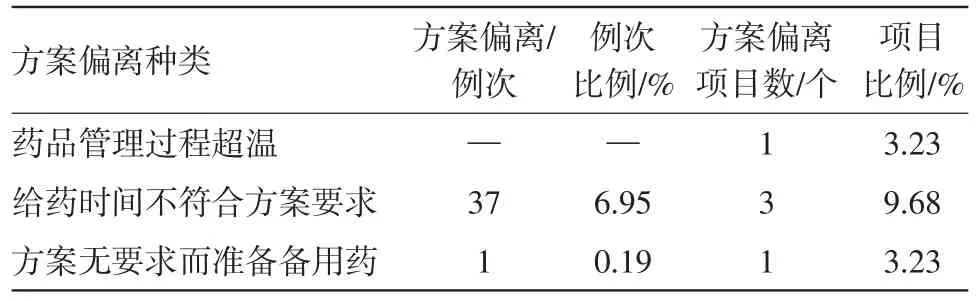
表4 藥品管理方面的偏離數量統計
藥品管理方面的方案偏離多發生在藥品發放環節。某項目中,方案規定受試者統一在8點進行給藥,但實際操作難以做到所有受試者同一時間給藥,而是依次完成給藥,造成方案偏離;另有項目規定在高脂餐后30 min準時進行給藥,而在給藥過程中,難免出現幾秒的誤差,造成共37例次的方案偏離。
其余的方案偏離情況見表5。
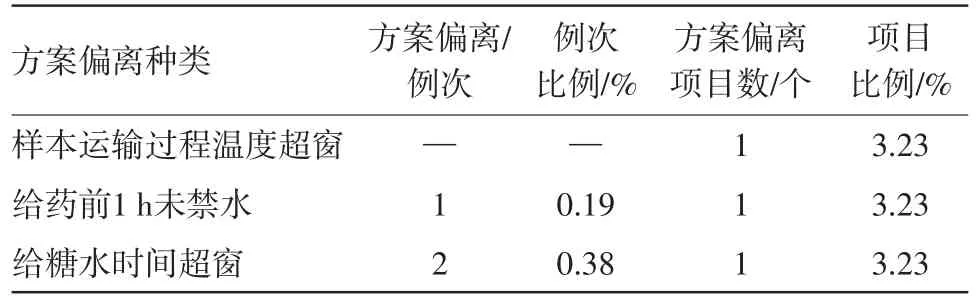
表5 其他方案偏離數量統計
3.2 偏離原因分析
3.2.1方案設計不合理 國家藥品監督管理局藥品審評中心已針對生物等效性試驗發布了包括《以藥動學參數為終點評價指標的化學藥物仿制藥人體生物等效性研究技術指導原則》在內的多個指導原則,規定了方案設計的基本要求。但申辦方或合同研究組織在方案撰寫過程中,依據一貫習慣而缺乏對研究中心的交流,導致描述不具體且脫離研究中心的實際,方案可執行性差,導致出現前文所述在實驗室檢查及藥品、飲食管理方面的方案偏離。
3.2.2研究者對試驗方案不熟悉,未能完全遵循方案 項目的進行需要所有研究者的配合,以及對試驗細節的關注。在試驗過程中,有研究者不能重視方案細節,造成工作疏漏,出現方案偏離。
3.2.3研究者與合同研究組織間的溝通不及時、合作契合度不高 生物等效性試驗需要申辦方、研究者、臨床監查員(CRA)與臨床研究協調員(CRC)的共同努力,及時的溝通必不可少,若溝通不利則容易出現各種問題。如,合同研究組織(CRO)在知情同意書版本升級后未及時告知研究者,且未打印新版知情同意書,導致受試者未簽署新版知情同意書。
3.2.4受試者依從性不佳 受試者是參與藥物臨床試驗的評價主體,受試者對試驗的依從性直接影響了試驗的質量。但是在試驗過程中,部分受試者不能完全的遵守試驗流程,如出組檢查要求受試者空腹檢查,但個別受試者未按要求進行完出組檢查便自行進餐,經研究者發現后進行其他檢查,造成進食后進行檢查的方案偏離。
3.2.5不可控因素 試驗過程也受到環境的多重影響。我中心出現過因項目中物流故障,發生樣本全部超溫而不能進行檢測而啟用備用檢測管的事故。
3.3 減少偏離的對策由于臨床試驗涉及環節較多,參與臨床試驗主體的差異,方案偏離情況往往難以避免。但過多的方案偏離有可能會影響受試者的權益、影響試驗的真實性和科學性,必須采取措施最大可能減少方案偏離的發生,尤其是對于項目中的可控因素,應避免發生方案偏離。
3.3.1優化方案設計 試驗設計應該盡量準確、詳盡,不產生歧義。尤其生物等效性項目多為單中心,可立項階段多與研究中心溝通,使方案符合臨床實際,既注重科學性,又兼顧可行性。
3.3.2加強項目培訓和溝通 確保在試驗開展之前所有的研究者得到培訓,尤其要強調試驗中的關鍵環節,和易錯點,使所有研究者包括臨床協調員充分熟知方案后進行相關的操作,避免因研究者的操作發生方案偏離。在項目啟動前,建立研究機構與項目方進行溝通的渠道,加強交流協作,避免因溝通不暢造成方案偏離。另外,由于目前合同研究組織存在人員流動大,水平層次不一的問題,在一個項目內部,監查員的內部溝通也是極其重要的,尤其是在有監查員離職的時候需要做好交接工作。
3.3.3建立質量控制體系 申辦方和機構均應建立完善的質量控制體系。針對項目中重點環節如入排標準的核對等,應建立雙人核對的制度;同時在項目執行過程中,具體工作責任到人,關鍵環節專人專崗。同時,在監查及內部質控過程,均應按照合同研究組織及機構的標準作業程序(SOP)嚴格執行,力爭在項目早期發現問題,解決問題。
3.3.4做好受試者的管理工作 受試者的依從性是保證試驗質量的重要一環。在進行知情同意和宣教的時候,做好受試者的教育管理工作,能更利于受試者配合試驗的流程,切勿因研究者的知情講解不到位,影響項目的進行。
4 討論
4.1 方案違背和方案偏離本文均以方案偏離進行統計。目前國際國內法規中對方案違背或方案偏離沒有明確的區分,《藥物臨床試驗倫理審查工作指導原則》中稱之為不依從/違背方案,定義為指對倫理委員會批準試驗方案的所有偏離,并且這種偏離沒有獲得倫理委員會的事先批準,或者不依從/違背人體受試者保護規定和倫理委員會要求的情況[4]。ICH GCP對方案違背和方案偏離并無明確定義,但強調研究者/研究機構應當依從由申辦者同意、管理當局(如有要求)批準,并已獲得倫理委員會批準的試驗方案。如沒有和申辦者達成一致并事先得到倫理委員會的審查和書面同意,研究者不能有任何偏離方案的行為,除非必須立即消除對受試者的傷害,或只是涉及事務上的或管理方面的變化(如監查員變更,電話號碼的變更)[5]。而NIH對方案偏離和方案違背有更加詳細的定義,指出方案違背(protocolviolation,PV)是在方案偏離(protocol deviation,PD)的基礎上,可能會影響到受試者的權益、健康,并使得試驗數據的準確性及可靠性受到影響[6]。筆者認為,方案偏離與方案違背的區別就在對試驗數據、對受試者權益及安全的影響。
在此次文件查閱中,筆者發現試驗過程中發生的方案偏離,大都比較輕微,與文獻的報道比較一致[1,7],部分方案偏離既不影響受試者的安全,也不影響試驗的數據,其中僅有4例次違背入排標注為方案違背,其余均為方案偏離。但是對于方案偏離的控制更能體現項目的質量。
4.2 方案偏離的管理對于PV的情況,任何人發現均應立即向倫理委員會提交報告,以便及時處理;對于PD的情況,一般可采取定期報告的方式。此外,為避免研究對受試者的即刻危險,研究者可在倫理委員會批準前,并獲得申辦方書面同意的情況下不依從方案,事后向倫理委員會提交報告[8],防止嚴重違反方案,使倫理委員會能夠及時介入,真正起到監督的作用。
除了向倫理委員會報告之外,發生如下情況下還須向政府藥品監督管理部門報告[9]。包括:①申辦者在臨床總結報告中要報告不依從方案的具體情況和詳細解釋;②申辦者獲知研究者/研究機構發生了重大的PV,中止其繼續參與試驗后,也須將詳細情況上報;③某些地區的藥品監督管理部門要求研究者就嚴重PV的情況進行上報。
國家食品藥品監督管理總局發布的《藥物臨床試驗的生物統計學指導原則》[10]認為,對于確證性試驗宜同時采用全分析集和符合方案集進行統計分析。當兩種數據集的分析結論一致時,可以增強試驗結果的可信性。當不一致時,應對其差異進行討論和解釋。所有進行隨機的受試者均能進入全分析集,違反隨機、入排標準等發生嚴重方案偏離的受試者不能進入符合方案集。總之,如果符合方案集被排除的受試者比例太大,將影響整個試驗的有效性。《藥物臨床試驗數據管理與統計分析的計劃和報告指導原則》[11]認為在統計分析報告中需根據依從性定義,報告各受試者完成試驗的情況,包括研究時間、藥物暴露時間、藥物使用量等情況,列表描述依從性差的受試者、依從性差的具體原因及進入分析數據集情況。
5 小結
在生物等效性試驗過程中,方案偏離發生是比較常見的。方案偏離發生的原因也各有不同,但大多是可以通過對試驗過程的管理而避免的。優化方案設計、加強研究者培訓和質控管理等可以減少方案偏離的發生。對于已發生的方案偏離,研究機構和申辦方均應努力做到及時處理,以減小對試驗的影響。

