絕經后骨質疏松癥及其合并代謝綜合征的研究
尹肖寒 張寧 楊芳 張瑞巖* 韓軍 王正平*
1.聊城大學生物制藥研究院,山東 聊城 252000 2.聊城市人民醫院臨床營養學實驗室,山東 聊城 252002
隨著國民經濟的飛速發展和人們生活方式的改變,人口老齡化日益明顯,中老年人的健康問題已引起廣泛重視。以往普遍認為骨質疏松癥(osteoporosis,OP)、2型糖尿病、脂代謝異常、高血壓這些常見病是相互獨立的疾病。但近幾年的研究發現,它們常并存于同一個體,并且病理生理機制類似。有研究表明代謝綜合征(metabolic syndrome,MS)是OP的獨立危險因素[1]。絕經后骨質疏松癥(postmenopausal osteoporosis,PMOP)是一種由多因素引起的與年齡相關的慢性退行性代謝性疾病。PMOP患者體內的雌激素水平下降,可以間接引起脂代謝異常和功能障礙。研究表明,臨床上大多數用于治療OP的藥物對血脂具有調節作用[2]。MS是一種包括中心性肥胖、高血壓、糖脂代謝異常等在內的臨床綜合征,與OP類似的是,它們都是多發于中老年人的慢性退行性病變,且發病率隨年齡增長呈顯著上升趨勢[3]。MS與PMOP二者關系密切,但既往相關研究較少,二者關聯機制尚未完全闡明。本研究旨在探究MS患者的高血壓、脂代謝異常等多種因素與PMOP的關系,從而為該類疾病和合并癥預防及治療提供新的理論依據。
1 資料與方法
1.1 研究對象
選取2017年3月至2018年1月在聊城大學營養中心和聊城市人民醫院體檢的絕經后婦女266例,包括N-PMOP患者共122例,平均年齡(60.02±9.17)歲;PMOP患者共144例,平均年齡(67.66±11.47)歲,依據代謝綜合征及骨質疏松癥的診斷標準[4-5]篩選出MS-PMOP患者共69例,未合并MS的PMOP的患者共75例。排除標準:①原發性或繼發性甲亢;嚴重缺乏鈣及維生素D;骨轉移或骨髓瘤等;②近半年內曾使用雙膦酸鹽、維生素D、鈣劑、雌激素、各種降脂藥或糖皮質激素、抗癲癇藥物等影響骨代謝的藥物;③有精神及認知障礙者,長期臥床者;④過早(≤40歲)絕經;⑤既往有椎體退變性或有脊柱或腰椎創傷等壓縮性、創傷性或脆性骨折病史。所有參與研究人員均知情同意并簽署知情同意書。
1.2 研究方法
1.2.1臨床資料收集:采用回顧性資料分析方法對研究對象進行問卷調查,詳實采集并記錄相關資料(包括年齡、現病史、既往史、婚育史、月經史、家族史等),通過標準儀器測量身高、體重和血壓,并計算體質量指數(body mass index,BMI)。
1.2.2血生化指標和骨密度檢測:抽取兩組研究對象晨起空腹外周血,室溫離心后提取血清,置于-20 ℃以備測定;采用全自動生化分析儀檢測空腹血糖(fasting plasma glucose,FPG)、三酰甘油(triglyceride,TG)、低密度脂蛋白(low density lipoprotein cholesterol,LDL-C)等。檢測嚴格按照操作標準進行。所有研究對象均使用雙能X線骨密度儀(DEXA)測定腰椎(L1-L4)、股骨干及全身骨密度,通過計算機程序得出T值。
1.3 診斷標準
1.3.1代謝綜合征診斷標準:中華醫學會糖尿病分會關于MS診斷標準[4]如下:同時滿足以下條件≥3條者,即可明確診斷。(1)超重和(或)肥胖(BMI≥25 kg/m2)。(2)糖尿病:FPG≥6.1 mmol/L及(或)餐后2 h血糖≥7.8 mmol/L以及(或)已確診為糖尿病;包括正在接受治療的患者。(3)高血壓:血壓≥140/90 mmHg和(或)已確診為高血壓;包括正在治療中的患者。(4)脂代謝紊亂:TG≥1.7 mmol/L和(或)高密度脂蛋白(high-density lipoprotein cholesterol,HDL-C)<1 mmol/L。
1.3.2骨質疏松癥診斷標準:根據2017年最新頒布的中國原發性骨質疏松癥診治指南,基于雙能X線檢測骨密度的診斷標準如下:T值≥-1 SD,則診斷為骨量正常;-2.5 SD≤T值<-1 SD,則診斷為骨量低下;T值<-2.5SD,則診斷為骨質疏松[5]。
1.4 統計學分析

2 結果
2.1 PMOP與N-PMOP患者一般資料及血生化指標比較
2.1.1PMOP與N-PMOP患者一般資料比較:將研究對象分為絕經后骨質疏松癥組(PMOP組)與絕經后非骨質疏松癥組(N-PMOP組)。其中,兩組的年齡差異有統計學意義(P<0.05),而兩組的身高、體重、BMI差異沒有統計學意義(P>0.05),詳見表1。
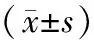
表1 PMOP與N-PMOP患者間一般資料比較 Table 1 Comparison of general characteristics between PMOP and N-PMOP
注:*代表在P<0.05層面上具有統計學意義。
2.1.2PMOP與N-PMOP患者血生化指標比較:PMOP組的收縮壓(systolic blood pressure,SBP)、舒張壓(diastolic blood pressure,DBP)、FPG、同型半胱氨酸(homocysteine,HCY)均值高于N-PMOP組,差異有統計學意義(P<0.05);并且PMOP組的HDL-C均值低于N-PMOP組,差異有統計學意義(P<0.05),詳見圖1~4。
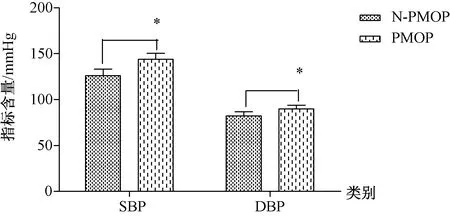
圖1 PMOP和N-PMOP兩組血壓差異性比較Fig.1 Comparison of differences in blood pressure between PMOP and N-PMOP groups

圖2 PMOP和N-PMOP兩組空腹血糖差異性比較Fig.2 Comparison of differences in FPG between PMOP and N-PMOP groups

圖3 PMOP和N-PMOP兩組脂代謝指標含量的差異性比較Fig.3 Comparison of differences in lipid metabolism index between PMOP and N-PMOP groups

圖4 PMOP和N-PMOP兩組同型半胱氨酸含量差異性比較Fig.4 Comparison of the difference in HCY content between PMOP and N-PMOP groups注:*代表在P<0.05層面上有統計學意義。
2.1.3PMOP患者的危險因素分析:以年齡、SBP、DBP、FPG、HDL-C及HCY為自變量,骨量為因變量,進行二元Logistic回歸分析。回歸方程為:骨質疏松=-46.209+0.368收縮壓+1.702空腹血糖+(-10.951)HDL-C。經分析,研究對象的SBP、FPG及HCY的增高都是合并MS的PMOP患者的危險因素。收縮壓、空腹血糖與PMOP呈正相關(P<0.05),其次,HDL-C與骨質疏松獨立負相關,均為其重要的危險因素。詳見表2。
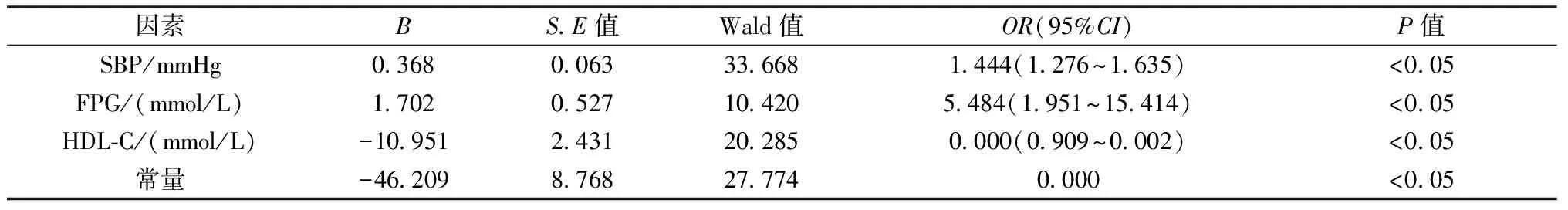
表2 PMOP患者的危險因素分析 Table 2 Risk factors analysis of PMOP patients
2.2 合并MS的PMOP患者與PMOP患者一般資料及血生化指標比較
2.2.1合并MS的PMOP患者與PMOP患者一般資料比較:依據MS診斷標準將PMOP組中患者分為合并MS的PMOP患者組(MS-PMOP組)和PMOP患者組(PMOP組)。經分析,PMOP組患者的年齡、身高均值高于MS-PMOP組,差異有統計學意義(P<0.05);而PMOP組患者的體重、BMI均值低于MS-PMOP組,差異有統計學意義(P<0.05),詳見表3。
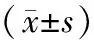
表3 合并MS的PMOP患者間一般資料比較Table 3 Comparison of general characteristics between MS and PMOP
注:P<0.05代表差異有統計學意義。
2.2.2合并MS的PMOP患者與PMOP患者血生化指標比較:經統計分析,PMOP組患者的DBP、FPG、HDL-C、HCY均值低于MS-PMOP組,差異有統計學意義(P<0.05),詳見圖5~8。

圖5 MS-PMOP與PMOP兩組血壓差異性比較Fig.5 Comparison of blood pressure between MS-PMOP and PMOP groups

圖6 MS-PMOP與PMOP空腹血差異性比較Fig.6 Comparison of FPG between MS-PMOP and PMOP groups

圖7 MS-PMOP與PMOP脂代謝指標含量差異性比較Fig.7 Comparison of lipid metabolism indicators between MS-PMOP and PMOP groups

圖8 MS-PMOP與PMOP同型半胱氨酸含量差異性比較Fig.8 Comparison of homocysteine content between MS-PMOP and PMOP groups注:*代表在P<0.05層面上具有統計學意義。
2.3 MS-PMOP患者骨密度的相關性分析
經分析,與MS-PMOP患者骨密度T值呈負相關的因素包括:年齡(r=-0.559,P<0.05)、收縮壓(r=-0.239,P<0.05)、舒張壓(r=-0.95,P<0.05)、FPG(r=-0.457,P<0.05)、LDL-C(r=-0.981,P<0.05)、HCY(r=-0.898,P<0.05);與骨密度T值呈正相關的因素為:HDL-C(r=0.951,P<0.05)、血清鈣(r=0.336,P<0.05)、血清磷(r=0.834,P<0.05)。詳見表4。
表4骨密度和各項指標的相關性分析
Table4Correlation analysis of bone mineral density and various indicators

項目r值P值年齡-0.559?<0.05身高0.0080.949體重-0.1180.334BMI-0.1570.199收縮壓-0.239?0.048舒張壓-0.950?<0.05FPG-0.457?<0.05HDL-C0.951?<0.05LDL-C-0.981?<0.05VLDL-C0.215<0.05鈣0.336?<0.05磷0.834?<0.05TG-0.0460.706HCY-0.898?<0.05
注:*代表在P<0.05層面上具有統計學意義。
3 討論
骨密度的變化與年齡密切相關,骨密度峰值可以預測OP發病率和骨量流失程度。在排除其他影響骨密度的前提下,人類骨密度達到骨峰值是在25~35歲[6]。骨密度峰值維持到50歲左右(相當于女性絕經期),隨后骨密度呈現逐漸下降趨勢。除此之外,絕經后女性骨脆性較男性高,更容易出現骨折。原因在于女性骨量流失是骨小梁斷裂,而男性的骨量流失是骨小梁微小結構退化。
已有研究表明,高血壓病與OP之間呈負相關[7]。這與本研究結果SBP、DBP與骨密度呈負相關(P<0.05)一致,可能發生的機制主要是:①高血壓患者甲狀旁腺激素分泌增多,刺激破骨細胞活性增強,導致骨量減少;②高血壓患者氧化應激過程增強[8]。除此之外,易云平等[9]研究結果顯示骨密度與空腹血糖沒有明顯相關性,而Lohmander等[10]的研究證實空腹血糖高常合并骨質疏松,這與本研究結果吻合,FPG與骨密度呈負相關(P<0.05)。由此可見,空腹血糖增高是骨質疏松的影響因素。國外相關文獻報道其機制可能為:體內胰島素分泌不足和機體對胰島素的低敏感性,導致骨基質膠原蛋白分解增加,降低了成骨細胞活性,從而引起骨質量的降低[10]。
除此之外,有研究證實,機體處于脂代謝異常狀態下,會引起骨髓基質細胞分化程度的改變,其向脂肪細胞分化增多,向成骨細胞的分化明顯減少,從而影響骨代謝[11]。本研究結果顯示,HDL-C、血清鈣、血清磷與骨密度呈正相關(P<0.05),LDL-C、HCY與骨密度T值呈負相關(P<0.05)。其中,HDL-C可以保護成骨細胞基質微環境免受脂質氧化的破壞,這種保護作用可能與體內清道夫受體SR-BI的表達增加相關[12]。而LDL-C水平升高則會引起脂質過氧化增強,破壞成骨細胞基質微環境。因此,PMOP患者更應該注意脂代謝血生化指標的監測,并且PMOP的發生與脂代謝異常是交互作用的復雜病理過程,進行基因位點的研究很有必要。既往研究表明較高水平的HCY會影響到機體的骨代謝,從而引起骨質疏松[13]。在這一點上和本研究結論相吻合。其對PMOP的影響機制主要是高HCY改變了血流動力學,從而影響到骨骼代謝,進而導致骨質疏松的發生[14]。
代謝綜合征和絕經后骨質疏松癥都是與年齡相關的慢性代謝性疾病,且發病機制較為復雜。目前,MS與PMOP的關系尚無明確定論,既往研究結果不盡相同[15-17]。本研究結果顯示,MS患者的SBP、FPG增高,HDL-C降低均是PMOP的危險因素。分析可能的發病機制是:MS患者的骨量丟失現象主要是由于MS的異常代謝狀態改變了與骨代謝相關的成骨、破骨細胞活性,骨密度失去平衡。
綜上所述,脂代謝異常、高同型半胱氨酸等都有可能會影響絕經后婦女骨代謝,加劇絕經后骨質疏松癥的發生;MS患者的SBP、FPG的增高,HDL-C的降低均是PMOP的危險因素,MS患者作為多種代謝異常的聚集體,是PMOP發生的高危人群。因此,合理控制血壓、血糖、血脂,定期監測代謝綜合征患者的骨密度水平及HCY等生化指標顯得尤為重要。

