荷芪散聯合非布司他治療高尿酸血癥伴胰島素抵抗的臨床研究
張卓, 趙恒俠, 劉媛, 周道成, 莊偉坤, 鄧玉秀, 陳宇陽
(1.廣州中醫藥大學第四臨床醫學院,廣東深圳 518033;2.深圳市中醫院內分泌科,廣東深圳 518033)
高尿酸血癥(hyperuricemia,HUA)是指在正常嘌呤飲食下,非同日兩次空腹血尿酸(UA)水平高于420μmol/L(不分性別)的一種嘌呤代謝障礙引起的代謝性疾病[1]。其臨床表現為體內尿酸產物增加和/或排泄減少,隨著血UA維持在高水平,除了可能引起痛風性關節炎,還與腎臟、內分泌代謝、胰島素抵抗(insulin resistance,IR)、心腦血管等系統疾病的發生和發展有關。IR引起血中胰島素及血糖升高,是糖耐量異常、2型糖尿病、痛風、原發性高血壓、脂代謝紊亂、肥胖等疾病的共同病理生理基礎[2]。目前已有大量研究證明高血UA與IR的相關性:HUA可能成為IR的獨立預測因素,IR也可能促進HUA的發生及進展。在IR狀態下,糖酵解過程的中間產物5-磷酸核糖及磷酸核糖焦磷酸轉移,導致血UA生成增多[3]。胰島素還能作用于腎小管,降低尿中UA的排出,導致血UA的排泄減少[4]。Krishnan E等[5]研究發現HUA患者出現IR的風險比無HUA者高1.36倍。Robles-Cervantes J A等[6]通過研究提出HUA增加胰島β細胞對胰島素的分泌可能是HUA導致IR的機制。隨著經濟的發展,人們生活水平的提高與生活方式的改變,近年來HUA患病率總體呈現增長趨勢,已成為第二大代謝性疾病[7-8],僅次于糖尿病。鑒于HUA并發癥的復雜性和嚴重性,西醫治療重點在于控制UA的同時并控制并發癥的惡化。雖然傳統的西藥可以較好地控制UA,緩解癥狀,但有些藥物作用機制尚不明確,且存在不同程度的副作用及不良反應。中醫藥干預本病強調養治并舉、病證結合、分期而治的原則,起到較好的防病治病作用。因此,本研究立足中西醫結合,以荷芪散加味聯合非布司他治療HUA伴IR患者,取得較為滿意的療效,現將研究結果報道如下。
1 對象與方法
1.1研究對象及分組選取2019年1月至2019年4月在深圳市中醫院住院部及門診接受治療的HUA伴IR患者,共42例,均為男性患者。采用隨機數字表將患者隨機分為對照組和觀察組,每組各21例。患者均簽署知情同意書,并通過本院倫理委員會審查批準。
1.2診斷標準
1.2.1 HUA診斷標準 根據中國HUA相關疾病診療多學科專家共識[1]:日常飲食下,非同日兩次空腹血UA水平>420μmol/L即可診斷為HUA。
1.2.2 IR的計算 評估IR用穩態模型評價胰島素抵抗指數(HOMA-IR)[9]和胰島素敏感指數(ISI)[10]。HOMA-IR計算公式:HOMA-IR=空腹胰島素(FINS,U/L)×空腹 血 糖(FPG,mmol/L)/22.5;HOMA-IR>2.69即為IR[11,12]。ISI計算公式:ISI=1/[FINS(U/L)×FPG(mmol/L)]。因其為非正態分布,故分析時取其自然對數即InISI。
1.2.3 中醫辨證標準 參照2008年中華中醫藥學會發布的《痛風和高尿酸血癥中華中醫藥學會標準》中的中醫證候診斷標準,屬于兼夾證中的痰濕瘀濁[13]。癥見:身體重著乏力,頭重或周身脹感,口臭、痰多、小便不利,大便黏臭不爽,身體肌肉或關節陣發刺痛,舌質暗紅有瘀斑,或舌下靜脈黑、暗,舌體胖大,舌苔厚膩,脈滑或澀。
1.3納入標準符合以上HUA及IR診斷標準,且中醫證型為痰濕瘀濁型,年齡20~60歲之間,能夠配合完成研究的患者。
1.4排除標準①繼發性HUA患者,如血液系統腫瘤、慢性腎功能不全、先天性代謝異常、中毒等因素引起的血UA水平升高,以及年齡<25歲、具有痛風家族史的HUA患者需排查遺傳性嘌呤代謝異常疾病;②伴有嚴重肝功能不全者;③合并有急慢性感染性疾病、自身免疫系統疾病者;④伴有精神障礙者;⑤治療前使用過對UA代謝及胰島素敏感性有影響的藥物(如胰島素、皮質醇激素、噻唑烷二酮類、血管緊張素轉換酶抑制劑、雙胍類、噻嗪類利尿劑等)者;⑥妊娠期或哺乳期婦女;⑦對本研究藥物過敏者;⑧伴有凝血功能障礙及活動性消化潰瘍出血者;⑨未取得知情同意者。
1.5治療方法
1.5.1 對照組 給予口服非布司他片治療。用法:非布司他片(江蘇萬邦藥物生化股份有限公司,批準文號:國藥準字H20130058)口服,每次40 mg,每天1次。
1.5.2 觀察組 在對照組基礎上給予荷芪散(趙恒俠教授臨床經驗方)加味治療。處方:黃芪30 g、荷葉30 g、何首烏15 g、決明子30 g、冬瓜皮30 g、石菖蒲10 g、蒼術10 g、山藥15 g、澤蘭15 g、甘草5 g。痛風性關節炎期加絡石藤15 g、雞血藤15 g、路路通15 g、威靈仙15 g、川牛膝15 g、焦山楂15 g。中藥材由深圳市中醫院中藥房提供,并由深圳市中醫院制劑室協助煎煮,上方每天1劑,以水650 mL,煎取250 mL,復煎兌汁,分早晚2次溫服。
1.5.3 注意事項及療程 入組患者均給予低嘌呤飲食(避免攝入高嘌呤食物,如動物內臟,以及控制肉類、海鮮和豆類等攝入)、低蛋白低脂飲食、多飲水、避免飲酒、健康教育、運動指導和規律鍛煉等。2組患者均經過3個月治療后進行療效評價,并隨訪3個月。
1.6觀察指標
1.6.1 中醫證候評分 對患者的身體重著乏力,頭重或周身脹感,口臭、痰多、小便不利,大便黏臭不爽,身體肌肉或關節陣發刺痛,舌質暗紅有瘀斑,或舌下靜脈黑、暗,舌體胖大,舌苔厚膩,脈滑或澀等中醫證候表現進行分級量化,按有或無和程度的輕重分為無、輕、中、重4級,分別計為0、1、2、3分。觀察2組患者治療前后中醫證候評分的變化情況。
1.6.2 生化指標檢測 全部患者分別于治療前后抽取空腹靜脈血,分離血清。采用葡萄糖氧化酶法測定空腹血糖(FPG);采用放射免疫法測定空腹胰島素(FINS);采用血液生化分析儀檢測2組患者治療前后血尿酸(UA)、血肌酐(Scr)、尿素(UREA)、C反應蛋白(CRP)水平的變化情況;并由專人測量腰圍,計算HOMA-IR和ISI。
1.7臨床療效評價標準參照文獻[14]。顯效:經過治療后患者血UA水平恢復正常,或較前降低≥25%,隨訪不用藥可維持3個月以上;有效:經過治療后患者血UA水平基本恢復正常,或較前降低≥15%,隨訪不用藥可維持1個月以上;無效:經過治療后患者血UA水平沒有改善,或較前降低<15%。總有效率=(顯效例數+有效例數)/總例數×100%。
1.8統計方法采用SPSS 13.0統計軟件進行數據的統計分析。計量資料用均數±標準差(s)表示,組內治療前后比較采用配對t檢驗,組間比較采用兩獨立樣本t檢驗。計數資料用率或百分比表示,組間比較采用χ2檢驗,等級資料組間比較采用秩和檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 2組患者的基線資料比較觀察組患者的平均年齡為(38.19±11.47)歲;平均病程為(5.62±4.18)年。對照組患者的平均年齡為(38.48±10.24)歲;平均病程為(5.10±4.05)年。2組患者的性別、年齡、病程等基線資料比較,差異均無統計學意義(P>0.05),具有可比性。
2.2 2組患者臨床療效比較表1結果顯示:治療3個月后,觀察組的總有效率為95.2%,對照組為81.0%,組間比較,觀察組的療效優于對照組,差異有統計學意義(P<0.05)。
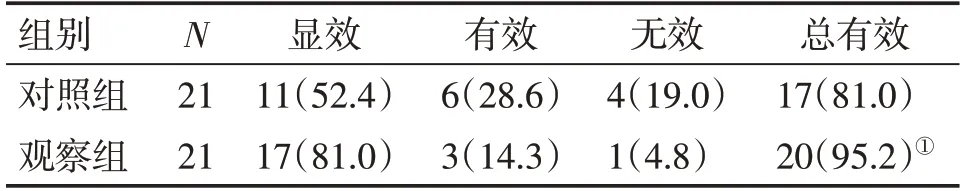
表1 2組患者臨床療效比較Table 1 Comparison of clinical efficacy of the two groups n(p/%)
2.3 2組患者治療前后中醫證候積分比較表2結果顯示:治療前,2組患者的中醫證候積分比較,差異無統計學意義(P>0.05);治療后,2組患者的中醫證候積分均較治療前明顯降低(P<0.01),且觀察組對中醫證候積分的降低作用明顯優于對照組,差異有統計學意義(P<0.05)。
表2 2組患者治療前后中醫證候積分比較Table 2 Comparison of TCM symptom scores of the two groups before and after treatment(s,s/分)

表2 2組患者治療前后中醫證候積分比較Table 2 Comparison of TCM symptom scores of the two groups before and after treatment(s,s/分)
①P<0.01,與治療前比較;②P<0.05,與對照組治療后比較
?
2.4 2組患者治療前后血生化指標比較表3結果顯示:治療前,2組患者血清UA、Scr、UREA和CRP水平比較,差異均無統計學意義(P>0.05);治療后,2組患者血清UA、Scr、CRP水平均明顯降低(P<0.05),且觀察組對血清UA、Scr、CRP水平的降低作用明顯優于對照組,差異均有統計學意義(P<0.05),而UREA水平2組治療前后及組間比較,差異均無統計學意義(P>0.05)。
表3 2組患者治療前后血生化指標變化比較Table 3 Comparison of blood biochemical parameters of the two groups before and after treatment (s)

表3 2組患者治療前后血生化指標變化比較Table 3 Comparison of blood biochemical parameters of the two groups before and after treatment (s)
①P<0.05,與治療前比較;②P<0.05,與對照組治療后比較
?
2.5 2組患者治療前后IR相關指標及腰圍變化比較表4結果顯示:治療前,2組患者IR相關指標FPG、FINS、HOMA-IR、InISI及腰圍比較,差異均無統計學意義(P>0.05);治療后,2組患者FPG、FINS、HOMA-IR均較治療前降低,InISI均較治療前升高(P<0.05),且觀察組對FPG、FINS、HOMA-IR的降低作用和對InISI的升高作用均優于對照組(P<0.05);腰圍方面,治療后,觀察組患者較治療前減小(P<0.05),而對照組變化不明顯(P>0.05),治療后組間比較,觀察組對腰圍的減小作用優于對照組,差異有統計學意義(P<0.05)。
2.6安全性評價2組患者治療前后血、尿、大便常規,肝功能及心電圖檢測均在正常范圍內。治療期間,對照組1例出現輕微腹瀉癥狀,經對癥處理后癥狀緩解。治療結束后,對全部患者進行3個月隨訪,均未見任何與治療藥物相關的不良反應。
3 討論
高尿酸血癥(HUA)與痛風在中醫學中應歸屬于“痹病”、“痛風”、“腳氣”等范疇。趙恒俠教授等[13]研究認為,HUA患者普遍存在痰濕瘀濁的病機證候,他們通過大量的臨床觀察發現HUA多見于40歲以上男性,以及飲酒過度、偏嗜膏粱厚味和甘美甜膩食品者,這種不良飲食和生活習慣,加之患者大多處于正氣漸衰的年齡階段,臟氣虛衰,臟腑功能失調,脾失健運則升清降濁無權,腎失氣化則分清泌濁失司,導致痰濁內生,滯留血中,不得泄利,日久瘀結,形成痰濕瘀濁的病理基礎,從而導致痰濕瘀濁閉阻經絡而發病。因此,本病應以化痰祛濕、化瘀散濁為主要治療原則,同時輔以健脾益腎、通利經絡之法。趙恒俠教授臨床經驗方荷芪散正有健脾補腎、化痰祛濕、化瘀散濁之功效。方中以荷葉、黃芪為君,荷葉健脾利濕、升發清陽,黃芪益氣健脾、利水消腫,二藥合用,共奏健脾利濕之功;冬瓜皮利水消腫,石菖蒲豁痰化濕,蒼術燥濕健脾,澤蘭活血利水消腫,四藥合用,祛濕化痰、活血化瘀;決明子潤腸通便;制何首烏補益肝腎、潤腸通便、化濁降脂;山藥針對脾腎兩虛,健脾補腎。故荷芪散正對HUA之痰濕瘀濁證。趙恒俠教授課題組前期研究[15-16]發現,荷芪散對于代謝綜合征及糖尿病患者的IR等代謝異常和內分泌紊亂有明顯改善作用,且可提高胰島素敏感性。痰濕瘀濁閉阻經絡,發為痛風時,隨證加用絡石藤、雞血藤、路路通、威靈仙、川牛膝以利濕通絡、祛瘀止痛,加焦山楂加強消食化濁、行氣散瘀。值得一提的是,有研究[17]證實威靈仙不僅能促進UA排泄,還能降低血BUN、Scr水平,減少腎小管間質尿酸鹽結晶沉積和炎性細胞浸潤。綜上所述,荷芪散加味集化痰祛濕、化瘀散濁、健脾益腎、通利經絡于一體,應用于臨床,對于HUA伴IR患者療效顯著。
表4 2組患者治療前后IR相關指標及腰圍變化比較Table 4 Comparison of insulin resistance related parameters and waist circumference of the two groups before and after treatment

表4 2組患者治療前后IR相關指標及腰圍變化比較Table 4 Comparison of insulin resistance related parameters and waist circumference of the two groups before and after treatment
①P<0.05,與治療前比較;②P<0.05,與對照組治療后比較
組別對照組腰圍(l/cm)87.10±5.68 86.70±3.31 87.14±4.52 76.47±4.66①②N觀察組21 21 21 21時間治療前治療后治療前治療后FPG[c/(mmol·L-1)]6.94±0.51 5.58±0.88①7.36±0.82 5.03±0.65①②FINS[J/(U·L-1)]43.15±3.36 20.96±2.38①42.56±3.73 13.80±2.45①②HOMA-IR 10.32±1.73 6.41±1.01①10.77±1.25 2.08±0.71①②InISI-5.75±0.10-4.90±0.11①-5.76±0.11-3.63±0.08①②
目前,我國HUA的發病率正在急劇上升,不同地區HUA的發病率為5.46%~19.30%[1]。高UA是細胞內的促氧化劑,通過誘導細胞的氧化應激、線粒體功能失調、炎癥反應和腎素—血管緊張素系統(RAS)的活化等機制導致內皮功能障礙、血管平滑肌增殖、間質炎癥浸潤等,UA及Scr、BUN無法排出而引發慢性腎臟疾病的發生和進展[18],嚴重影響患者的生活質量。高琳等[19]的研究已經明確證實,血UA濃度與IR關系密切,IR是HUA的獨立致病因素。IR在痛風患者中普遍存在[20]。腰圍反映了腹部皮下脂肪和內臟脂肪的聚集,而內臟脂肪的過度聚集以及其分泌的多種脂肪細胞因子,可介導IR等多種代謝異常[21]。非布司他為基于結構的黃嘌呤氧化酶抑制劑,其特殊結構阻斷了通往黃嘌呤氧化酶中心的通道,從而阻止了黃嘌呤氧化酶與其受體的結合,選擇性地抑制黃嘌呤氧化酶的活性從而減少UA的生成[22]。非布司他同時能夠減輕腎間質的炎性細胞浸潤,使尿酸性腎病早期纖維化得到有效緩解甚至逆轉[23]。此外,非布司他還能降低超敏C反應蛋白(Hs-CRP),改善機體微炎癥狀態,保護腎小管上皮細胞,從而對腎功能起到一定程度的保護作用,另外還能增加痛風患者的胰島素敏感性[24]。非布司他藥物安全性較高,可用于輕中度腎功能不全的患者,研究[25]表明,其不良反應與安慰劑組接近,主要是肝功能異常、腹瀉,而且不良反應較為輕微。在HUA的治療中,非布司他目前發揮著關鍵的作用[26],與其他治療痛風藥物比較有較好的應用前景。
總體而言,常規西藥治療HUA存在不同程度的副作用及不良反應,有些藥物作用機制尚不明確。中醫藥治療痛風及HUA近年來日益受到關注,某些中藥具有抗炎、鎮痛、活血、消腫和降低血UA的作用[27-28]。在本課題的研究中,通過觀察對比2組患者的臨床療效及相關指標的變化,表明荷芪散加味聯合非布司他不僅能夠進一步降低血UA,消除炎癥,改善腎功能,還可明顯改善HUA患者的IR狀態,降低不良反應,其療效明顯優于單用非布司他。

