IL-4 和IFN-γ 對COPD 患者肺成纖維細胞HIF-1α 和TGF-β1 表達的影響
曾慈梅 歐宗興 黃鄧高 沈 彬 王 蕾 馬西淼 曹 卉
1.中南大學湘雅醫學院附屬海口醫院呼吸內科,海南海口 570208;2.中南大學湘雅醫學院附屬海口醫院心胸外科,海南海口 570208;3.中南大學湘雅醫學院附屬海口醫院中心實驗室,海南海口 570208
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一種慢性肺部氣流受限的疾病,氣道重塑是COPD 重要的病理生理學改變[1]。γ 干擾素(interferon-γ,IFN-γ)和白細胞介素4(interleukin-4,IL-4)分別是CD4+T 細胞亞群Th1、Th2 最具代表性的細胞因子,可采用IFN-γ/IL-4 來表征Th1/Th2 亞群分布狀態[2];同時,COPD 患者血清中IFN-γ 和IL-4 水平的動態變化與COPD 病程密切相關[3]。近期的研究[4-5]表明IFN-γ 和IL-4 直接參與了COPD 相關的氣道和血管重構進程,但具體的機制不明。缺氧誘導因子1α(hypoxia inducible factors,HIF-1α)和轉化 生長因子β1(transferring growth factor β1,TGF-β1)在COPD 誘發的血管重塑過程中發揮了重要作用[6-8]。本研究擬評價IFN-γ 和IL-4 對COPD 患者肺成纖維細胞HIF-1α、TGF-β1 表達的影響,并結合患者臨床資料;初步探討IFN-γ 和IL-4 在COPD 患者氣道重塑中的作用,為治療COPD 提供新思路。
1 資料與方法
1.1 一般資料
收集2017 年12 月~2018 年8 月在中南大學湘雅醫學院海口附屬醫院胸外科因肺癌進行手術切除的正常肺組織(16 例)標本和肺癌合并COPD 患者(12 例)的肺組織切片標本。術前均征求患者同意,并記錄患者的年齡、性別、吸煙史和肺功能,并以肺功能為依據,根據全球慢性阻塞性肺疾病(GOLD2017)標準分級。排除標準:合并哮喘、支氣管擴張和間質性肺疾病等其他肺部疾病史者。
1.2 試劑與方法
重組人IL-4 和IFN-γ 購自R&D 公司;HIF-1α和TGF-β1 一抗購自Abcam 公司;β-actin 一抗和所有二抗購自中杉金橋公司;引物由生工生物工程股份有限公司合成。
1.3 COPD 患者肺成纖維細胞與正常肺成纖維細胞的原代培養
取1 cm3COPD 肺活檢組織,無菌磷酸緩沖鹽溶液(PBS)漂洗3 遍,剪碎組織塊成勻漿狀,取約1 mm3左右組織碎塊接種于24 孔板,待組織碎塊貼附后加入DMEM-10%FBS l mL 培養,每3~4 天換液,1~2 周左右可見組織碎塊周圍有成纖維細胞爬出,繼續培養至細胞融合成片鋪滿大部分容器底部,0.25%胰蛋白酶0.2 g/L EDTA 消化并轉移到25 mL 培養瓶,常規培養,1∶2 傳代,取第2~5 代細胞進行實驗。取1 cm3正常部位肺組織,參照“COPD 患者肺成纖維細胞原代培養”的方法進行操作。
1.4 qRT-PCR
TRIzolTMReagent(Invitrogene)提取細胞總RNA,取300 ng 總RNA 進行反轉錄制備cDNA,采用Takara公司的PrimeScriptTMRT Master Mix 試劑,反應體系和時間參照產品說明書進行;將反轉錄后的cDNA 稀釋10 倍進行qRT-PCR,采用Takara 公司的TB GreenTMPremix Ex TaqTMⅡ試劑,反應體系和時間參照產品說明書進行;使用Applied Biosystem 7500 Fast 系統進行實驗。引物序列如下:HIF-1α,上引物:5′-GCCAGATCTCGGCGAAGTAA-3′;下引物:5′-CCAGTTAGTTCAAACAGCATCCA-3′TGF-β1;上引物:5′-CTGTCCAACATGATCGTGCG-3′;下引物:5′-TGACACAGAGATCCGCAGTC-3′;β-actin,上引物:5′-AGACCTGTAC-GCCAACACAG-3′;下引物:5′-TTCTGCATCCTGTCGGCAAT-3′。采用2-△△Ct法計算mRNA 相對變化倍數。
1.5 Western blot
消化細胞,500 g/min 收集,加入適量體積RIPA裂解液,冰上裂解1 h,收集上清進行BCA 定量,調整上樣濃度,將蛋白樣品行10% SDS-PAGE 電泳,后電轉至PVDF 膜上,5% BSA 室溫封閉2 h,一抗4℃孵育過夜,二抗4℃孵育2 h,ECL 檢測。
1.6 統計學方法
采用SPSS 17.0 統計軟件對所得數據進行統計學分析。計量資料采用均數±標準差()表示,兩組均數間比較采用t 檢驗,相關性分析采用Pearson 直線相關法,以P <0.05 為差異有統計學意義。
2 結果
2.1 COPD 患者及正常肺成纖維細胞的原代培養
光鏡下可見肺組織塊周圍有成纖維細胞長出,伴隨上皮細胞、間皮細胞、內皮細胞或平滑肌細胞混雜,第三代肺成纖維細胞呈典型紡錘狀形態,貼壁良好。第四代肺成纖維細胞視野內已幾乎沒有其他細胞存在,生長狀態良好。收集細胞用流式細胞術進行鑒定,可見波形蛋白陽性細胞率達98%以上。見圖1。
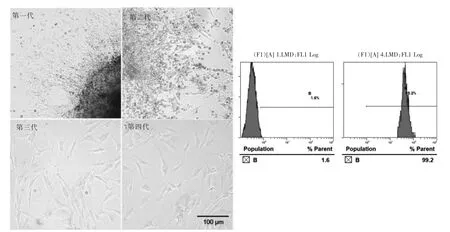
圖1 肺成纖維細胞的原代培養
2.2 HIF-1α 和TGF-β1 在COPD 患者肺成纖維細胞中的表達情況
與正常肺成纖維細胞比較,COPD 患者肺成纖維細胞中HIF-1α 的mRNA 平均上調2.5 倍左右(P <0.01);TGF-β1 的mRNA 平均上調2.2 倍左右(P <0.01)。見圖2。

圖2 HIF-1α 和TGF-β1 在COPD 患者肺成纖維細胞中的表達
2.3 IL-4 對正常肺成纖維細胞中HIF-1α 和TGF-β1生成的影響
用重組人IL-4(50 ng/mL)刺激正常肺成纖維細胞,結果顯示:IL-4 可引起肺成纖維細胞HIF-1α、TGF-β1 的mRNA 和蛋白表達升高(n=5,P <0.05),見圖3A~B,且IL-4 的作用時間與HIF-1α、TGF-β1的蛋白表達水平呈正相關(n=5,P <0.05)。見圖3C。
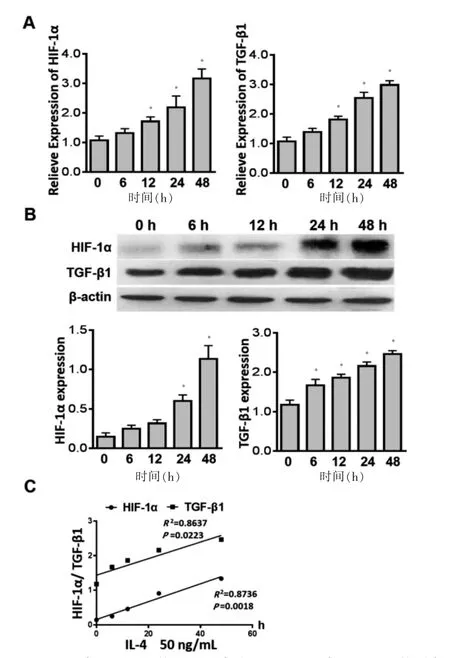
圖3 IL-4 對正常肺成纖維細胞HIF-1α 和TGF-β1生成影響(n=5)
2.4 IFN-γ 對正常肺成纖維細胞HIF-1α 和TGF-β1生成的影響
用重組人IFN-γ(50 ng/mL)刺激正常肺成纖維細胞,結果顯示:IFN-γ 可引起肺成纖維細胞HIF-1α、TGF-β1 的mRNA 和蛋白表達降低(n=5,P <0.05),見圖4A~B,且IFN-γ 的作用時間與HIF-1α、TGF-β1的蛋白表達水平呈負相關(n=5,P <0.05)。見圖4C。

圖4 IFN-γ 對正常肺成纖維細胞HIF-1α 和TGF-β1 生成的影響
3 討論
氣道重塑是COPD 重要的病理生理學改變[1]。目前已發現有50 多個細胞因子與COPD 的發生、發展有關[9]。IFN-γ 和IL-4 分別是CD4+T 細胞亞群Th1、Th2最具代表性的細胞因子,可采用IFN-γ/IL-4 來表征Th1/Th2 亞群分布狀態。Th1/Th2 細胞直接參與了COPD 的病理進程,而COPD 患者的Th1 細胞亞群向Th2 細胞亞群轉化是導致急性COPD 發作的重要誘因[10-13]。亦有研究報道IFN-γ 和IL-4 直接參與COPD誘發的氣道重塑,但具體機制不明。
COPD 患者以長期慢性低氧為特征,在肺血管重塑階段,較低的氧濃度可誘導HIF-1α 表達和活性增加[14],并可通過激活其下游分子直接參與COPD 氣道重塑過程。TGF-β1 是上皮-間質轉化(EMT)過程中重要的調控因子,可通過Smad 通路、ERK/MAPK、PI3K/AKT、Wnt 通路等多種途徑促使氣道上皮細胞損傷、間充質細胞增生,誘發氣道重塑和氣流受限[15-16]。結合近期的文獻報道[17-20]和IFN-γ、IL-4 在COPD 發生、發展進程中的重要作用,本課題組推測IFN-γ和IL-4可能會通過HIF-1α、TGF-β1 影響氣道重塑過程。
本研究中,以COPD 患者和正常肺成纖維細胞為研究對象,利用重組人IL-4 和IFN-γ 刺激肺成纖維細胞,模擬COPD 急性期和穩定期血清中IL-4/IFN-γ對肺成纖維細胞的影響。研究發現:HIF-1α 和TGFβ1 在COPD 患者肺成纖維細胞中高表達;IL-4 可促進正常肺成纖維細胞HIF-1α、TGF-β1 的生成,且IL-4 的作用時間與HIF-1α、TGF-β1 的蛋白表達水平呈正相關;IFN-γ 可抑制HIF-1α 和TGF-β1 的生成,IFN-γ 的作用時間與HIF-1α、TGF-β1 的蛋白表達水平呈負相關。上述結果提示在COPD 患者急性期,血清中高水平的IL-4 和低水平的IFN-γ 發揮協同作用,誘導肺成纖維細胞產生HIF-1α、TGF-β1,從而促進COPD 氣道重塑的發生。但IL-4/IFN-γ 調控肺成纖維細胞HIF-1α/TGF-β1 生成的作用機制仍不清楚,相關調控網絡需要進一步闡明。

