脫氫表雄酮對早發性卵巢功能不全不孕癥女性卵巢儲備功能的影響
趙小衛 韓偉 孟雪梅 冉約曼
早發性卵巢功能不全(premature ovarian insufficiency,POI)是引起女性不孕癥的病因之一,發生于40歲以前,主要表現為卵巢儲備功能減退,以月經紊亂(如停經或稀發月經)伴有高促性腺激素和低雌激素為特征[1],其發病率約為1%[2]。改善POI不孕癥患者的卵巢儲備功能是生殖醫學領域的焦點之一,激素替代治療(hormonereplacementtherapy,HRT)是育齡期 POI患者的推薦治療方案[3],可顯著改善患者卵巢功能[4]。卵巢儲備功能是指卵巢皮質區卵泡生長、發育,并形成可受精的卵母細胞的能力,此能力取決于卵巢內庫存卵泡的數量和質量[5]。血清抗苗勒管激素(anti Mullerian hormone,AMH)、基礎促卵泡生成素(basic follicle stimulating hormone,bFSH)、竇卵泡數(antral follicle counting,AFC)、基礎雌二醇(basic estradiol,bE2)、卵巢總體積(total ovarian volume,TOV)是預測卵巢儲備功能的標志性指標[6]。脫氫表雄酮(dehydroepiandrosterone,DHEA)作為雌雄激素合成的前體,是卵巢合成甾體激素的必要底物,可提高卵泡內甾體激素濃度[7],改善卵巢對促性腺激素的反應性,在卵泡生長發育、成熟等過程中均具有重要作用,但DHEA對卵巢儲備功能的影響至今仍未能完全闡明。本研究旨在觀察DHEA對POI不孕癥患者卵巢儲備功能指標的影響,并評價藥物使用安全性。
1 對象和方法
1.1 對象 本次臨床研究為回顧性病例對照研究,選擇2017年1月至2018年4月在本院就診的POI患者84例。
1.2 診斷標準 診斷標準參照2016年歐洲人類生殖與胚胎學會(European Society of Human Reproduction and Embryology,ESHRE)的 POI診療指南[1]及 POI的臨床診療中國專家共識[2],具體為:(1)年齡<40 歲;(2)月經稀發或停經4個月及以上;(3)至少2次血清促卵泡生成素(follicle stimulating hormone,FSH)>25U/L(間隔>4周)。
1.3 納入標準及排除標準 納入標準:(1)符合POI診斷標準;(2)至少2次血清25U/L≤FSH<40U/L(間隔>4周)。排除標準:(1)合并有心、肝、腎等其他重要臟器的器質性疾病;(2)合并精神疾患,不能配合治療;(3)治療前3個月經周期內或治療同時使用其他激素類藥物;(4)存在激素使用高風險或禁忌證,不適宜激素治療者。
1.4 治療方法和分組 將服用復合包裝雌二醇/雌二醇地屈孕酮片(商品名:芬嗎通;規格:2mg/10mg×28片;荷蘭Abbott Biologicals B.V.公司)的42例患者作為對照組,將同時服用復合包裝雌二醇/雌二醇地屈孕酮片(商品名、規格及生產廠家同對照組)和DHEA片(規格:75mg×60片;美國ESMOND公司)的42例患者作為治療組。治療方案為月經周期(或撤藥性出血)第3天起,對照組患者服用復合包裝雌二醇/雌二醇地屈孕酮片,1片/次,1次/d;治療組則同時服用DHEA片,75mg/次,1次/d,兩組均連續治療3個序貫周期。兩組患者年齡、體重指數、月經類型(月經稀發、閉經)比較無統計學差異(均P>0.05),具有可比性,見表1。
表1 兩組患者一般資料比較
1.5 觀察指標與檢測方法
1.5.1 有效性指標 兩組患者治療前及治療3個周期后,于月經來潮(或撤藥性出血)第3天抽取靜脈血,以ELISA法檢測AMH、bFSH、bE2水平,并行婦科彩超檢測AFC、TOV。比較兩組患者治療前后上述指標值。
1.5.2 安全性指標 兩組患者治療前后均空腹抽取靜脈血,送檢至我院檢驗科,以全自動生化檢測儀檢測。比較兩組患者治療前后谷丙轉氨酶(ALT)、谷草轉氨酶(AST)和血尿素氮(BUN)、血肌酐(SCr)水平改變情況。
1.6 統計學處理 應用SPSS 21.0統計軟件。正態分布的計量資料以表示。計量資料方差齊者組內治療前后比較采用配對樣本t檢驗,組間比較采用獨立樣本t檢驗;非正態分布或方差不齊者,兩組間比較采用Mann-WhitneyU檢驗分析。計數資料組間比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者治療前后卵巢儲備功能指標比較 見表2。

表2 兩組患者治療前后卵巢儲備功能指標比較
由表2可見,兩組患者治療前AMH、AFC、TOV比較均無統計學差異(均P>0.05)。治療后兩組患者AMH水平均高于治療前,差異均有統計學意義(均P<0.01);治療后治療組AMH水平高于對照組,但差異無統計學意義(P>0.05)。治療后治療組AFC顯著高于治療前(P<0.01),對照組AFC略高于治療前,但差異無統計學意義(P>0.05);治療后治療組AFC高于對照組(P<0.05)。兩組患者治療前后TOV差異均無統計學意義(P>0.05)。治療前兩組患者bFSH、bE2水平差異無統計學意義(P>0.05)。治療后兩組患者bFSH水平均低于治療前,差異有統計學意義(均P<0.01),bE2水平均高于治療前(均P<0.01)。治療后治療組bFSH水平顯著低于對照組,差異有統計學意義(P<0.01);bE2水平兩組間差異無統計學意義(P>0.05)。
2.2 兩組患者治療肝、腎功能比較 見表3。
由表3可見,兩組患者治療前后ALT、AST與BUN、SCr比較,差異均無統計學意義(均P>0.05)。
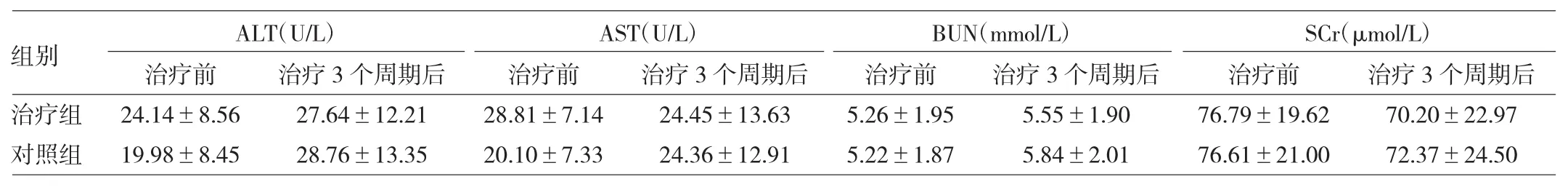
表3 兩組患者治療肝、腎功能比較
3 討論
POI由卵巢早衰(premature ovarian failure,POF)演變而來,POF指女性40歲以前出現閉經以及圍絕經期癥狀,伴有FSH水平升高(FSH>40U/L)、雌激素水平降低等內分泌異常。ESHRE的診斷標準為停經或月經稀發4個月,間隔>4周連續兩次FSH>25U/L;國際絕經協會(International Menopause Society,IMS)的診斷閾值FSH>40U/L。我國中華醫學會婦產科學分會絕經學組專家共識沿用的是ESHRE的診斷閾值,將疾病的診斷標準“關口前移”。但POF概念存在局限性,僅能代表卵巢功能衰竭的終末階段,無法體現疾病的進展性和多樣性,2008年美國生殖醫學會(American Society for Reproductive Medicine,ASRM)提出了“原發性卵巢功能不全”的概念,2016年ESHRE將POF更改為POI,并發布了相關診療指南。
POI病因有遺傳因素、感染、手術損傷等,還有部分患者原因不明,遺傳因素主要有某些性染色體缺陷及常染色體基因缺陷、Turner綜合征、先天性性腺發育不良等,而自身免疫功能紊亂、感染或醫源性因素等也可導致POI發生,還有50%的患者POI病因不明確[8]。
育齡期女性卵巢儲備功能的評估對生育能力的保存具有重要意義。POI患者40歲以前出現卵巢功能衰退,主要表現為卵巢儲備功能不同程度地減退,促性腺激素水平增高。POI嚴重損害女性生殖健康,是輔助生殖技術尚未攻克的難題之一,研究發現,患者血清AMH水平每年下降5.6%,AFC每年下降4.4%,TOV每年縮小1.1%[9-10]。POI的發病機制尚不明確,目前尚無有效的方法恢復卵巢功能。
HRT是針對POI的一線療法,但HRT各種藥物長期口服或局部應用的全身安全性,以及修復卵巢儲備功能的效果尚無更多證據。POI的非激素治療如中藥治療、針灸治療等臨床證據非常有限[11-13],尚不能作為HRT的替代方案,僅作為輔助治療或暫時性的替代治療。
DHEA是腎上腺源性雄激素的主要來源,是合成卵巢甾體激素的重要前體。DHEA可促進卵巢泡膜細胞、顆粒細胞合成雌激素,有利于提高卵巢對下丘腦-垂體生殖軸促性腺激素刺激的反應性,促進優勢卵泡發育成熟,改善卵母細胞質量。DHEA在體外受精-胚胎移植等輔助生殖技術中應用廣泛,主要用于改善卵巢功能低下或卵巢儲備減退的不孕癥患者卵母細胞質量及數量。
研究顯示,補充DHEA可顯著減低卵巢動脈搏動指數(pulsatility index,PI)、阻力指數(resistance index,RI)和動脈血流收縮期峰值的流速/舒張期低值的流速(systolic/diastolic,S/D)值,并提高收縮期最大血流速度(peak systolic velocity,PSV)值,通過降低血管阻力,改善卵巢血供,發揮促生育作用[14-15]。本研究在HRT的基礎上聯合DHEA治療,結果發現,治療后兩組患者bFSH水平顯著降低,AMH、bE2水平顯著升高,而且治療后治療組bFSH水平顯著低于對照組,而AFC顯著高于對照組。
綜上所述,本研究發現DHEA能夠改善POI不孕癥患者的卵巢儲備功能,其機制與提高AMH、AFC、bE2,降低bFSH水平有關,同時未發現DHEA引起相關肝腎功能損傷,但本研究為單中心研究,納入樣本量相對較小,研究人群較為單一,因此存在一定的局限性。
因此,后期需要大規模多中心臨床研究以及體內外實驗研究進一步探索DHEA改善卵巢功能的具體分子機制,為早發性卵巢功能不全不孕癥的臨床治療提供實驗依據。

