TET1蛋白對乳腺癌細胞株MDA-MB-453增殖的影響
陳舒穎 廖明 楊麗娜

【摘要】 目的 探討TET1蛋白對乳腺癌細胞株MDA-MB-453增殖的影響。方法 將TET1的穩轉細胞株(MDA-MB-453-TET1)和其陰性對照組穩轉細胞株(MDA-MB-453-NC)通過慢病毒載體構建出來, 采用RNA的反轉錄(RT)-聚合酶鏈式反應(PCR)及蛋白質免疫印跡(Western blot)法檢測TET1的表達情況。細胞增殖實驗(CCK-8法)檢測細胞增殖;Western blot檢測上皮間充質轉化(EMT)相關蛋白[上皮細胞鈣粘蛋白(E-cadherin)、N-鈣粘蛋白(N-cadherin)、波形蛋白(Vimentin)、β-鏈蛋白(β-catenin)]的呈現。結果 陰性對照組與空白對照組E-cadherin、N-cadherin、Vimentin、β-catenin、TET1 mRNA及TET1表達水平比較, 差異均無統計學意義(P>0.05)。MDA-MB-453-TET1組E-cadherin(2.98±0.11)、TET1 mRNA(5.36±0.02)及TET1(12.3±0.41)均顯著高于陰性對照組的(0.98±0.21)、(1.25±0.08)、(4.21±0.09)與空白對照組的(0.95±0.2)、(1.23±0.04)、(4.19±0.10), N-cadherin(0.08±0.02)、Vimentin(4.41±0.18)、β-catenin(0.05±0.002)均低于陰性對照組的(0.10±0.01)、(9.98±0.52)、(0.11±0.02)與空白對照組的(0.11±0.02)、(9.97±0.45)、(1.23±0.04), 差異均有統計學意義(P<0.05)。陰性對照組與空白對照組OD值比較, 差異無統計學意義(P>0.05)。MDA-MB-453-TET1組OD值低于陰性對照組與空白對照組, 差異有統計學意義(P<0.05)。結論 TET1可抑制MDA-MB-453細胞增殖, 其機制可能與通過Wnt/β-catenin通路抑制EMT的發生相關。
【關鍵詞】 乳腺癌;細胞株MDA-MB-453;TET1蛋白;細胞增殖
DOI:10.14163/j.cnki.11-5547/r.2019.28.113
TET蛋白是存在于生物體內的一種雙加氧酶, 其不但能使5-甲基胞嘧啶轉變為5-羥甲基胞嘧啶, 同時還是DNA去甲基化過程中必不可少的一種酶, 這種酶在保持干細胞的多能性時也有著相當重要的用處[1]。該家族主要包括3種蛋白酶, 即TET1、TET2和TET3, 其中TET1蛋白參與腫瘤的增殖及侵襲轉移過程[2]。通過體外實驗研究TET1對乳腺癌細胞增殖能力的影響, 為研究乳腺癌的發生提供一定的參考。
1 材料與方法
1. 1 試劑 人乳腺癌細胞株MDA-MB-453與人胚腎HEK 293T慢病毒包裝細胞(深圳市百恩維生物科技有限公司提供);DMEM培養液(武漢普諾賽生命科技有限公司提供);胎牛血清(武漢普諾賽生命科技有限公司提供);Ⅱ型膠原酶(上海玉博生物科技有限公司提供);胰蛋白酶及基質膠與Mdivi-1(上海玉博生物科技有限公司提供);兔抗E-cadherin、N-cadherin、Vimentin、β-catenin一抗、羊抗兔熒光二抗、羊抗鼠熒光二抗均購自美國Sigma公司。
1. 2 方法 根據慢病毒的包裝試劑外殼的使用說明來操作, 把轉染的293T細胞培育72 h, 然后將培育中的清液收集起來, 即是慢病毒液。然后把感染靶細胞(MDA-MB-453)用嘌呤霉素做一次詳細的挑選, 從中取得MDA-MB-453-TET1組和陰性對照組(MDA-MB-453-NC);最后用未感染的細胞作為空白對照組。三組分別選取2×106個細胞進行分析, 對三組細胞進行增殖實驗。
按照TET1試劑盒說明書進行操作。制備電泳膠, 將電泳膠放入電泳槽, 在聚合酶鏈式反應(PCR)熱循環儀中將其逆轉錄為互補脫氧核糖核酸(cDNA)。甘油醛-3-磷酸脫氫酶(GAPDH)為內參, 上游5'-GAAGTCACCCGCGTGCTAAT-3', 下游5'-TCACTGCTCCCGAATGTCT-3';TET1上游5'-GTGTGATGAGCCCAAGGA-3', 下游5'-GCAGTTGGCTCGCATCATAG-3'。PCR反應條件:在95℃10 min, 95℃50 s, 52℃50 s, 72℃3 min, 重復37個循環, 72℃延伸反應20 min, 計算TET1信使RNA(mRNA)水平相對表達量。
提取細胞總蛋白, 然后作十二烷基硫酸鈉(SDS)-聚丙烯酰胺凝膠電泳(PAGE), 再轉膜, 在其中添加對應一抗, 以4℃的溫度放置一晚。第2天進行含0.05%吐溫-20的磷酸鹽緩沖液(PBST)漂洗, 加入二抗, 室溫孵育2 h, 增強化學發光法(ECL)顯色, 計算蛋白水平的相對表達量。
將對數生長期細胞, 按1×103個細胞的量加入到96孔板里面, 放入CCK-8后進行細胞培養, 時間的設定為0、12、24、36和72 h, 根據時間長短的排序依次放入CCK-8試劑10 μl/孔, 37℃、5%CO2細胞培養箱中過夜培養;酶標儀上檢測各孔450 nm處的光密度(OD)值。這一實驗過程最少要進行3次以上, 然后根據實驗結果對實驗數據作統計學分析和研究。
1. 3 觀察指標 比較三組RT-PCR及Western blot法檢測結果以及細胞增殖能力檢測結果。
1. 4 統計學方法 采用SPSS19.0統計學軟件對數據進行統計分析。所獲數據均符合正態分布規律, 計量資料以均數±標準差( x-±s)表示, 采用t檢驗;計數資料以率(%)表示, 采用χ2檢驗。P<0.05表示差異具有統計學意義。
2 結果
2. 1 三組RT-PCR及Western blot法檢測結果比較 陰性對照組與空白對照組E-cadherin、N-cadherin、Vimentin、β-catenin、TET1 mRNA及TET1表達水平比較, 差異均無統計學意義(P>0.05)。MDA-MB-453-TET1組E-cadherin、TET1 mRNA及TET1表達水平均顯著高于陰性對照組與空白對照組, N-cadherin、Vimentin、β-catenin表達水平均低于陰性對照組與空白對照組, 差異均有統計學意義(P<0.05)。見表1。
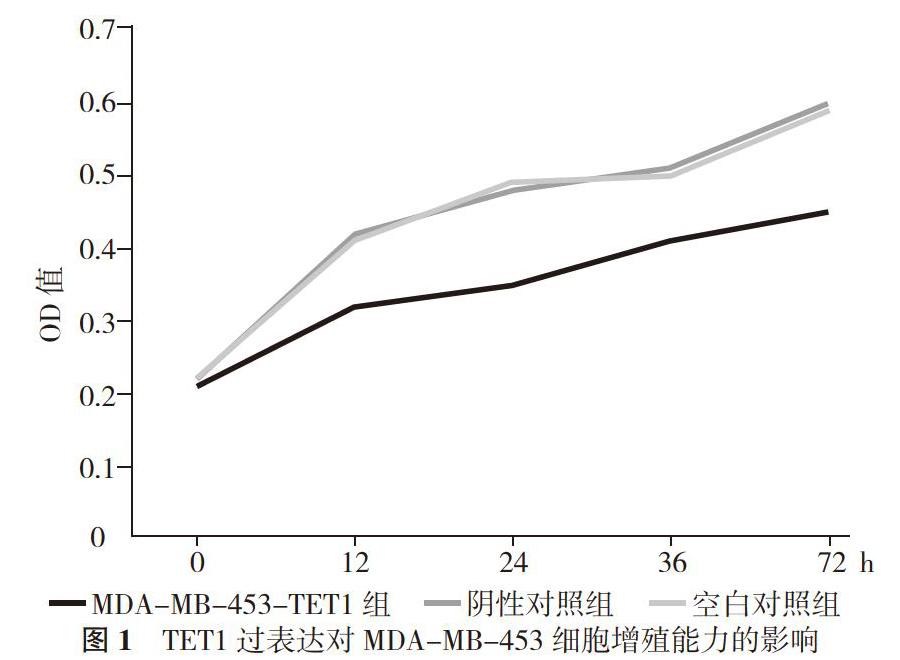
2. 2 三組細胞增殖能力檢測結果比較 陰性對照組與空白對照組OD值比較, 差異無統計學意義(P>0.05)。MDA-MB-453-TET1組OD值低于陰性對照組與空白對照組, 差異有統計學意義(P<0.05)。
3 討論
研究表明[3], TET1可以調控DNA去甲基化, 參與腫瘤的侵襲和轉移。EMT可導致腫瘤細胞離開原發部位, 經過血液循環或淋巴循環移動到其他地方。在這個過程中, 腫瘤細胞得到了間質細胞才有的遷徙能力, 這是由于腫瘤細胞的上皮型標志物E-cadherin的表達呈下降趨勢, 間質型標志物Vimentin和N-cadherin的表達呈上升狀態而導致的。大量研究表明, E-cadherin的啟動子區域有超甲基化這一現象, 這也被視作是引起E-cadherin表達呈下降趨勢的一大主要影響因素。TET1經過調整EMT相關蛋白的表達來影響乳腺癌的侵襲和移動[4-6]。
本研究中TET1在MDA-MB-453-TET1組出現高表達, 陰性對照組與空白對照組出現低表達, 說明MDA-MB-453-TET1的構建比較成功。MDA-MB-453-TET1細胞中E-cadherin表現是一種高表達, N-cadherin、Vimentin、β-catenin表現是一種低表達。實驗表明, TET1能經過調節EMT影響乳腺癌的侵襲和移動, 然后經過推進乳腺癌細胞向上皮樣表型轉化, 提高E-cadherin的表達增強細胞間的黏附能力, 最終使N-cadherin、Vimentin和β-catenin減少, 從而抑制EMT發生。CCK-8法進行檢測乳腺癌細胞株增殖能力實驗中, 在接種細胞24、36、72 h后MDA-MB-453-TET1組的細胞生長速度明顯減慢。說明TET1的過表達抑制乳腺癌MDA-MB-453細胞的增殖。
綜上所述, TET1可抑制MDA-MB-453細胞增殖, 其機制可能與通過EMT相關蛋白通路抑制EMT的發生相關。
參考文獻
[1] 段紅潔, 張愛民, 牛秀瓏, 等. IFN-γ和IL-4對人乳腺癌細胞系MCF-7成瘤性、黏附能力的影響及其機制. 中國腫瘤生物治療雜志, 2015, 22(5):597-602.
[2] Chen HF, Wu KJ. Epigenetics, TET proteins, and hypoxia in epithelial-mesenchymal transition and tumorigenesis. BioMedicine(Taipei), 2016, 6(1):1-8.
[3] Huang Y, Chavez L, Chang X, et al. Distinct roles of the methylcytosine oxidases Tet1 and Tet2 in mouse embryonic stem cells. Proc Natl Acad Sci USA, 2014, 111(4):1361-1366.
[4] 張萌萌, 李雅琪, 張碩, 等. TET1蛋白對人乳腺癌MDA-MB-231細胞株增殖和侵襲能力的影響及其相關機制. 腫瘤防治研究, 2017, 44(7):447-453.
[5] Jeschke J, Collignon E, Fuks F. Portraits of TET-mediated DNA hydroxymethylation in cancer. Curr Opin Genet Dev, 2016, 36(36):16-26.
[6] Yang H, Liu Y, Bai F, et al. Tumor development is associated with decrease of TET gene expression and 5-methylcytosine hydroxylation. Oncogene, 2013, 32(5):663-669.
[收稿日期:2019-03-06]

