DKK1通過抑制MMP2、MMP9的表達影響人小細胞肺癌SBC-5細胞的增殖和侵襲能力的研究
陳文娟,雷光焰,趙 征,雷寶霞,韓 樂*
(陜西省腫瘤醫院 1.內三科;2.胸外科,陜西 西安710061)
2018年全球癌癥統計顯示:肺癌的發病率和死亡率均居惡性腫瘤首位[1]。小細胞肺癌(Small cell lung cancer,SCLC)約占肺癌發病率的14%,具有高度侵襲性,約60%患者就診時已是廣泛期[2]。約70%的患者對標準一線化療反應較好,但不可避免的復發,二線治療有效率有限,2年的總生存小于5%[3,4]。免疫檢測點抑制劑在SCLC治療中仍在探索階段[5]。因此,深入研究SCLC發生發展分子機制至關重要。
DKK1是Wnt信號通路的負向調控因子,與多種腫瘤的發生發展相關[6]。MMP2和MMP9是基質金屬蛋白酶(matrix metalloproteinases,MMPs)家族成員,在腫瘤轉移和侵襲過程有重要作用。結合文獻報道及小細胞肺癌的特征,猜測DKK1和MMPs可能與小細胞肺癌的發生發展有相關性。為進一步證實,本課題組采用慢病毒感染的方法穩定下調SBC-5細胞中DKK1的表達,觀察下調DKK1表達對SBC-5細胞增殖和侵襲能力的影響,并對分子機制進行初步探討。
1 材料與方法
1.1 材料人小細胞肺癌SBC-5細胞株凍存于實驗室液氮罐、PCR引物由上海生工設計合成、DKK1、MMP2和MMP9抗體(兔抗人)購自Abcam 公司、β-actin(鼠抗人)抗體購自Sigma 公司、慢病毒由吉凱公司合成,其余常用試劑及儀器為實驗室備用。
1.2 細胞培養SBC-5細胞復蘇、重懸,于37 ℃、5% CO2孵箱中培養,常規消化傳代,擴大培養,后續實驗取對數生長期的細胞。
1.3 構建DKK1表達下調的SBC-5細胞株處理細胞,調整密度為1×104/ml,6孔版每孔加入2 ml細胞懸液,培養24 h,密度達20%且狀態良好時換為無血清培養基,取DKK1過表達慢病毒及相應對照病毒,分別在含有Polybrene的ENi.S感染液中進行感染。基因靶序列:GAACCACCTTGTCTTCAAA。感染24 h更換成完全培養基,72 h觀察細胞形態及綠色熒光的比例,大于80%提示感染成功。擴大培養,加入1 μg/ml嘌呤霉素篩選1周。
1.4 RT-PCR和Western-bloting方法鑒定SBC-5-DKK1-siRNA細胞株構建成功① RT-PCR: 按照操作步驟進行RNA提取,測定濃度和純度。進行反轉錄和熒光定量PCR,β-actin作為內參,2-ΔΔCT法計算結果。② Western-bloting:冰上裂解細胞30分鐘,提總蛋白,定量并制備蛋白樣品;SDS-聚丙烯酰胺凝膠電泳,濕轉法轉膜,5%BSA室溫封閉1 h,1×TBST 洗滌3次,每次15 min,BSA稀釋的1∶2000 DKK1和1∶ 8000 β-actin一抗4℃過夜雜交,洗滌方法同上,1∶2000稀釋的二抗室溫雜交1 h,同上洗滌;ECL顯影、曝光。
1.5 平板克隆形成實驗細胞密度調整為2×103/ml,6孔版每孔100 μl細胞懸液,培養液補至2 ml,常規培養。肉眼可見克隆形成時終止培養,預冷PBS洗3次,甲醇固定15 min,結晶紫染液染色20 min,自來水沖洗,空氣干燥。肉眼計數可見克隆數,計算克隆形成率:克隆形成率(%)=(克隆數/接種細胞數)×100%。重復3次。
1.6 Transwell細胞侵襲實驗用Matrigel基質膠包被Transwell小室基底膜,室溫風干;無血清培養基重懸細胞,密度調整為5×104/ml,取200 μl/孔加入含8 μm孔徑膜的Transwell上室,下室加入500 μl完全培養基,培養24 h。拿出小室,淋洗及染色步驟同平板克隆實驗,計數穿過微孔膜的細胞數,隨機取10個視野,取平均值。重復3次。
1.7 Western-bloting法檢測MMP2和MMP9蛋白的表達實驗步驟同上所述。一抗為1∶2000 MMP2、MMP9和1∶ 8000 β-actin。
1.8 統計學方法采用SPSS24.0統計學軟件進行t檢驗,P<0.05為差異具有統計學意義。
2 結果
2.1 下調DKK1表達的SBC-5-DKK1-siRNA細胞株的構建
感染72 h觀察兩組細胞熒光率大于80%(圖1),且形態良好,提示感染成功。
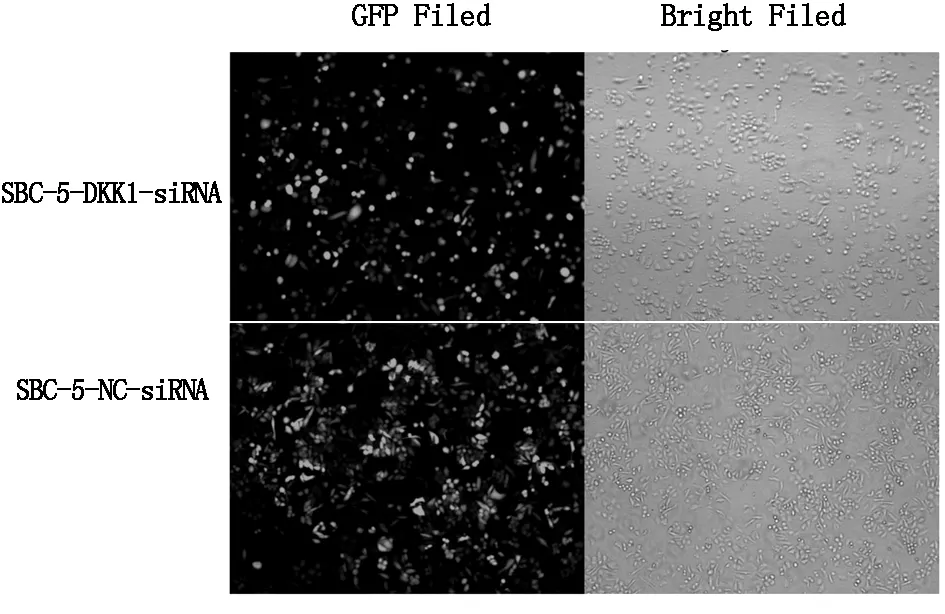
圖1 倒置熒光顯微觀察慢病毒感染SBC-5細胞后兩組細胞的形態及熒光,可見感染效率大于80%
2.2 下調DKK1表達的SBC-5-DKK1-siRNA細胞株的鑒定
RT-PCR和Western-bloting方法驗證感染效率。結果提示:實驗組中DKK1的mRNA和蛋白表達水平均顯著低于對照組細胞(圖2A,B)。
2.3 平板克隆形成實驗
計數兩組細胞克隆形成的數目,計算克隆形成率,結果顯示:實驗組為(0.11±0.01),低于對照組(0.20±0.01),差異具有統計學意義(P=0.0097)(圖3A,B)。
2.4 Transwell 實驗檢測細胞的侵襲能力
計數穿過小室基底膜的細胞數:每高倍視野(×200)下實驗組穿過基底膜細胞數為58.67±6.01,對照組為158± 6.56(圖4A,B),兩組間差異均具有統計學意義(P=0.0059) 。
2.5 Western-bloting檢測兩組細胞中MMP2和MMP9蛋白表達差異結果顯示:與對照組相比,實驗組MMP2和MMP9蛋白的表達均被抑制(圖5)。
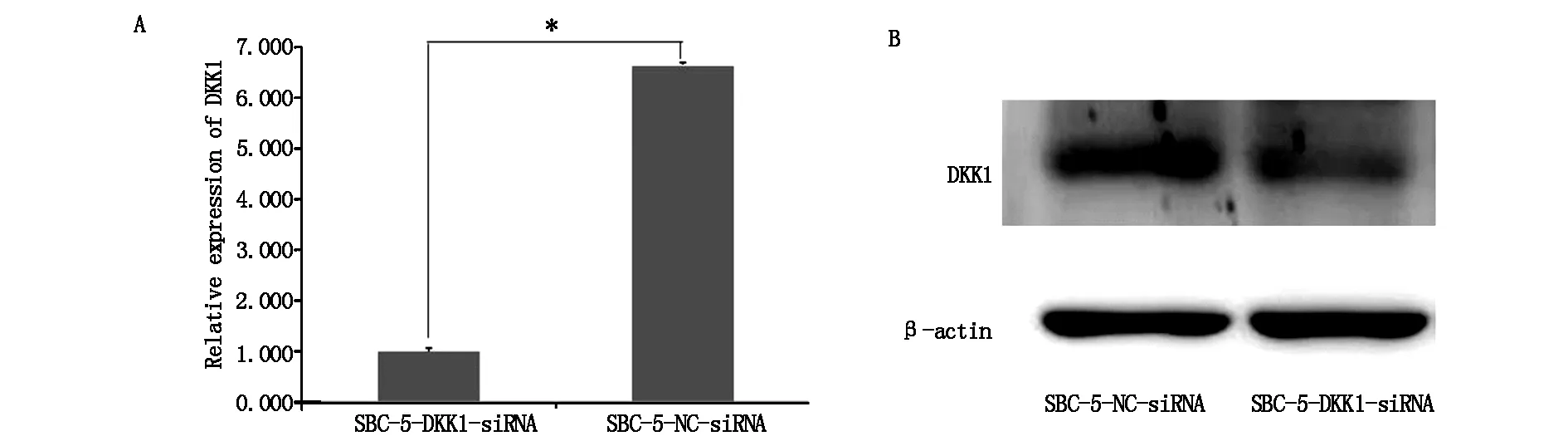
圖2 兩組細胞中DKK1mRNA和DKK1蛋白的表達(*P<0.05)
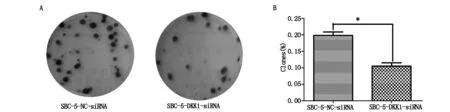
A:下調DKK1表達對SBC-5細胞克隆形成能力的影響;B:實驗結果的統計學分析( *P<0.05)
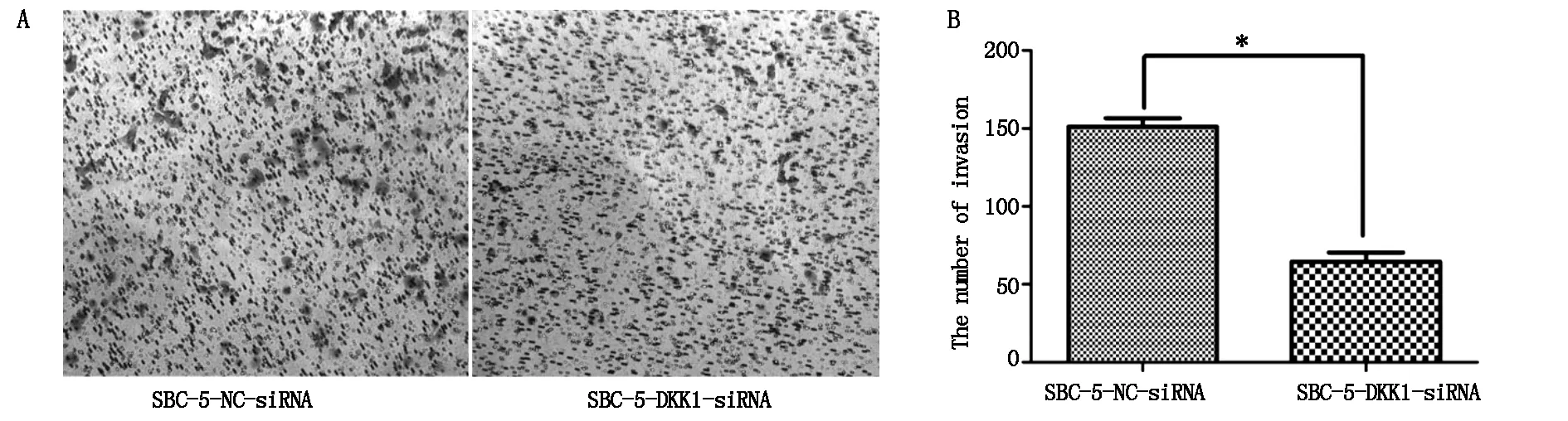
A:Transwell 檢測細胞的侵襲能力變化;B:侵襲能力統計分析(*P<0.05)
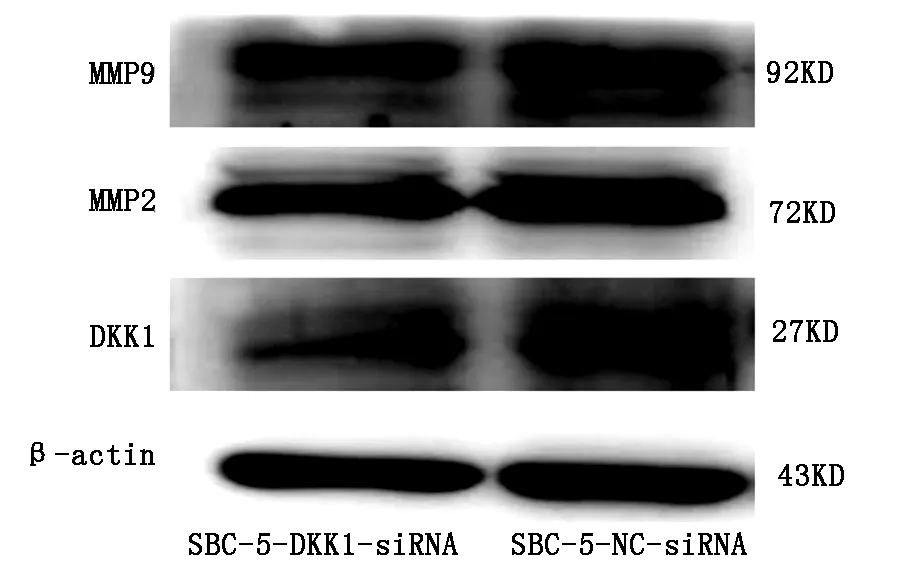
圖5 Western-bloting法檢測下調DKK1后兩組細胞中MMP2和MMP9蛋白表達的差異
3 討論
Wnt信號通路被認為與腫瘤的發生、腫瘤細胞的增殖及轉移等過程密切相關[7]。DKK1是DKKs家族中的一員,屬于分泌型蛋白。通過與Wnt受體LRP5/6及跨膜蛋白Kremen1/2結合形成三聚體,誘導其內吞而發揮抑制Wnt信號通路的作用[8]。
DKK1被報道在乳腺癌細胞株MDA-MB-231和前列腺癌細胞株C4-2B 中過表達,通過抑制Wnt通路引起骨溶解的增加[9,10]。DKK1在NSCLC患者血清水平和細胞株中表達升高,尤其是骨轉移者[11]。盡管DKK1被報道與多種惡性腫瘤相關,但在SCLC中的研究仍較少。結合文獻及SCLC易發生轉移的特點,猜想DKK1可能在小細胞肺癌的發生發展過程中發揮著重要的作用。我們選取具有高增值能力及轉移能力的BC-5細胞,下調DKK1的表達,發現細胞的增殖及侵襲能力被抑制。提示DKK1對SBC-5細胞的生物學行為均有影響。初步揭示DKK1可能參與了SCLC的發生發展過程。
DKK1對Wnt信號通路的調控較為復雜[12]。為初步探討DKK1影響SBC-5細胞株的機制,我們檢測下調DKK1表達后MMP2和MMP9的表達,發現MMP2和MMP9的表達均被抑制,初步揭示DKK1可能通過MMP2和MMP9在SCLC中發揮作用。MMP2和MMP9參與了腫瘤的增殖、侵襲及轉移等過程,特別是在新生血管的形成中發揮著重要的作用[13]。Maniotis等人發現在高侵襲性葡萄膜黑色素瘤中,存在血管生成擬態(vasculogenic mimicry,VM)現象[14],MMP2和MMP9被稱為VM相關蛋白。Lingli Yao等[15],在高表達DKK1和低表達DKK1的NSCLC細胞株A549和H460中,分別下調和上調DKK1表達,觀察到下調DKK1表達后VM相關蛋白MMP2及MMP9表達均被抑制,上調組結果相反。本實驗在SBC-5細胞株中的結果與文獻報道結果一致。提示DKK1可能通過MMP2和MMP9影響小細胞肺癌的發生、發展及轉移。
綜上所述,本實驗初步驗證了DKK1對SBC-5細胞株生物學行為的影響,同時揭示DKK1可能通過調節血管擬態相關蛋白MMP2和MMP9的表達在小細胞肺癌中發揮生物學功能。為后續深入研究DKK1在人SCLC中的作用機制奠定實驗基礎。

