PON1基因多態性與吸煙的交互作用對早發冠心病的影響
楊春強 相彬 路俊生 李明 張霞 王均志
(1日照市中心醫院心血管內科,山東 日照 276800;2青島市城陽區人民醫院心血管內科)
冠心病(CHD)是一類復雜和多因素促成的疾病。發病年齡男性≤55歲,女性≤65歲,則稱為早發CHD(PCAD)。流行病學調查資料表明CHD已經成為發達國家人群發病和死亡原因的主要疾病之一。近年來,我國CHD發病率、患病率、死亡率均呈上升趨勢〔1〕。人類血清對氧磷酶(PON)1由肝臟合成,相對分子質量為43 kD,在血清中借助于極端疏水的N端和載脂蛋白A1緊密結合,固定于高密度脂蛋白膽固醇(HDL-C)中,因能水解有機磷酸酯的底物對氧磷而命名〔2〕。研究發現PON1通過抑制低密度脂蛋白膽固醇(LDL-C)的生成和水解氧化型的LDL-C,抑制巨噬細胞的氧化應激,從而發揮抗動脈粥樣硬化的作用〔3,4〕。目前PON1基因多態性與CHD的相關性亦是研究的熱點。其中rs662位點引起編碼區192位的非同義氨基酸置換(谷氨酸→精氨酸)〔5〕,從而導致PON1水解活性的不同。這個192谷氨酸變體水解對氧磷的效率低于精氨酸變體可以有效地抑制LDL-C的氧化〔6〕。而192精氨酸變體的抗氧化能力降低可能與CHD的發病高風險相關〔7,8〕。吸煙是目前已知的可以降低CHD患者PON1活性的影響因素〔9〕,并且煙草提取物抑制PON1活性成劑量及時間依賴性〔10〕。因此,研究CHD患者PON1基因多態性-吸煙的交互作用將會在冠心病的一級預防、高危險人群篩查中發揮重要的理論指導作用,具有廣泛的應用前景。然而PON1基因多態性-吸煙交互作用是否與CHD危險性相關目前尚無統一觀點。本研究擬探討PON1基因多態性和吸煙的交互作用與中國漢族人群PCAD的相關性。
1 資料和方法
1.1研究對象 2014年6月至2017年6月日照市中心醫院心血管內科住院及門診PCAD患者688例及體檢中心無CHD病史的健康體檢者1 226例進行基因分型。所有研究對象要求年齡男性≤55歲,女性≤65歲,并且均采用國際上公認的診斷CHD的方法,并經冠脈增強電子計算機斷層掃描或選擇性冠狀動脈造影檢查,由專科醫生進行診斷。排除標準:①其他心血管系統相關的疾病;②嚴重器質性疾病史及嚴重感染史;③妊娠哺乳及長期服用避孕藥者。本研究中的研究對象均為無血緣關系漢族人。研究對象均知情同意,并自愿簽署知情同意書。
1.2病史采集及實驗室檢查 所有研究對象采集以下信息:年齡、性別、既往病史、藥物治療、CHD家族史、行為因素、體格檢查等情況。清晨取空腹靜脈血送至檢驗科,常規進行生化檢查。
1.3全血細胞基因組DNA的提取與分型 研究對象均抽取2 ml的外周靜脈血置于乙二胺四乙酸(EDTA)抗凝管中,采用北京天根科技公司(Tiangen Biotech,Beijing,China)的RelaxGene Blood DNA System提取所有樣本的基因組DNA。采用基于連接酶檢測反應(LDR)的SNP分型技術(上海翼和應用生物技術有限公司)對所有樣本的4個SNP位點進行基因分型。簡要流程如下:①通過多重PCR技術(Multiple PCR)獲得含有待檢測突變位點的基因片段;②通過多重LDR技術(Multiple LDR)進行基因分型檢測;③最后通過測序儀電泳讀取檢測結果。
為了確保實驗質量,我們在分型中使用了雙重陽性對照(相同DNA樣本的重復)和陰性對照(空白,不含DNA 樣本)。SNP和樣本分型正確率在95%以上時方可進入下一步的實驗流程。
1.4統計學分析 采用SPSS18.0軟件進行統計分析。計數資料用例(百分率)表示,計量資料用均數±標準差表示。計量資料組間比較時,滿足正態性及方差齊性的數據采用完全隨機設計兩獨立樣本均數比較的t檢驗,不滿足正態性及方差齊性者則采用非參數檢驗。所有計數資料的統計使用χ2檢驗以及基于二分類變量的Logistic回歸檢驗。本研究采用廣義多因子降維法(GMDR)分析各種變量間的組合并判讀較好的模型。在一次性分析多個SNP是否與疾病相關聯時,如果將P值定義在0.05水平,則多重比較會增加假陽性結果,因此需要對此進行校正,以減少假陽性的結果。主要應用Bonferroni Correction法〔11〕進行多重比較的校正。
2 結 果
2.1一般資料分析 兩組性別和年齡差異無統計學意義(P>0.05)。PCAD組的高血壓病史、糖尿病病史、吸煙史及家族史所占比例均明顯高于對照組(P<0.05)。與對照組比較,PCAD組體重指數(BMI)及LDL-C水平明顯升高(P<0.05),而HDL-C水平明顯降低(P<0.05)。見表1。
2.2對照組和PCAD組rs3735590、rs3917550、rs662、rs3917481等位基因和基因型頻率的分布 所有SNP位點均顯示出2個等位基因及3個基因型。rs3735590、rs3917550、rs662、rs3917481等位基因和基因型頻率分布在PCAD組和對照組間差異無統計學意義(P>0.05)。見表2。
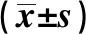
表1 對照組與PCAD組一般資料分析

表2 對照組與CHD組基因型和等位基因頻率的分布〔n(%)〕
1)經BonferroniCorrection法多重比較校正,下表同
2.3不同遺傳模型下(共顯性、顯性和隱性和加性模型)rs3735590、rs3917550、rs662,、rs3917481位點與PCAD的關聯分析 運用基于二分類變量的Logistic回歸在不同遺傳模型下進行所研究位點與PCAD的關聯分析。結果顯示rs3735590位點在隱性模型 (TTvsCT+CC)下與PCAD相關(P=0.007 6,OR=0.23,95%CI=0.07~0.75)。在經過多重校正后依然有統計學意義(P=0.030 4)。而rs3917550、rs662,、rs3917481在不同遺傳模型下均與PCAD遺傳易感性不相關(P>0.05)。見表3。

表3 不同遺傳模型下rs3735590、rs3917550、rs662、rs3917481位點與PCAD的關聯分析
共顯性模型:CT vs CC;TT vs CC(T);顯性模型:TT+CT vs CC(T為最小等位基因);隱性模型:TT vs CT+CC(T為最小等位基因);加性模型:TT vs CT vs CC(T為最小等位基因);P值:經性別、年齡、高血壓、糖尿病、吸煙史、家族史、BMI、HDL-C、LDL-C校正,下表同
2.4按照吸煙史分層后rs3735590、rs3917550、rs662、rs3917481與PCAD的關聯性分析及基因-吸煙的相乘的交互作用分析 因為rs3735590、rs3917550及rs3917481的風險基因型頻率較少,同時,在大部分情況下,顯性模型也顯示了更好的適應性。因此我們運用基于二分類變量的Logistic回歸在顯性模型下進行相乘的基因-吸煙交互作用分析。結果顯示rs3735590及rs662與吸煙存在相乘的交互作用(均P<0.000 1)。并且在按照吸煙史分層后,我們發現rs662位點的等位基因T(基因型為CT+TT)與吸煙的PCAD患者的發病風險相關(P<0.05)。而rs3735590與有吸煙史及無吸煙史的PCAD患者的發病風險均相關(均P<0.05)。其余兩個位點并未發現與PCAD的相關性(P>0.05)。見表4。

表4 按照吸煙史分層后rs3735590、rs3917550、rs662、rs3917481與PCAD的關聯性分析及基因-吸煙間的交互作用
2.5rs3735590、rs3917550、rs662、rs3917481與吸煙的相加的基因-吸煙交互作用分析 本研究同樣在顯性模型下進行相加的基因-基因交互作用分析。我們使用2×2的析因設計來計算相加的基因-基因交互效應。假設A(-)為非風險基因型,則A(-)/A(-)為參照組,RR11為A(+)/A(+)組風險/參照組的風險(OR值),RR10為A(+)/A(-)組風險/參照組的風險,RR01為A(-)/A(+)組風險/參照組的風險。表5為不同位點組合下計算的RR11,RR10和RR01。如rs3735590/吸煙-0/0表示CC-無吸煙史組合;rs3735590/吸煙-0/1表示CC-有吸煙史組合;rs3735590/吸煙-1/0表示CT+TT-無吸煙史組合;rs3735590/吸煙-1/1表示CT+TT-有吸煙史組合。結果顯示調整混雜因素后,并未發現有統計學意義的交互作用效應。
2.6rs3735590、rs3917550、rs662、rs3917481基因-吸煙交互作用的GMDR分析 本研究通過GMDR0.9軟件進行多因子降維分析2.6rs3735590、rs3917550、rs662、rs3917481基因-吸煙交互作用。表6列出了不同組合的最佳模型,及訓練精確度、測試精確度及10次擬合的交叉驗證一致性(CV)。結果顯示rs3735590-rs3917550-rs662-rs3917481-吸煙構成的組合符號檢驗有統計學意義(P=0.001),且訓練精準度、測試精準度及CV都較高,因此為最佳交互作用模型。

表5 rs3735590、rs3917550、rs662、rs3917481與吸煙交互作用叉生分析(n)
吸煙0/1:無吸煙史/有吸煙史;rs3735590 0/1:CC/CT+TT;rs3917550 0/1:GG/GA+AA;rs662 0/1:CC/CT+TT;rs3917481 0/1:CC/CT+TT

表6 基因-吸煙交互作用和PCAD風險的廣義多因素降維模型
3 討 論
PCAD病理學研究表明其動脈粥樣硬化斑塊富含脂質泡沫細胞,為軟斑塊〔12〕,此種軟斑塊進展迅速易破裂是冠狀動脈血栓形成的主要原因,故PCAD多無先兆癥狀,急性起病多表現為急性冠脈綜合征,尤其是急性心肌梗死,病死率極高〔13〕。研究發現,典型的PCAD患者多為超重、重度吸煙、血壓升高并且一級親屬多有CHD病史的患者〔14〕。與本研究結果類似。
吸煙是目前公認的可引起過早死亡的最為重要的因素,并且為CHD的關鍵獨立危險因素。本研究結果與其他在東亞裔人群中的研究相似〔15〕,在整體人群中本研究并未發現PON1基因rs662位點的多態性與PCAD相關。然而,在按照吸煙史分層后,我們發現等位基因T(基因型為CT+TT)增加了吸煙PCAD患者的發病風險。有研究發現,HDL-C參與了PONI基因對CHD發病的過程〔16〕,rs662位點的C等位基因與較低的HDL-C水平相關。然而,與他人研究結果一致〔17〕,我們并未發現PON1基因與HDL-C的相關性(數據未顯示)。此外,本研究說明PON1的rs662位點與吸煙的交互作用對PCAD的影響并非是由HDL-C等常見的危險因素介導的。
此外,本研究亦發現一個新的位點rs3735590與吸煙的交互作用或許參與了PCAD的發病。rs3735590位點位于PON1基因的3′非翻譯區(UTR)。研究顯示該位點的等位基因C到T的改變,可以降低miRNA-616對PON1基因3′UTR的親和力,從而促進該基因的表達,并降低動脈粥樣硬化的風險〔18〕。本研究與以上研究相似,本研究結果提示TT基因型或許可以降低PCAD的發病風險。此外,我們發現對于有吸煙史的PCAD患者,攜帶等位基因T (基因型為CT+TT)或許降低了43%的發病風險。然而,在無吸煙史的PCAD患者中,我們發現了等位基因T似乎增加了PCAD的發病風險。鑒于后者為邊界P值,這種現象很難理解,或許可以解釋為吸煙與該位點的基因-環境之間的上位性效應弱化了單個位點的等位基因或基因型的效應。因為目前僅有關于煙草提取物通過修飾PON1的自由巰基而改變血漿中該酶活性的生物學研究,卻罕見關于吸煙與PON1基因多態性交互作用的分子生物學研究。因此,未來需要更多的體內及體外研究加以證實。
復雜疾病的發生往往涉及到多個基因的交互作用,基因之間、基因與環境之間也存在著復雜的調控機制。因為沒有最好的統計學方法來檢驗基因-基因、基因環境交互作用,本研究結果Logistic回歸分析結果說明兩個位點rs373559與rs662與吸煙的交互作用是非依賴性的。傳統的Logistic回歸分析方法可用于基因間交互作用的研究,但是對于多變量的研究對象,交互作用也隨之增加,出現所謂的超參數化,從而降低檢驗效能。因此,多因子降維分析法(MDR)應運而生,在基因交互分析中得到了廣泛應用。MDR是一種非參數、無需遺傳模式的分析方法,它的主要特點是把高維的位點組合分成高危和低危兩類,降低了數據的維數,并通過交叉驗證來檢驗模型。最后得到的結果是一組模型,每一個模型是從一個特定交互級別(l階、2階、…交互作用)中選取最優的。該方法不僅適用于病例對照的研究設計,而且可應用于復雜疾病的交互作用分析。以MDR方法為基礎,學者發展了GMDR。與MDR相比較,GMDR采用基于廣義線性回歸的積分的統計方法,代替了MDR中的高危和低危分類,可處理計量和計數資料,同時允許調整協變量。這種方法和MDR丟失大量信息的降維方法不同,從而把握度也得到提高。本研究結果顯示rs3735590-rs3917550-rs662-rs3917481-吸煙構成的組合符號檢驗有統計學意義(P=0.001),且訓練精準度、測試精準度以及交叉一致性都較高,因此為最佳交互作用模型,與PCAD發病有關,它們之間的調控機制可能參與了PCAD疾病的發展進程,然而值得注意的是GMDR分析只是產生假說,這些推測都需要得到進一步的證實。
本研究尚存在一些不足之處。①未能將這四個位點與血漿PON1活性做進一步分析。盡管如此,前人的一些研究或許能支持我們的結論。②未能進一步分析PCAD患者PON1基因多態性與吸煙嚴重程度的交互作用。因為前已述及,煙草提取物抑制PON1活性成劑量及時間依賴性。因此,未來需要進一步的研究,例如按照 “年支”劃分吸煙的分嚴重程度加以證實PON1基因與吸煙在PCAD患者中的交互作用效應。
綜上,本研究從表觀遺傳學的角度分析了PON1基因的4個SNP位點與吸煙的交互作用對PCAD的影響。結果發現兩個位點rrs3735590和rs662與吸煙存在交互作用,或許參與了PCAD的發病機制。因此,本研究或為從基因環境交互作用的角度研究若干相關基因與PCAD的關系提供了新的研究方向。

