血清食欲素A對急性腦梗死的影響
張填 邢夢蕓 趙振強 王埮
(海南醫學院第一附屬醫院神經內科一病區,海南 海口 570102)
急性腦梗死(ACI)是最常見的腦卒中類型,具有高致死率、高致殘率、高復發率的特點,我國住院ACI患者發病后3個月時病死率為9%~9.6%,致殘率為34.5%~37.1%,1年時病死率為14.4%~15.4%,致殘率為33.4%~33.8%〔1,2〕。嚴重影響腦卒中患者的日常生活能力和社會功能,加重患者家庭及照料者的負擔。ACI的危險因素眾多、機制較為復雜,尚未十分明確。食欲素(Ox)與下丘腦泌素為同一種物質,是一種具有調節機體攝食及能量平衡作用的小分子神經多肽,包括OxA和OxB〔3〕。OxA為脂溶性,可以通過血腦屏障,其在組織或血液中的含量顯著高于OxB,而OxB在血液中很快被降解不能被完整發現并檢測到。研究已發現,OxA參與調節多種生理和病理學機制,如飲食與能量代謝、睡眠與覺醒、炎癥反應、血壓調節、學習與記憶、腫瘤細胞凋亡等〔4~8〕。近年來,Ox及受體在神經系統疾病,如帕金森病、認知功能障礙、腦卒中后抑郁及腦血管病等的病理生理學作用及其機制的研究也日益引發關注。然而,其對ACI患者的臨床影響目前報道較少。本研究探討OxA對ACI的影響,以期為臨床提供及時、有效的治療方案,延緩ACI的進展,降低其死亡率、致殘率。
1 對象與方法
1.1研究對象 選取2017年4~12月于海南醫學院第一附屬醫院神經內科住院的ACI患者117例ACI組,男77例,女40例,平均年齡(59.97±8.99)歲,平均受教育年限(9.25±3.21)年。全部病例符合中國急性缺血性腦卒中診治指南2014的診斷標準〔9〕,并經頭部計算機斷層掃描(CT)或磁共振成像(MRI)證實,發病72 h內就診,且能夠配合完成相關量表及神經系統檢查者。排除應用溶栓或微創治療及死亡的患者,并排除嚴重的心、肝、腎疾病及感染者,排除ACI發病前即有認知障礙者,排除甲狀腺功能減退、意識障礙、嚴重失語、失用、視力及聽力障礙、嚴重神經功能缺損〔美國國立衛生研究院腦卒中量表(NIHSS)評分>10分〕等影響認知功能評估者,排除有嚴重焦慮或抑郁癥、有酒精、藥物濫用及嚴重精神疾病(如精神分裂癥、躁狂癥等)者。同時,選取同期健康體檢者65例為對照組,男42例,女23例,平均年齡(59.29±7.73)歲,平均受教育年限(9.71±2.83)年。兩組性別、年齡、受教育年限方面比較差異均無統計學意義(P>0.05)。
1.2研究方法
1.2.1神經功能評定及預后判斷標準 由專業的同一位神經內科醫師對117例ACI患者在其入院時進行NIHSS測評,NIHSS評分越高提示ACI病情越重。采用改良Rankin量表〔10〕(mRS)評估ACI患者在發病30 d時的殘疾程度,≤2分為預后良好,>2分為預后不良,mRS評分越高提示預后越差。
1.2.2實驗室指標檢測 所有觀察對象于入院后第2天清晨空腹采集肘靜脈血,采用酶聯免疫吸附試驗(ELISA)檢測血清OxA、β淀粉樣蛋白(Aβ)1~42、磷酸化tau蛋白(P-tau)水平的表達,同時由我院檢驗科生化分析儀檢測一般生化項目,包括同型半胱氨酸(Hcy)、超敏C反應蛋白(hs-CRP)、尿酸(UA)、胱抑素(Cys)-C、總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)水平。
1.3統計方法 采用SPSS20.0統計軟件進行t及χ2檢驗。相關性分析采用Spearman相關分析。ACI的危險因素分析采用Logistic回歸分析。
2 結 果
2.1兩組吸煙史、飲酒史、既往史比較 與對照組比較,ACI組在吸煙史、飲酒史、高血壓史、糖尿病史等方面均有顯著差異(P<0.05),見表1。

表1 兩組吸煙、飲酒及既往史比較〔n(%)〕
2.2兩組血清學指標比較 與對照組比較,ACI組血清OxA、Aβ1~42、Hcy、hs-CRP、Cys-C水平明顯升高,而HDL-C水平明顯下降,差異均有統計學意義(P<0.05)。兩組P-tau、UA、TC、TG及LDL-C水平差異無統計學意義(P>0.05),見表2。
2.3ACI危險因素的Logistic回歸分析 導入10個可能影響ACI的因素,經Logistic逐步回歸分析,最后篩選出5個主要的影響因素:吸煙史、高血壓史、OxA、Hcy及HDL-C,見表3。
2.4ACI不同預后患者血清OxA水平比較 預后良好(mRS≤2分)的ACI患者OxA水平為(954.20±1 142.61)pg/ml,與預后不良(mRS>2分)的ACI患者OxA水平〔(1 083.66±1 259.76)pg/ml〕比較,差異無統計學意義(t=0.567,P=0.572),表明血清OxA水平對ACI患者近期預后無影響。
2.5ACI患者血清OxA水平與入院后NIHSS評分、發病30 d時mRS評分及相關實驗室指標的相關性 ACI患者血清OxA水平與Aβ1~42、Hcy及hs-CRP呈正相關(均P<0.05),而與入院后NIHSS評分、發病30 d時mRS評分無相關性(P>0.05),見表4。
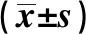
表2 兩組血清學指標比較

表3 ACI危險因素的Logistic回歸分析

表4 ACI患者血清OxA水平與NIHSS評分、mRS評分及ACI相關指標的相關分析
3 討 論
ACI的病理生理學機制十分復雜,主要包括缺血性去極化、鈣離子和谷氨酸誘導的興奮性細胞損傷、包括各種自由基在內的活性氧引起的氧化損傷、次級微循環障礙、水腫形成、細胞凋亡及炎癥反應等。腦缺血后可致細胞立即或延遲死亡,并伴有強烈的炎癥反應,可加重再灌注過程中的損傷。
研究發現,Ox神經元廣泛分布于神經系統,包括大腦皮質、丘腦、下丘腦、腦干、邊緣系統、脊髓及迷走神經等,其中在丘腦、下丘腦和藍斑等處分布密集,調節自分泌和神經內分泌〔11〕。OxA參與了腦缺血后的病理生理過程,并可能通過調節炎癥反應、促進神經保護因子表達等發揮神經保護作用。OxA可抑制腦缺血神經元損傷,并調控缺血后葡萄糖耐受不良〔12〕;可通過調節c-Fos蛋白表達來減輕脂多糖誘導的炎癥反應〔13〕;可通過降低中性粒細胞活化和脂質過氧化作用,對缺血再灌注引起的損傷發揮保護作用〔14〕。大鼠腦缺血后,外源性給予OxA可促進腦缺血后低氧誘導因子(HIF)-1α的表達,從而促進血管發生、神經干細胞分化及減少細胞凋亡而起到神經保護作用〔15〕。Xiong等〔16〕研究發現,Ox基因敲除(AT)小鼠在給予短暫性大腦中動脈栓塞(MCAO)后24、48 h巨噬細胞/小膠質細胞浸潤和髓過氧化物酶陽性細胞數明顯增多,腦梗死體積明顯增大,且神經功能評分較差。在MCAO處理前給予腦室注射OxA可顯著減少兩組小鼠的梗死體積和巨噬細胞/小膠質細胞浸潤,提高AT小鼠的神經學評分;在MCAO處理后注射OxA亦可減少兩組小鼠的梗死面積,且經OxA預處理可顯著減少脂多糖誘導的BV2小膠質細胞產生TNF-α,結果表明,OxA在腦缺血引起的氧化應激中發揮著重要的抗炎作用,并通過抑制炎癥反應對腦缺血損傷起到神經保護作用。
本研究發現,ACI患血清OxA、Hcy、hs-CRP、Cys-C水平明顯升高,而HDL-C水平明顯下降,與相關研究結果一致〔17~19〕,且OxA、Hcy、HDL-C是ACI的影響因素,但血清OxA水平與入院時NIHSS評分、發病30 d時mRS評分無相關,與Hcy、hs-CRP呈正相關。已有研究證實,Hcy及hs-CRP水平升高均可增強氧化應激反應〔20,21〕。本研究認為血清OxA與ACI的發生有關,但與ACI的病情輕重及近期預后無關,分析其原因可能為:腦缺血后包括各種自由基在內的活性氧引起的氧化應激損傷、細胞凋亡及炎癥反應等,使OxA表達反應性升高,通過與Hcy、hs-CRP相關的某些機制抑制氧化應激中的炎癥反應而發揮神經保護作用,可能為機體的一種自我保護,其確切機制有待于進一步研究。然而Kotan等〔22〕研究發現,腦梗死后2~3 d患者血清和腦脊液OxA水平不同程度下降,與本研究結果不相一致,可能與樣本量等因素有關,需要多中心、大樣本研究進一步評估OxA對ACI的影響,所得結果更為可靠。
另外,本研究發現,ACI患者血清OxA水平與Aβ1~42呈正相關。Aβ是由淀粉樣前體蛋白經過水解作用產生的多肽,可循環于血液、腦脊液和腦間質液中,其中最常見的亞型是Aβ1~40和Aβ1~42。其中Aβ1~42的毒性更強,更易聚集。Aβ對神經元具有直接毒性,可導致氧化應激,炎癥反應,改變細胞內鈣離子穩定〔23〕。阿爾茨海默病即以進行性Aβ沉積為特征,而腦血管病與阿爾茨海默病存在著協同甚至可能的因果關系。戚基萍等〔24〕對43例因腦梗死而死亡的尸檢腦標本進行研究后發現,Aβ1~40和Aβ1~42在人腦缺血后海馬CA1區的表達上調,且Aβ1~40和Aβ1~42的過度表達可能對腦缺血后腦損傷的進展起著重要作用。柯莉等〔25〕研究發現,ACI患者血漿Aβ1~42水平較健康對照組水平顯著增高,且血漿Aβ1~42水平隨腦梗死體積的增大及NIHSS評分的增加而升高。本研究發現,ACI患者血清Aβ1~42水平明顯升高,與上述研究結果一致。另有研究發現〔26〕,促食素可以通過抑制小膠質細胞的吞噬作用和自噬潮而阻止Aβ的清除。若我們的假設成立,ACI后的血清OxA表達反應性升高,發揮神經保護作用的同時進一步促使Aβ的增多、聚集,從而是否更易導致腦卒中后認知障礙的發生,有待于進一步研究探討。

