激活原代星形膠質細胞α7尼古丁膽堿能受體對PI3K/Akt/HSP70信號通路的影響
董智慧 呂菊 謝鵬 任真奎,3 官志忠,4 禹文峰
(貴州醫科大學 1分子生物學重點實驗室,貴州 貴陽 550004;2地方病與少數民族疾病教育部重點實驗室;3黔西南州人民醫院檢驗科;4貴州醫科大學病理學教研室)
在神經退行性疾病中,阿爾茨海默病(AD)是現在公共衛生最重視的問題之一。AD是一種由多種因素如性別、遺傳基因、環境等影響的神經退行性疾病,主要特征在于β淀粉樣蛋白(Aβ)和tau蛋白的異常加工,導致細胞外老年斑和細胞內神經原纖維纏結的形成,從而引發一系列細胞毒性作用,最終導致大腦神經元凋亡,甚至壞死,繼而出現漸進性認知功能障礙〔1〕。熱休克蛋白(HSP)70是HSPs家族中含量最多的成員,可以通過增強β淀粉樣蛋白(Aβ)清除、抑制Aβ聚集、恢復和穩定tau蛋白的穩定性及抑制細胞凋亡和神經炎癥等多種方式在AD中發揮細胞保護作用〔2,3〕。在星形膠質細胞中,過表達HSP70可減輕脂多糖(LPS)或α-突觸核蛋白誘導的神經炎癥〔4,5〕。α7尼古丁膽堿能受體(α7nAChR)廣泛存在于大腦皮質和海馬神經元、星形膠質細胞、小膠質細胞中,在AD中具有神經保護作用而成為AD的重要研究對象〔6〕。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)信號通路在細胞生長和生存中具有重要作用。在AD中,α7nAChR可通過PI3k/Akt信號通路參與AD的神經保護作用〔7〕。同時,有研究表明,PI3K/Akt也參與了HSP70 的調控〔8〕。但是對于α7nAChR是否參與了HSP70的調控目前還不清楚。本課題組前期研究表明在星形膠質細胞內,尼古丁可通過α7nAChRs調控內源性cryab蛋白的表達〔9〕。而HSP70與cryab都屬于HSPs家族的成員,他們都具有清除蛋白異常聚集的功能。本研究擬探討在星形膠質細胞內α7nAChR與HSP70蛋白表達的關系,為AD的預防提供新思路。
1 材料和方法
1.1實驗動物 1~24 h內新生的Sprangue-Dawley(SD)大鼠,由貴州醫科大學動物實驗中心提供(動物許可證號:SCXK(黔)2012-0004)。
1.2主要儀器和試劑 胎牛血清,DMEM培養基,購于Gibco公司(美國);尼古丁及鼠抗HSP70單克隆抗體,購于Sigma公司;α7nAChR阻斷劑methyllycaconitine(MLA),購于TOXICE公司;PI3K/Akt信號通路阻斷劑LY294002,辣根過氧化物酶(HRP)標記的抗鼠的二抗和鼠抗β-肌動蛋白(actin )單克隆抗體,購于美國CST公司;超敏電化學發光法(ECL)發光試劑盒和聚乙烯二氟(PVDF)膜購于美國Millipore 公司;聚氰基丙烯酸正丁酯(BCA)蛋白定量試劑盒和蛋白Marker購于美國Thermo公司;抗體稀釋液、封閉液、十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)快速凝膠配置試劑盒購于碧云天生物技術有限公司;熒光倒置顯微鏡出自Olympus公司;超高速離心機出自德國的eppendorf公司;二氧化碳培養箱購于日本SANYO公司。
1.3原代星形膠質細胞培養及鑒定方法 主要參照McCarthy等〔10〕和Schildge等〔11〕的方法并進行改良,分離新生SD乳鼠大腦皮質處的星形膠質細胞,剪成約1 cm3,0.25%胰酶消化并進行漂洗后,加入含1 %雙抗(青霉素100 U/ml和鏈霉素100 U/ml)及含10 %FBS的高糖DMEM培養基,繼續吹打制成細胞懸液后接種于25 cm2的培養瓶內,在5% CO2、37℃恒溫的條件下培養24 h后換液。之后每隔2~3 d換液一次直到細胞鋪滿整個瓶底。純化后將細胞傳1~3代。將細胞接種于用多聚賴氨酸(PLL)包被好的12孔板內,采用膠質纖維酸性蛋白(GFAP)及神經核抗原(Neu)N進行細胞免疫熒光雙染后鑒定星形膠質細胞的純度。
1.4細胞分組及加藥處理 當分離出星形膠質細胞后培養1 w,純化并鑒定后,以一定密度接種于六孔板內,待細胞快長滿孔底時,將細胞分組后加藥處理。細胞分組情況:單獨空白對照組、單獨激動劑尼古丁組、單獨阻斷劑(MLA或LY294002)組、MLA+尼古丁組、PI3K信號通路阻斷劑LY294002組及LY294002+尼古丁組。MLA+尼古丁組或LY294002+尼古丁組預先加MLA或LY294002處理星形膠質細胞2 h后,再加入尼古丁共同處理18 h。
1.5免疫印跡法檢測蛋白表達水平 棄去細胞培養液,用預冷的磷酸鹽緩沖液(PBS)將殘留培養液清洗干凈,加入適量細胞裂解液,收集細胞,冰上裂解2 h后12 000 r/min離心20 min,收集上清。通過BCA蛋白定量法檢測提取的細胞蛋白濃度。最后,采用免疫印跡法檢測目的蛋白HSP70和P-Akt蛋白表達水平,以內參(β-actin/GAPDH)蛋白為內對照。用ImageJ軟件分析并計算HSP70和P-Akt蛋白條帶與β-actin/GAPDH蛋白條帶像素灰度的比值作為蛋白表達相對水平。實驗重復3次,每次3復孔。
1.6統計學分析 使用GraphPad Prism5.0軟件進行分析,組間兩兩比較采用配對t檢驗,多組比較采用單因素方差分析(one-way ANOVA)。
2 結 果
2.1星形膠質細胞的免疫熒光鑒定 熒光顯微鏡下觀察,當星形膠質細胞占所有細胞的98%以上時,繼續開展后續實驗。見圖1。

圖1 原代培養星形膠質細胞 GFAP 免疫熒光染色(×200)
2.2尼古丁明顯上調HSP70蛋白表達水平 與空白對照組〔(1.00±0.27)%〕比較,用濃度為5 μmol/L的尼古丁刺激星形膠質細胞不同時間段(6、12、18、24 h)后,HSP70蛋白表達水平不同程度升高〔分別為(1.89±0.25)%、(2.55±0.52)%、(4.16±0.67)%、(4.06±0.77)%,P<0.05〕,在18 h、24 h時間段升高最明顯(P<0.01)。見圖2。

圖2 尼古丁上調 HSP70 蛋白表達
2.3尼古丁通過激活α7nAChRs上調HSP70蛋白表達水平 采用濃度為0.1 μmol/L的α7nAChRs 阻斷劑MLA預處理星形膠質細胞2 h后,再加入濃度為5 μmol/L尼古丁共培養18 h后檢測HSP70蛋白的表達水平。結果顯示,對照組、MLA組、尼古丁組、MLA+尼古丁組HSP70蛋白水平分別為(1.00±0.17)%,(1.12±0.17)%,(2.08±0.18)%,(1.19±0.12)%;MLA+尼古丁組與尼古丁組比較,HSP70蛋白表達水平受到抑制(P<0.05)。證明尼古丁可以通過激活α7nAChRs 而上調HSP70蛋白水平。見圖3。
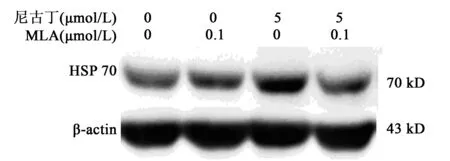
圖3 尼古丁通過激活 α7nAChRs上調HSP70 蛋白表達
2.4PI3K/Akt信號通路參與尼古丁激活α7nAChRs上調星形膠質細胞內HSP70蛋白表達水平 用5 μmol/L 尼古丁分別作用于星形膠質細胞不同時間(5 min、10 min、20 min、30 min),結果顯示P-Akt蛋白的上調效應出現時間依賴性,對照組,5、10、20、30 min組P-Akt蛋白水平依次為(1.00±0.28)%、(1.00±0.35)%、(1.47±0.27)%、(2.33±0.42)%、(2.21±0.33)%;在20 min后蛋白表達達到穩定階段,因此選用該時間段進行后續實驗(P<0.05),見圖4。后續采用LY294002或MLA預處理星形膠質細胞2 h,再加入尼古丁共處理20 min后提取細胞總蛋白檢測。結果顯示,對照組、尼古丁組、尼古丁+LY294002組、MLA+尼古丁組的P-Akt蛋白水平分別為(1.00±0.15)%、(1.93±0.19)%、(1.35±0.27)%、(0.86±0.20)%,P-Akt蛋白的上調作用可被LY294002或MLA所抑制(P<0.05),見圖5,圖6。為進一步研究LY294002是否能抑制星形膠質細胞HSP70的上調,用10 μmol/L的LY294002預處理星形膠質細胞2 h,在加入尼古丁5 μmol/L 培養18 h后,對照組、LY294002組、尼古丁組、尼古丁+LY294002組HSP70蛋白表達水平分別為(1.00±0.17)%、(1.07±0.23)%、(1.77±0.14)%、(1.09±0.13)%;與尼古丁組比較,HSP70蛋白表達水平明顯受到抑制(P<0.05),見圖7。

圖4 尼古丁顯著上調 P-Akt(ser473)蛋白表達

圖5 LY294002對P-Akt蛋白表達的影響

圖6 MLA對P-Akt蛋白表達的影響

圖7 LY294002對尼古丁上調HSP70蛋白表達水平的影響
3 討 論
HSP是機體在受到外界刺激(如高溫,重金屬,有毒物質等)時細胞產生的一種高度保守的分子伴侶蛋白。HSP在蛋白質折疊過程中發揮重要作用,細胞可以將HSP轉運至突觸和軸突以阻斷或阻礙錯誤折疊蛋白的過程〔12〕。AD的病理機制主要是Aβ的異常折疊、聚集和tau蛋白的過度磷酸化。許多研究表明,HSP不僅可以直接抑制β-淀粉樣聚集,保護細胞免受Aβ毒性的影響,也可以促進錯誤聚集和折疊的蛋白質進行泛素化和降解。HSP70是在中樞神經系統中表達最豐富的一種HSP,HSP70家族由17個成員組成,在細胞的各區室廣泛存在,包括細胞核、細胞質、線粒體和內質網。HSP70也具有保護蛋白質正確折疊的功能,并有助于損傷蛋白質的再折疊和再活化〔13〕。在神經退行性疾病中,HSP70與Aβ和路易小體有共存的現象。在AD腦組織中,也發現受影響區域中HSP70的高水平表達〔14〕。HSP70過表達在AD中具有神經保護作用。在AD動物模型APP/PS1轉基因小鼠的大腦中,過表達HSP70改善了小鼠的認知功能障礙,減輕了AD相關表型〔15,16〕。HSP70可以與APP結合并干擾其分泌途徑以減少Aβ的形成,通過蛋白酶體系統降解tau和Aβ寡聚體〔17〕,也可直接結合異常tau蛋白,并通過促進tau蛋白的降解和去磷酸化來降低其濃度〔14〕。外源性的HSP70對Aβ42的細胞外沉積誘導的毒性具有高度保護作用〔18〕。此外,在星形膠質細胞內,過表達HSP70可以抑制α-突觸核蛋白或LPS誘導的神經炎癥〔4,5〕。
α7nAChR是配體門控離子通道家族中的成員,在調節興奮性神經遞質釋放、提高學習和記憶能力及增強認知功能中起重要作用〔6〕。在神經退行性疾病中,α7nAChRs表達顯著降低〔19〕。在AD動物模型中,激動 α7nAChR會對大鼠的學習和記憶能力產生影響。而α7nAChR在 AD 及精神分裂患者的治療中,也可明顯改善患者的認知功能障礙〔20〕。此外,有研究表明,PI3K/Akt信號通路參與了神經保護作用,在AD的海馬神經元中發現Akt表達明顯減少,從而導致神經元細胞凋亡〔21〕。同時,α7nAChR參與了P13K/Akt信號通路的調控,激活α7nAChR可使PI3K/Akt信號通路中Akt被激活,活化的Akt可使GSK-3β第9位點處的絲氨酸磷酸化(Ser9)水平升高,從而抑制GSK-3β活化導致的tau蛋白病變〔19〕。PI3K/Akt信號通路參與了誘導HSP70的表達,這種調節可能依賴于Akt激活后抑制了GSK-3β的活性。GSK-3β的抑制可使HSP70表達上調,阻斷PI3K/Akt通路會激活GSK-3β的活性,從而抑制HSP70的表達〔22,23〕。
在本實驗研究中,用尼古丁處理原代星形膠質細胞能顯著上調PI3K/Akt信號通路中P-Akt蛋白表達水平,而該上調作用可以被該通路的抑制劑LY294002 或α7nAChR的阻斷劑MLA 所抑制。這說明尼古丁可以通過激活α7nAChR,使PI3K/Akt信號通路激活引起細胞內相應蛋白的表達變化。該研究結果與前期結果〔9〕相一致。另外,阻斷PI3K/Akt信號通路可以抑制HSP70蛋白的表達。本文進一步研究也發現,在星形膠質細胞中,使用PI3K/Akt信號通路阻斷劑LY294002能顯著降低HSP70的表達水平,說明尼古丁很有可能通過激活α7nAChRs從而激活PI3K/Akt/HSP70信號通路來發揮對AD的保護作用,為進一步研究HSP70蛋白是否可作為AD的一個有效的治療靶點奠定了一定的基礎。

