有機小分子催化α,β-不飽和酮的不對稱共軛加成反應研究進展
蔣偉健,陳志衛
(浙江工業大學藥學院,浙江 杭州 310014)
α,β-不飽和酮的不對稱共軛加成反應在有機合成中是一類連接C-C 鍵的非常重要的反應[1-2]。該反應廣泛應用于手性藥物的制備、天然產物的合成,該類反應的產物是許多天然產物、生物活性物質以及手性藥物的重要中間體[3]。近年來,不對稱催化已經成為合成手性分子的一個重要手段。發展得較早的是手性配體與過渡金屬聯合催化[4-5],但是由于金屬離子的引入使得后處理時難以避免部分重金屬殘留,不利于在制藥領域的工業化生產。
相比手性過渡金屬以及酶催化,有機小分子催化劑有著獨特的優勢,如不含過渡金屬、容易制備、價格低廉、反應條件溫和以及穩定性強等[6-8]。因此,近年來越來越受到有機化學家的關注。同時,有機小分子手性催化劑的廣泛應用使得合成手性藥物的工業化進程得到了大大提高。本文主要介紹了幾類常見的有機小分子催化劑對α,β-不飽和酮的不對稱共軛加成反應以及在有機合成中的應用。
1 手性胺催化的α,β-不飽和酮的不對稱共軛加成
2014 年,Luo 課題組[9]首次報道了采用手性伯胺催化簡單烯烴(芳香烯胺)對α,β-烯酮進行不對稱共軛加成。一般來說,簡單烯烴由于親核性較弱以及控制立體選擇性難度較高,很少用于共軛加成反應。但是,采用手性伯胺催化的方法可以解決上述困難。該反應底物適用性高,包括α-取代的乙烯基酮都能以高收率和良好的對映選擇性得到乙烯基化加合物(圖1)。
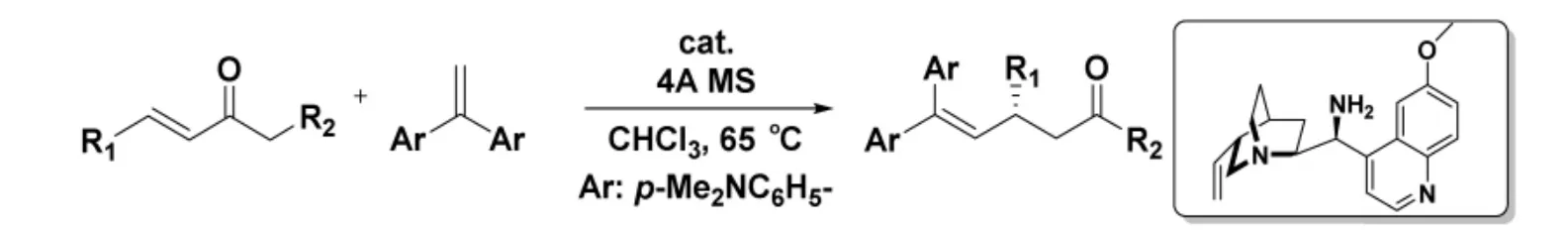
圖1
2015 年,Maruoka 小組[10]通過使用軸向手性胺催化劑,實現了醛對含對甲苯磺酰基保護的α,β-不飽和酮的不對稱共軛加成。進一步,通過對甲苯磺酰基的β 消除,可以將產物轉化為普通方法難以制備的具有γ-立體中心的烯酮。(圖2)
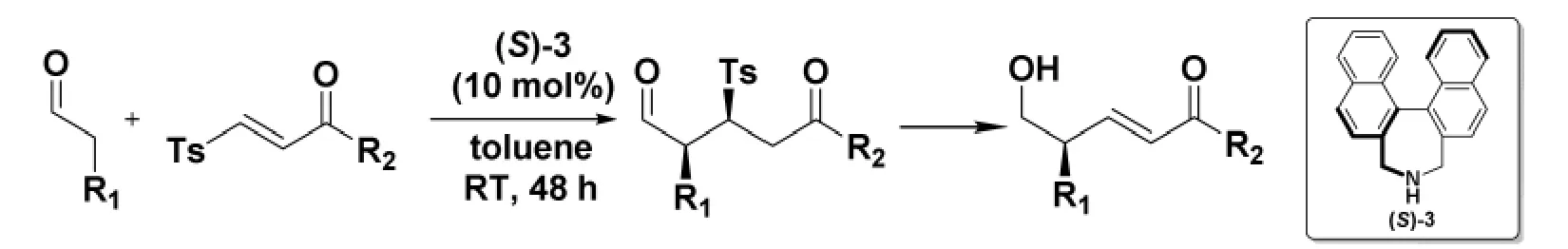
圖2
2017 年,He 課題組[11]首次使用簡單的手性伯胺作為催化劑,開發了一種簡單的有機催化邁克爾-羥醛脫水多米諾反應,用于從丙酮和α,β-不飽和酮制備手性3,5-二芳基-環己烯酮。并且獲得了中等至良好的產率(高達85%)和出色的對映選擇性(88%~98%ee)(圖3)。

圖3
2019 年,Luo 小組[12]報道了通過手性伯胺催化劑以烯酮和硝酮進行1,3-偶極環加成得到具有多個立體異構中心的稠合雙環異惡唑烷衍生物的合成方法。該反應具有良好至優異的對映選擇性(圖4)。
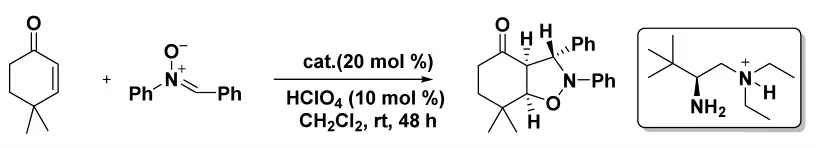
圖4
2 手性磷酸催化的α,β-不飽和酮的不對稱共軛加成
2012 年,游書力小組[13]報道了一條通過手性磷酸催化色胺與烯酮的邁克爾加成環化級聯反應得到吡咯烷二酮的路線。該路線用低至5 mol%的手性磷酸,從廉價易得的色胺和烯酮中以良好的收率和對映選擇性(高達95%收率和83%ee值)獲得了對映體富集的吡咯并吲哚衍生物。值得指出的是,該方法可進一步應用于合成含有吡咯并吲哚核心的天然產物(圖5)。

圖5
2017 年,游書力課題組[14]提出了在催化量的手性磷酸的存在下,以溫和的反應條件,吲哚基烯酮進行對映選擇性分子內脫芳香性邁克爾加成,可獲得具有良好的收率和高對映選擇性(高達97% ee)的各種帶有季立體異構中心的富含對映體的螺-吲哚胺(圖6)。并在后續實驗中以克級反應得到的螺-吲哚胺,其收率和選擇性并未發生改變。

圖6
2017 年,Correia 等人[15]報道了一條以手性磷酸為催化劑,對吲哚嗪與烯酮進行不對稱共軛加成制備高收率和高選擇性的烷基化吲哚嗪的路線(圖7)。除了其廣泛的生物學活性外,還原型的吲哚嗪還因其為吲哚嗪二生物堿的直接前體而聞名。該路線以較高收率和ee 值合成了幾種烷基化的吲哚嗪,并對其進行了包括還原胺化、還原內酯化和部分氫化的衍生。
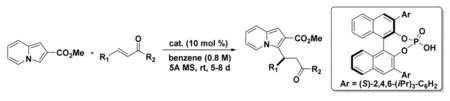
圖7
2019 年,Li 小組[16]報道了在手性螺環磷酸催化下將吲哚和吡咯與外環烯酮共軛加成的路線,該路線具有較高的收率以及高度的對映選擇性(圖8)。該路線為合成具有α-手性中心和特征的含吲哚的環狀酮提供了一種簡單有效的方法。
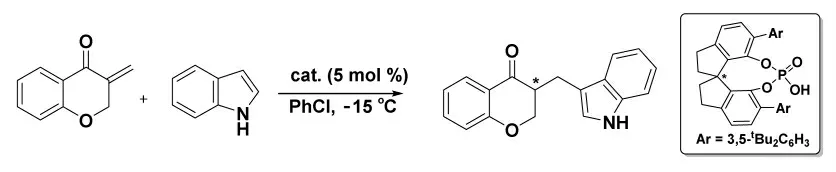
圖8
3 手性聯萘酚催化的α,β-不飽和酮的不對稱共軛加成
2007 年,Wu 課題組[17]首次報道了非金屬催化的不對稱共軛鏈烯基化方法(圖9)。該路線所使用的烯基硼酸酯和聯萘酚催化劑均已實現商品化。并且對于廣泛的烯酮底物,產物均具有優異的對映選擇性。
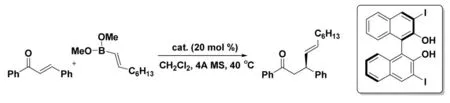
圖9
2011 年,Turner 課題組[18]報道了以手性聯萘酚為催化劑,催化芳基硼酸酯親核進攻α,β-不飽和酮制備手性化合物的方法(圖10)。該路線實現了以往難以實現的不對稱共軛芳基化,并且其收率和選擇性(最高至99% ee 值)均較高。但美中不足的是,該路線的反應溫度較高,且反應時間較長。
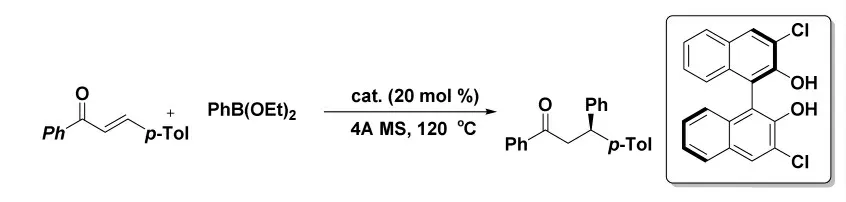
圖10
2012 年,Luan 小組[19]報道了手性聯萘酚催化芳基或鏈烯基硼酸酯對鄰醌甲基化物的不對稱共軛加成(圖11)。在10 mol%催化量下,以高選擇性(最高96% ee)和高收率(最高95%)獲得取代的2-苯乙烯基苯酚。并且通過該路線,以高收率和選擇性兩步合成(S)-4-甲氧基金氧烷。
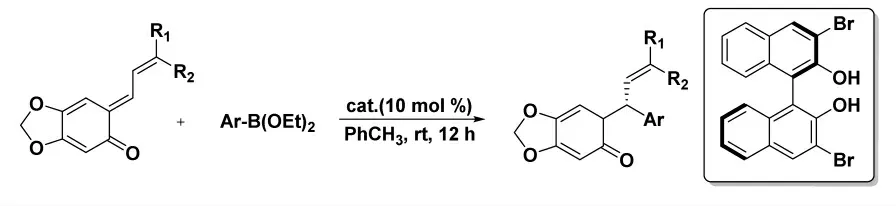
圖11
2015 年,Shih 課題組[20]使用手性聯萘酚催化劑,以相應的三氟硼酸鹽作為親核試劑,通過有機催化對映選擇性共軛加成反應形成雙-雜芳基或雙-芳基立體中心(圖12)。該反應在鄰位取代的芳基親核試劑和范圍廣泛的β-芳基烯酮和烯醛中反應良好。同時,該方法可應用于BR5 成纖維細胞遷移的抑制劑-盤狀吡咯D 的合成。
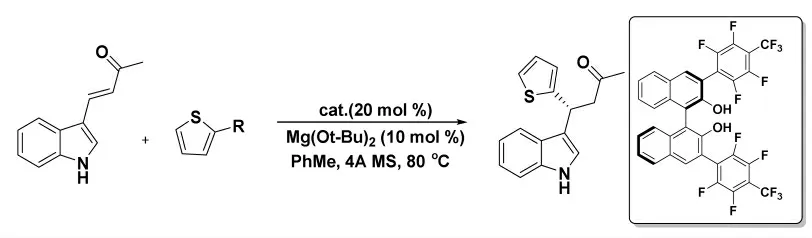
圖12
4 結語
由于α,β-不飽和酮在醫藥領域的應用,對其手性衍生物的研究具有重要的意義。其參與的不對稱共軛加成反應是合成新的手性化合物或雜環化合物的重要方法,這其中有機小分子催化劑的研究顯得十分重要。實驗結果表明,現階段催化劑的使用范圍和通用性仍然具有不同程度的局限性。所以,在現有催化劑基礎上對其進行合理修飾,得到具有更優催化效果且可以大量使用在不對稱反應中的有機催化劑,是今后研究領域的工作重點。

