慢性氨氮脅迫對“新吉富”羅非魚幼魚生長及血清生化指標的影響
唐首杰,劉辛宇,吳太淳,趙金良
( 上海海洋大學,農業農村部淡水水產種質資源重點實驗室,水產科學國家級實驗教學示范中心,水產動物遺傳育種中心上海市協同創新中心,上海 201306 )
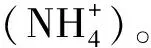
“新吉富”羅非魚(Oreochromisniloticus)是上海海洋大學以1994年引入的尼羅羅非魚“GIFT”品系第3代為基礎群體(F0),歷經10年系統選育而成的羅非魚新品種(登記號GS01-001-2005)[12],至2016年已選育至第20代(F20)。目前,該品種已成為我國羅非魚養殖業的主養品種之一。但隨著羅非魚集約化養殖密度的提高,養殖水體中殘餌、糞便等不斷累積,致使部分地區羅非魚長期處于較高含量氨氮的養殖環境中,從而導致其生長性能下降,影響了羅非魚養殖效益[13]。鑒于此,在選育系F20的基礎上,研究氨氮對“新吉富”羅非魚的慢性毒性效應,探索氨氮的慢性脅迫機制已成當務之急。目前,國內外學者在尼羅羅非魚慢性氨氮脅迫方面的研究主要集中在氨氮對尼羅羅非魚幼魚生長[8,14-16]、血清及肝臟生理功能影響[14-17]等領域,但慢性氨氮脅迫對“新吉富”羅非魚生長及生理功能的影響尚未見報道。本研究根據氨氮對“新吉富”羅非魚幼魚的半致死質量濃度和安全質量濃度(待發表資料),采用實驗生態學方法研究不同質量濃度氨氮脅迫對“新吉富”羅非魚幼魚生長性能及血清生化指標的影響,以期為“新吉富”羅非魚的健康養殖提供科學依據。
1 材料和方法
1.1 試驗材料
試驗魚為“新吉富”羅非魚選育系F20幼魚,初始體質量為(38.6±0.2) g,取自上海海洋大學魚類種質研究試驗站。試驗魚用3%氯化鈉和2%碳酸氫鈉消毒,然后放入水族箱暫養14 d以適應環境。投喂寧波天邦公司生產的羅非魚浮性顆粒飼料,含粗蛋白32%。日飽食投喂2次(9:00,16:00)。氯化銨(純度大于99.5%)購自上海生工生物工程技術服務有限公司。
1.2 試驗方法
根據氨氮對“新吉富”羅非魚幼魚的急性毒性試驗的結果(待發表)設定試驗的氨氮質量濃度梯度。以96 h半致死質量濃度(144.287 mg/L)的10%為慢性脅迫試驗的中間質量濃度,將慢性脅迫試驗設4個氨氮質量濃度組,其總氨氮質量濃度分別為7.22、14.43、28.86、57.72 mg/L,同時以未添加氯化銨的正常飼養用水作為對照組。每組試驗魚15尾,設3個平行組。
試驗于0.60 m×0.45 m×0.40 m的玻璃水族箱(試驗實際水體為64.8 L)中進行。以氯化銨準確配置母液,再按試驗設計分別稀釋成各組試驗液。試驗用水為充分曝氣處理的自來水,連續24 h充氣,溶解氧6.5~7.2 mg/L,水溫(28.0±1.0) ℃,pH 7.7±0.2,定時用納氏試劑法[18]測定各組總氨氮質量濃度,并用母液及時調整至試驗設定的表觀質量濃度。在試驗過程中,每日飽食投喂2次(9:00,16:00),早晚定時用虹吸管清除糞便,每晚(18:00)定時更換預先配置成相應質量濃度、等溫的氯化銨溶液,用飽和碳酸鈉溶液使水的pH維持相對穩定。
分別于氨氮暴露的第10、20 d和30 d時自各箱中分別取5尾試驗魚進行生長性狀、血清生化指標分析。測定各項指標前,將試驗魚迅速撈起并投入200 mg/L的間氨基苯甲酸乙酯甲磺酸鹽(Sigma,美國)溶液中進行深度麻醉。
1.2.1 生長性狀測定
分別測定試驗魚的體質量、體長、體高等數據,按下式計算特定生長率[19]:
特定生長率/%·d-1=[(lnm2-lnm1)/(t2-t1)]×100%
式中,m1、m2分別為時間t1、t2時的體質量。
1.2.2 血清生化指標測定
尾靜脈采血后,不加抗凝劑在室溫放置30~40 min,然后3000 r/min,離心10 min,收集上清液。采用南京建成生物工程研究所研發的試劑盒測定血清中谷丙轉氨酶、酸性磷酸酶和堿性磷酸酶的活性,組織蛋白含量采用考馬斯亮藍法測定。
1.3 數據統計
采用SPSS 19.0軟件對試驗數據進行處理分析,結果以平均值±標準差表示,各組間差異用單因素方差分析進行檢驗,并進行Duncan′s多重比較分析,P<0.05為差異顯著。
本試驗中所提及的氨氮是指水環境中的總氨氮質量濃度,由離子銨和非離子氨組成。通常在計算氨氮的半致死質量濃度時還要考慮非離子氨的半致死質量濃度。水體中非離子氨在總氨氮中所占的比例與溫度和pH有關,換算公式如下[20]:
非離子氨質量濃度=A/[10(pKa-pH)+1]
pKa=0.09018+2729.92/T
式中,A為總氨氮質量濃度,pKa為離解常數,T為熱力學溫度(T=273+T℃)。
2 結 果
2.1 生長性能分析
30 d的慢性氨氮脅迫期間,各組別試驗魚均未出現死亡情況。在整個試驗過程中,隨著氨氮質量濃度的升高,各組別試驗魚攝食量呈下降趨勢,其中,低質量濃度組(7.22 mg/L)與對照組間攝食量差異不明顯,高質量濃度組(28.86、57.72 mg/L)攝食量顯著減少,試驗后期出現停止攝食的情況。各組別試驗魚在整個試驗期間的生長性能見表1。5組試驗魚的初始體質量為38.28~38.68 g,30 d時的試驗末體質量為32.13~62.07 g,特定生長率為-0.60%/d~1.58%/d。28.86、57.72 mg/L組試驗末體質量均低于其初始體質量,因此,這2個試驗組的特定生長率均為負值,表明高質量濃度氨氮對試驗魚的生長產生了明顯的抑制。組間試驗末體質量、特定生長率呈現隨氨氮質量濃度升高而遞減的趨勢,即對照組>7.22 mg/L組>14.43 mg/L組>28.86 mg/L組>57.72 mg/L組,Duncan′s多重比較結果均顯示,對照組和7.22 mg/L組間差異不顯著,并且這2組的生長性能顯著高于其他3個試驗組(P<0.05);14.43、28.86 mg/L和57.72 mg/L組兩兩間均存在顯著差異。
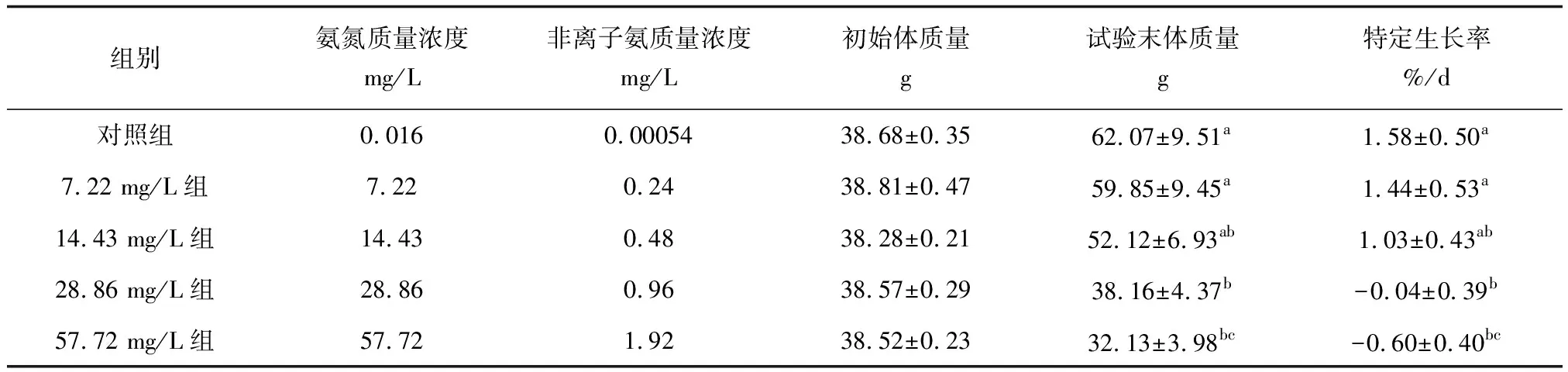
表1 慢性氨氮脅迫下“新吉富”羅非魚幼魚的生長性能
注:同列數據上標字母不同表示差異顯著(P<0.05),字母相同表示差異不顯著(P>0.05).
5組試驗魚在不同時段內的特定生長率變化趨勢見圖1。在0~10 d、10~20 d和20~30 d時段,28.86、57.72 mg/L組的特定生長率均為負值,且57.72 mg/L組的特定生長率最低;在0~10 d和10~20 d時段,對照組特定生長率最高;在20~30 d時段,7.22 mg/L組特定生長率最高。Duncan′s多重比較結果顯示,在所有3個時段內,28.86、57.72 mg/L組的特定生長率均顯著低于其余3個組(P<0.05);在0~10 d時段,對照組、7.22 mg/L組的特定生長率顯著高于14.43 mg/L組(P<0.05);在10~20 d時段,對照組的特定生長率顯著高于7.22、14.43 mg/L組(P<0.05);在20~30 d時段,7.22 mg/L組的特定生長率顯著高于對照組和14.43 mg/L組(P<0.05)。

圖1 不同質量濃度氨氮脅迫下“新吉富”羅非魚幼魚特定生長率的動態變化同一時間段內,上標字母不同表示差異顯著(P<0.05),字母相同表示差異不顯著(P>0.05).
2.2 血清生化指標分析
5組試驗魚血清中酸性磷酸酶活性的動態變化見圖2。在10 d時,7.22 mg/L組的血清酸性磷酸酶活性最高,57.72 mg/L組的血清酸性磷酸酶活性最低,7.22 mg/L組和對照組間血清酸性磷酸酶活性差異不顯著,14.43、28.86、57.72 mg/L組間血清酸性磷酸酶活性差異也不顯著,7.22 mg/L組、對照組的血清酸性磷酸酶活性均顯著高于其他3個組(P<0.05);在20 d時,14.43 mg/L組的血清酸性磷酸酶活性顯著高于其他4個組(P<0.05),7.22 mg/L組、對照組的血清酸性磷酸酶活性均顯著高于28.86、57.72 mg/L組(P<0.05),7.22 mg/L組和對照組間血清酸性磷酸酶活性差異不顯著,28.86、57.72 mg/L組間血清酸性磷酸酶活性差異也不顯著,57.72 mg/L組的血清酸性磷酸酶活性最低;在30 d時,7.22 mg/L組的血清酸性磷酸酶活性顯著高于其他4組(P<0.05),57.72 mg/L組的血清酸性磷酸酶活性最低,14.43 mg/L組和對照組間血清酸性磷酸酶活性差異不顯著,28.86、57.72 mg/L組間血清酸性磷酸酶活性差異也不顯著,14.43 mg/L組、對照組血清酸性磷酸酶活性均顯著高于28.86、57.72 mg/L組(P<0.05)。綜上,7.22、14.43 mg/L組的血清酸性磷酸酶活性分別在30 d和20 d時顯著高于對照組(P<0.05)。在高質量濃度氨氮作用下,28.86、57.72 mg/L組的血清酸性磷酸酶活性在整個試驗過程中均顯著低于對照組(P<0.05),表明這兩個組的血清酸性磷酸酶活性受到了明顯的抑制,氨氮對“新吉富”羅非魚幼魚血清產生了明顯的毒性作用。
5組試驗魚血清中堿性磷酸酶活性的動態變化見圖3。在10 d時,對照組的血清堿性磷酸酶活性顯著高于其他4個組(P<0.05),7.22、14.43、28.86 mg/L間血清堿性磷酸酶活性差異不顯著,且這3組的血清堿性磷酸酶活性均顯著高于57.72 mg/L組(P<0.05);在20 d時,14.43 mg/L組的血清堿性磷酸酶活性顯著高于其他4個組(P<0.05),對照組和7.22 mg/L組間血清堿性磷酸酶活性差異不顯著,并且這2組血清堿性磷酸酶活性均顯著高于28.86、57.72 mg/L組(P<0.05),57.72 mg/L組的血清堿性磷酸酶活性最低;在30 d時,7.22 mg/L組的血清堿性磷酸酶活性最高,對照組和7.22 mg/L組間血清堿性磷酸酶活性差異不顯著,并且這2組血清堿性磷酸酶活性均顯著高于其他3組(P<0.05),14.43、28.86 mg/L的血清堿性磷酸酶活性均顯著高于57.72 mg/L組(P<0.05)。綜上,7.22、14.43 mg/L組的血清堿性磷酸酶活性分別在30 d和20 d時高于對照組。在高質量濃度氨氮作用下,28.86、57.72 mg/L組的血清堿性磷酸酶活性在整個試驗過程中均顯著低于對照組(P<0.05),表明這2組的血清堿性磷酸酶活性受到了明顯的抑制,氨氮對“新吉富”羅非魚幼魚血清產生了明顯的毒性作用。
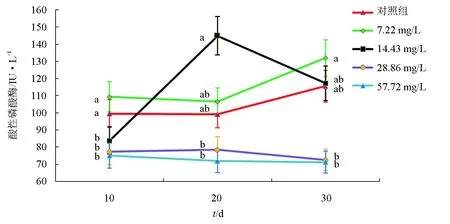
圖2 不同質量濃度氨氮脅迫下“新吉富”羅非魚幼魚血清酸性磷酸酶活性動態變化同一時間內,同列字母相同表示差異不顯著(P>0.05),字母不同表示差異顯著(P<0.05).下同.

圖3 不同質量濃度氨氮脅迫下“新吉富”羅非魚幼魚血清堿性磷酸酶活性動態變化
5組試驗魚血清中谷丙轉氨酶活性的動態變化見圖4。在10 d時,57.72 mg/L組的血清谷丙轉氨酶活性最高,對照組的血清谷丙轉氨酶活性最低,各組間血清谷丙轉氨酶活性差異不顯著;血清谷丙轉氨酶活性在20 d時和30 d時具有相同的變化趨勢,即57.72 mg/L組的血清谷丙轉氨酶活性顯著高于其他4組(P<0.05),血清谷丙轉氨酶活性呈現出隨氨氮質量濃度升高而顯著升高的趨勢,57.72 mg/L組>28.86 mg/L>14.43 mg/L組>7.22 mg/L組>對照組,57.72、28.86、14.43 mg/L組的血清谷丙轉氨酶活性均顯著高于對照組(P<0.05),7.22 mg/L組和對照組間血清谷丙轉氨酶活性差異不顯著。綜上,血清中谷丙轉氨酶活性隨氨氮質量濃度升高和脅迫時間的延長而顯著升高。
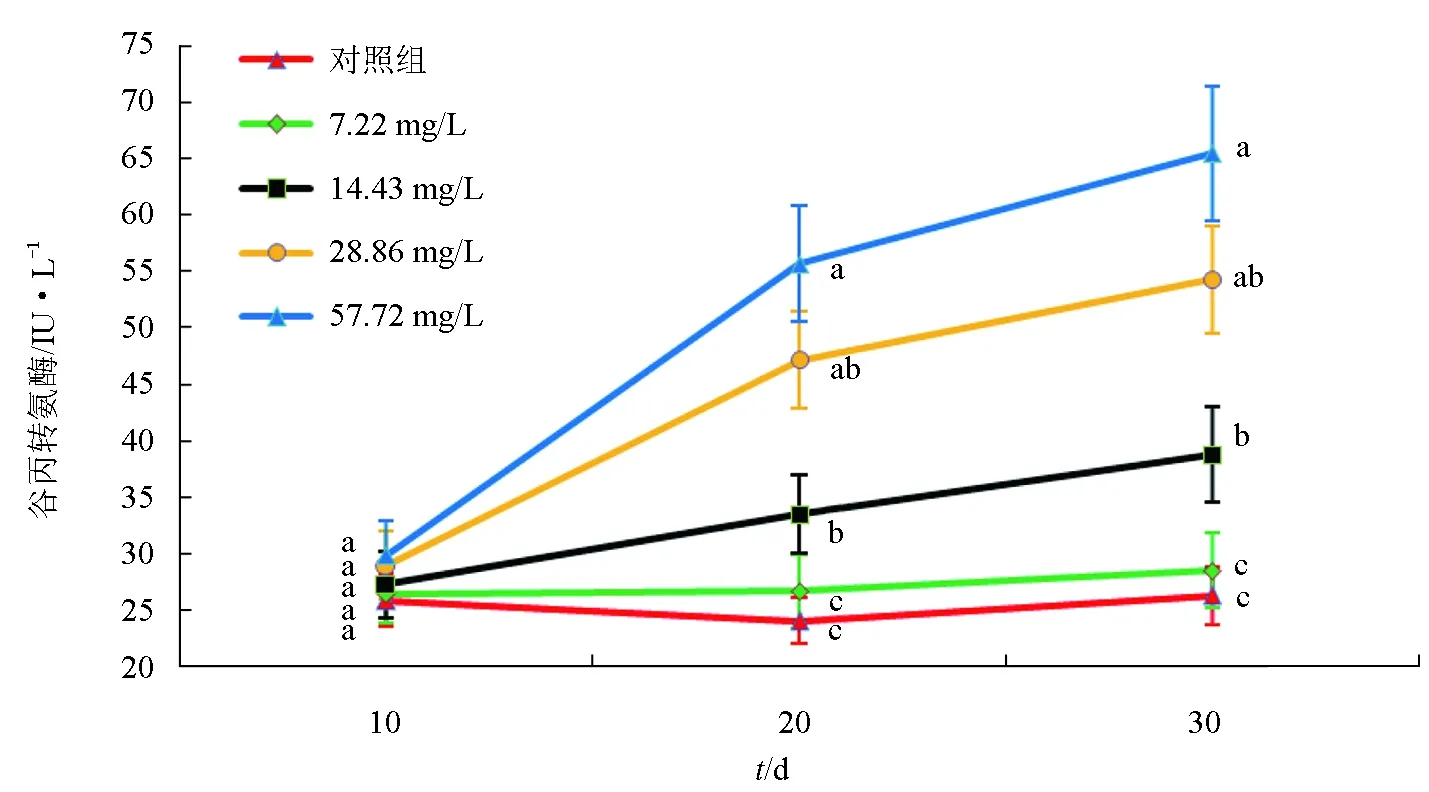
圖4 不同質量濃度氨氮脅迫下“新吉富”羅非魚幼魚血清谷丙轉氨酶活性動態變化
3 討 論
3.1 慢性氨氮脅迫對“新吉富”羅非魚幼魚生長性能的影響
大量研究表明,長期的氨氮脅迫可使魚類生長速度降低,隨著水體中非離子氨含量的升高和脅迫時間的延長,魚類攝食量下降,大部分能量用于機體的消耗,從而導致魚類生長率下降甚至生長停滯[8,21-24]。因此,在集約化養殖生產中,將水體中非離子氨含量控制在不影響魚類生長的安全范圍內顯得尤為重要。所謂安全限制含量,是指對水產動物生長、繁殖和生存沒有明顯影響的非離子氨含量[8]。許多學者通過實驗生態學方法研究了非離子氨對養殖魚類的安全限制含量。Alderson[25]曾報道,非離子氨對歐洲鰨(Soleasolea)和大菱鲆(Scophthalmusmaximus)幼魚的安全限制質量濃度分別為0.066 mg/L和0.11 mg/L。而Szumski等[26]認為,非離子氨對暖水性魚類的安全限制質量濃度為0.08 mg/L。Person-Le Ruyet等[27]報道,非離子氨對大菱鲆幼魚的安全限制質量濃度為0.18~0.33 mg/L。Foss等[21]的研究表明,當非離子氨質量濃度大于0.06 mg/L時,大西洋鱈(Gadusmorhua)幼魚的日攝食量減少,特定生長率顯著低于對照組,大西洋鱈幼魚養殖水體中非離子氨的安全限制質量濃度為0.06 mg/L。Lemarie等[22]研究發現,舌齒鱸(Dicentrarchuslabrax)幼魚質量增加率與非離子氨質量濃度成負相關,養殖水體中非離子氨的安全限制質量濃度為0.26 mg/L。El-Shafai等[8]研究發現,當水體中非離子氨質量濃度高于0.068 mg/L時,尼羅羅非魚幼魚特定生長率顯著低于對照組,由此提出尼羅羅非魚幼魚養殖水體中非離子氨的安全限制質量濃度為0.068 mg/L。本研究中,當非離子氨質量濃度為0.24 mg/L時,試驗魚的特定生長率與對照組間差異不顯著;當非離子氨質量濃度為0.48 mg/L時,試驗魚的生長率顯著低于對照組,與已有研究結果相比,本研究中的“新吉富”羅非魚幼魚能耐受的非離子氨質量濃度相對較高,究其原因,可能是因為魚類對非離子氨的耐受性存在種間差異,也可能與試驗魚規格、養殖密度及試驗條件(如pH、溫度、溶解氧及鹽度等)等不同有關。
此外,在本研究中,當水體中非離子氨質量濃度為0.24 mg/L時,試驗魚在初始階段(0~10 d)、中間階段(10~20 d)和最后階段(20~30 d)的特定生長率分別為1.10%/d、1.23%/d和2.00%/d,呈逐漸升高的趨勢。這一結果與Foss等[21]對大西洋鱈慢性氨氮耐受性的研究結果類似,Foss等[21]研究表明,在整個96 d試驗的初始階段(0~28 d),非離子氨質量濃度為0.11 mg/L和0.17 mg/L試驗組的特定生長率分別比對照組降低11%和23%,而在試驗最后階段(57~96 d),這兩個試驗組的特定生長率分別比對照組降低7%和9%,且與對照組間無顯著差異,試驗組的特定生長率呈緩慢升高的趨勢。在對花狼鳚(Anarhichasminor)[28]和舌齒鱸[22]的慢性氨氮脅迫研究中,也觀察到了類似的現象。產生這種現象的原因,可能是魚類對環境脅迫具有適應和自我調節能力,在慢性氨氮脅迫過程中,魚類機體能逐漸適應非離子氨的毒性,并通過多種方式阻止非離子氨在體內的積累,如減少體內氨的合成、加速氨的排泄、或將氨轉化為無毒的物質[29]。Randall等[30]研究發現,魚類通過減少體內蛋白質水解和氨基酸的代謝可以阻止氨氮在體內的累積。許多魚類通過增加體內谷氨酰胺合成酶的活性使氨氮快速轉化為谷氨酰胺,或者通過鳥氨酸尿素循環將氨氮轉化為尿素[29,31]。
3.2 慢性氨氮脅迫對“新吉富”羅非魚幼魚血清生化指標的影響
血液生化參數是反映魚體健康狀況和生理狀態的主要指標,也是魚類疾病診斷的依據之一,在慢性氨氮脅迫下,水體中的非離子氨通過魚鰓的吸收,進入血液,會對血細胞及血清中的酶類產生影響。酸性磷酸酶是一種對魚類的生理代謝有著重要影響的酶[32],在魚類各組織器官中廣泛分布;堿性磷酸酶主要參與生物體對物質的消化、吸收、轉運,調節動物體內鈣、磷的吸收,維持鈣、磷的平衡,是魚類生長發育的重要酶類之一[33]。酸性磷酸酶和堿性磷酸酶均參與了生物在環境毒物脅迫下產生的適應性反應,常用于評估環境毒物的毒性程度[34]。本研究中,血清中酸性磷酸酶和堿性磷酸酶的活性在慢性氨氮脅迫下的動態變化趨勢基本一致,即7.22、14.43 mg/L組的血清酸性磷酸酶和堿性磷酸酶活性分別在30 d和20 d時高于對照組,28.86、57.72 mg/L組的血清酸性磷酸酶和堿性磷酸酶活性在整個試驗過程中均顯著低于對照組(P<0.05)。究其原因,可能是血清中的酸性磷酸酶、堿性磷酸酶主要來源于血細胞[35],在低質量濃度氨氮(7.22 mg/L)長時間(30 d)脅迫下,或在較高質量濃度氨氮(14.43 mg/L)較長時間(20 d)脅迫下,魚體血細胞受損,其中的酸性磷酸酶、堿性磷酸酶進入血漿;同時,魚體在氨氮脅迫下,可能產生了毒物興奮作用[36],導致酸性磷酸酶、堿性磷酸酶誘導合成,從而引起血清中酸性磷酸酶、堿性磷酸酶活性顯著上升。而在高質量濃度氨氮(28.86、57.72 mg/L)脅迫下,血清的電解質平衡遭到破壞,酸性磷酸酶、堿性磷酸酶誘導作用受到抑制,導致酸性磷酸酶、堿性磷酸酶活性顯著下降,這與Jee等[37]的研究結果類似。本研究表明,“新吉富”羅非魚幼魚血清中酸性磷酸酶、堿性磷酸酶對氨氮具有一定耐受性,但超出生理耐受閾值后,其活性會受到顯著影響。
谷丙轉氨酶是廣泛存在于動物組織細胞內參與氨基酸合成與分解代謝的重要氨基轉移酶,催化谷氨酸與丙氨酸之間的氨基轉換,正常血清中谷丙轉氨酶的活性不高,但當組織細胞,特別是肝臟和心臟等器官的細胞發生病變時,能引起血清中谷丙轉氨酶活性明顯升高。因此,血清谷丙轉氨酶是肝細胞受損最靈敏的指標之一[38],其活性的增減可以反映機體中毒或病理變化。本研究中,血清中谷丙轉氨酶活性隨氨氮質量濃度升高和脅迫時間的延長而顯著升高。這與鯉魚(Cyprinuscarpio)[39]、青魚(Mylopharyngodonpiceus)[40]受氨氮脅迫后的谷丙轉氨酶活性變化趨勢相似。這可能是由于高質量濃度氨氮脅迫導致機體脂質過氧化產物增多,肝細胞腫脹、壞死,管壁細胞與基膜分離、管壁破裂等,影響肝胰腺正常生理功能所致[40-41]。

