對蝦源副溶血弧菌拮抗菌的篩選與評價
甄曉然,沈 輝,萬夕和,蔣 葛,范賢平,喬 毅,史文軍,朱志楊,沙士兵,徐錦忠
( 1.上海海洋大學 水產與生命學院,上海 201306; 2.江蘇省海洋水產研究所,江蘇 南通 226007 )
近年來,隨著對蝦養殖產業迅猛發展,對蝦疾病的發生也日益增多,嚴重制約了對蝦產業的發展[1-2]。凡納濱對蝦(Litopenaeusvannamei)急性肝胰腺壞死綜合征是近年來我國發生較為嚴重的一種蝦類疾病,該病主要是由副溶血弧菌(Vibrioparahemolyticus)感染所引起,患病對蝦出現空腸空胃、肝胰腺萎縮等癥狀,發病率和死亡率較高[3-5]。
生物拮抗是微生物群落內普遍存在的自然現象,利用動物病原菌的拮抗細菌制成有益微生物制劑,拮抗菌與病原菌相互抵制、相互排斥、相互制約[6],對養殖水體中的病原微生物產生拮抗作用,抑制病原菌的生長,改善養殖環境,調節對蝦體內的微生態平衡,具有生物安全和環境友好等優點,在對蝦疾病生物防治領域中的應用越來越多[7]。
筆者自江蘇南部沿海灘涂沉積物中分離到一株對多株凡納濱對蝦急性肝胰腺壞死綜合征病原弧菌具有明顯拮抗效果的細菌,進行菌株的安全性試驗,并對其分類學地位及擴培工藝進行研究,以期為凡納濱對蝦急性肝胰腺壞死綜合征的防控提供技術資料。
1 材料與方法
1.1 試驗材料
14株病原菌分離自江蘇如東患急性肝胰腺壞死綜合征的凡納濱對蝦肝胰腺,鑒定為副溶血弧菌,經人工攻毒試驗證實其具較強的感染力。
1.2 拮抗菌分離與篩選
1.2.1 分離
自江蘇南部沿海灘涂沉積物采集泥樣少許,分別用滅菌生理鹽水進行梯度稀釋,涂布于LB培養基、2216E培養基、高氏一號平板,28 ℃培養24~48 h,分離菌株保存備用。
1.2.2 初篩
取上述副溶血弧菌接種于2216E肉湯培養基,振蕩培養配成1.5×107cfu/mL的菌懸液,滴入無菌2216 E平板,使平板表面展布少許菌懸液。挑取復蘇24 h的待測菌點種于平板。每平板設3個平行,28 ℃培養48 h,觀察點種區附近抑菌透明圈或覆蓋圈的大小。
1.2.3 復篩
重復上述涂布步驟,將初篩效果較好的菌株采用濾紙片法測定拮抗效果,用滅菌鑷子等距離放置4片無菌濾紙片于涂布好弧菌的平板,無菌生理鹽水將拮抗菌發酵液調至3.0×108cfu/mL,向其中3片加入5 μL,另1片加入5 μL生理鹽水作為空白對照,每個平板3 個平行。在28 ℃條件下培養24~48 h,觀察有無覆蓋現象和抑菌圈的出現,用游標卡尺測量覆蓋圈或抑菌圈的直徑。
1.3 菌株鑒定
1.3.1 菌株的形態觀察及生理生化鑒定
參照文獻[8-9]對菌株進行生理生化鑒定。結合分離菌在不同平板上的菌落形態、革蘭氏染色和形態特點,進行細菌的初步鑒定。
1.3.2 16S rDNA序列比對及系統發育分析
采用天根生物專用試劑盒提取純化細菌DNA,16S rDNA序列擴增采用細菌通用引物27 F: 5′-AGA GTT TGA TCC TGG CTC AG-3′,1492 R: 5′-GGT TAC CTT GTT ACG ACT T-3′進行擴增,產物經1%瓊脂凝膠電泳,送至生工生物工程(上海)股份有限公司測序。應用BLAST軟件將所得序列與GenBank中的有關序列進行同源性分析,選取同源性高的序列,利用Mega 5.0進行多重比較后通過鄰接法構建系統發育樹。
1.4 菌株安全性試驗
試驗用凡納濱對蝦幼蝦[平均體長(4.0±0.5) cm]取自如東某養殖場,幼蝦在暫養7 d后隨機分組。試驗處理分浸浴組和投喂組。浸浴組:將待測菌株發酵后用生理鹽水稀釋密度為1×109、1×108、1×107cfu/mL,以0 cfu/mL為空白對照組,所有密度均設3個平行組,每組試驗對蝦30尾;投喂組:所篩選菌株與幼蝦飼料混合,密度調至1×1010、1×109、1×108cfu/g,每個密度梯度設置3個平行組,同時設置空白組,空白對照組投喂生理鹽水混合的飼料,各組試驗對蝦30尾。
試驗進行 10 d,期間水溫(20±1) ℃,鹽度12.0,每日按照對蝦質量的1%投喂飼料。保持充氣,每日吸污,采用平均法記錄10 d試驗中幼蝦的發病癥狀和死亡等狀況。
1.5 菌株生長特性
研究3種培養條件(pH、溫度、鹽度)對拮抗菌H0011生長的影響,并繪制其生長曲線。
1.5.1 pH
將液體培養基pH分別調至3、4、5、6、7、8、9,共7組。按1%接種量將拮抗菌H0011接種于LB液體培養基中,每個pH設置3個平行,180 r/min振蕩培養24 h。取菌懸液梯度稀釋,涂布計數。
1.5.2 溫度
將拮抗菌H0011接種于LB液體培養基中,分別于10、20、25、30、35、40、45 ℃,180 r/min培養 24 h,每個溫度設置3個平行,取菌懸液梯度稀釋,涂布計數。
1.5.3 鹽度
配制0、10、20、30、40、50不同鹽度梯度的LB液體培養基,分別接種拮抗菌H0011,每個鹽度梯度設3個平行,180 r/min培養24 h后,分別取菌懸液梯度稀釋,涂布計數。
1.5.4 菌株生長曲線
按1%接種量將拮抗菌H0011接種于LB液體培養基,180 r/min條件下搖床培養,每隔2 h取樣,梯度稀釋涂布計數,繪制時間與活菌數量的生長曲線。
2 結果與分析
2.1 拮抗菌的分離篩選
在江蘇沿海灘涂分離獲得252株菌,用點種法初步篩選到6株對病原菌具有拮抗作用的菌株,分別為H0011、H0013、H0017、H0027、H0030、H0037。采用濾紙片法進行復篩,獲得1株對14株對蝦急性肝胰腺壞死綜合征病原副溶血弧菌均有拮抗作用的菌株(H0011)。采用菌株H0011發酵液對14株攜帶毒力基因的副溶血弧菌進行抑菌效果分析,抗菌譜結果見表1。

表1 菌株H0011對14株致病性副溶血弧菌的抗菌效果
注:(1)“+++”代表極敏感,“++”代表高敏,“+”代表中敏.(2)抑菌圈(覆蓋圈)直徑> 20 mm為極敏感“+++”;15 mm<直徑<20 mm為高敏“++”;10 mm<直徑<15 mm為中敏“+”;直徑<10 mm為低敏或無效“—”.
2.2 菌株鑒定
2.2.1 菌株的形態特征
菌株H0011在LB平板上24 h生長為直徑1~3 mm的圓形、扁平菌落;菌落呈米粉色、邊緣不整齊,濕潤凸起、表面凹凸不平;短桿狀,革蘭氏陰性。
2.2.2 生理生化結果
菌株H0011生理生化試驗見表2,根據以上結果,按細菌雙歧索引鑒定步驟,該菌鑒定為居幼蟲普羅威登斯菌(Providenciavermicola),鑒定結果的可信度達81.5%。
表2 生化鑒定試驗結果
注:“+”代表“陽性”,“-”代表“陰性”.
2.2.3 16S rDNA基因序列分析以及系統發育樹的構建
采用細菌16S rDNA通用引物對菌株H0011的DNA進行PCR擴增,獲得1443 bp序列。將該序列提交到GenBank,獲得登錄號為MH 922927,使用BLAST在線數據進行序列比對分析,結果顯示菌株H0011與普羅威登斯菌KY 818989.1的親緣關系最近,同源性達99%。選取普羅威登斯菌屬及其他屬與之同源性相近的11株細菌的16S rDNA序列,構建系統發育樹(圖1)。進化樹的結果初步表明,分離獲得的菌株H0011為普羅威登斯菌屬,但未能鑒定到種。

圖1 基于16S rDNA序列的菌株H0011系統發育樹
2.3 安全性試驗
通過高密度脅迫試驗測試篩選普羅威登斯菌H0011的結果見表3。1×108、1×1010cfu/mL浸浴組的凡納濱對蝦,在整個試驗過程中健康,攝食正常,活力良好,無空腸和死亡現象;1×109cfu/mL浸浴組的3組平行中有一組對蝦出現 1 尾空腸現象。投喂組對蝦在整個試驗過程中健康,攝食正常,活力良好,無空腸和死亡現象。試驗期間,浸浴組空白對照組對蝦無死亡,但其中有一組出現1尾空腸現象。108cfu/mL密度以下的各組別之間均無顯著差異(P>0.05)。
2.4 菌株的生長特性
2.4.1 溫度對拮抗菌生長的影響
普羅威登斯菌H0011生長情況見圖2,在10~45 ℃溫度內均能生長。當溫度為10~20 ℃時,生長速度較慢,生長差異較小;而當溫度在20 ℃以后表現出了明顯的生長優勢,且30 ℃時生長速度最快。
表3 普羅威登斯菌H0011脅迫下的凡納濱對蝦試驗結果
圖2 不同溫度下普羅威登斯菌H0011的生長情況
2.4.2 鹽度對拮抗菌生長的影響
普羅威登斯菌H0011在不同鹽度下的生長情況見圖3。在鹽度0~60內均能生長,其中最適生長鹽度為10。在鹽度0~10內,隨著鹽度的升高,普羅威登斯菌 H0011 菌落數逐漸增多,在鹽度10的時候達到最大值;當鹽度>10時,普羅威登斯菌 H0011的菌落數逐漸降低,但生長情況差異不顯著。
圖3 不同鹽度下普羅威登斯菌H0011的生長情況
2.4.3 pH對拮抗菌生長的影響
普羅威登斯菌H0011在不同pH下的生長情況見圖 4。在pH 4~10內均能生長,其中最適pH=8。在pH 4~8時,其生長速度呈上升趨勢,在pH=8時菌落數達到最大值;當pH>8時,普羅威登斯菌H0011菌落數逐漸降低。
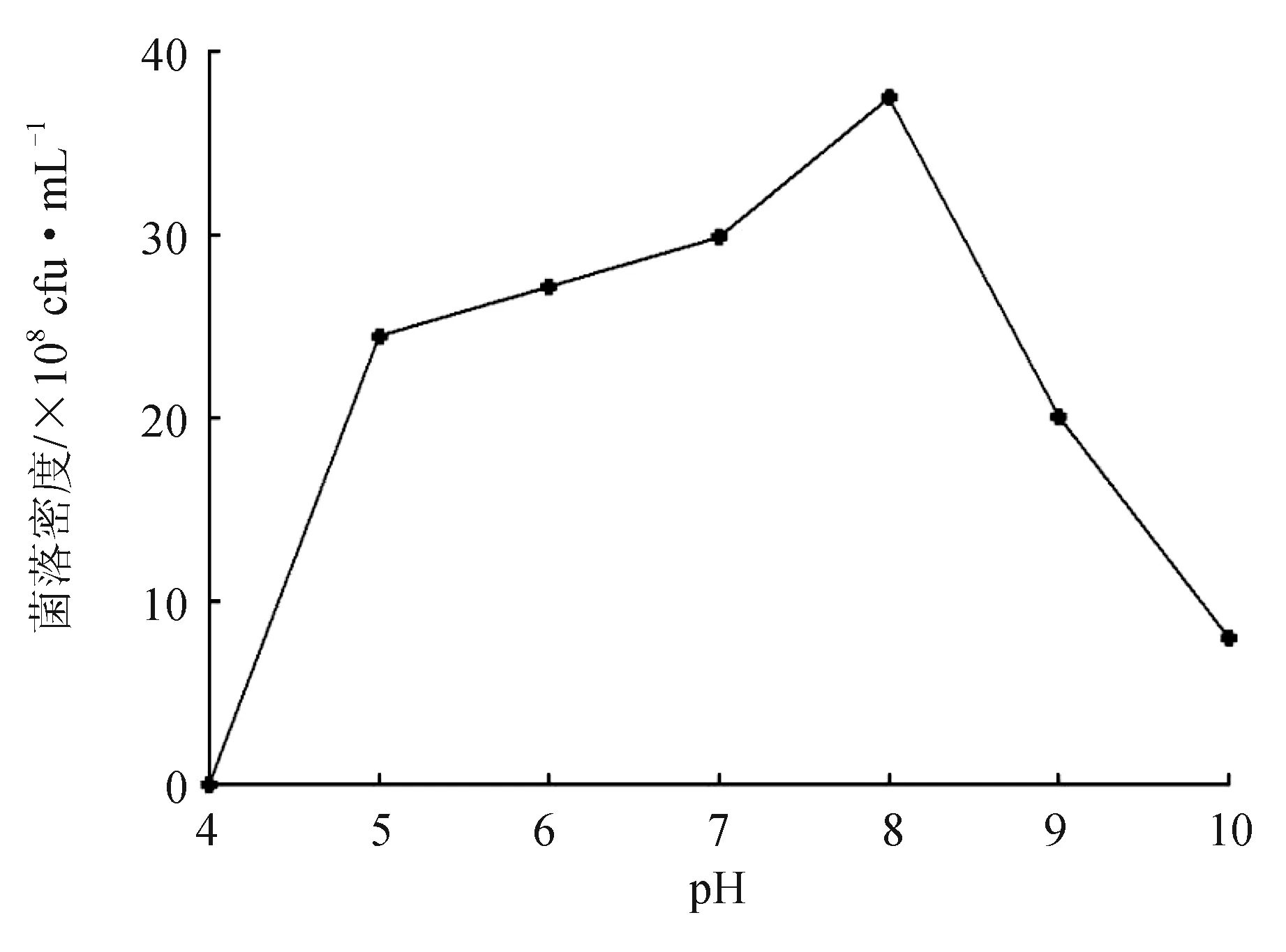
圖4 不同pH下普羅威登斯菌H0011的生長情況
2.4.4 普羅威登斯菌H0011的生長曲線
普羅威登斯菌 H0011的生長曲線見圖5。0~4 h 為遲緩期,4~20 h為生長對數期,菌體快速生長,20 h時菌體數量達最高值,此時菌體代謝活性高且生活力強。此后進入生長穩定期,直到76 h后由于培養基中營養缺乏及有害代謝產物積累,菌體代謝活性逐漸降低,發生衰老并自溶,菌體生長進入衰亡期。細菌發酵培養后密度可達到2.48×1010cfu/mL,且能長時間保持穩定,表明該拮抗菌普羅威登斯菌 H0011 具有良好的生長和活性保持能力。
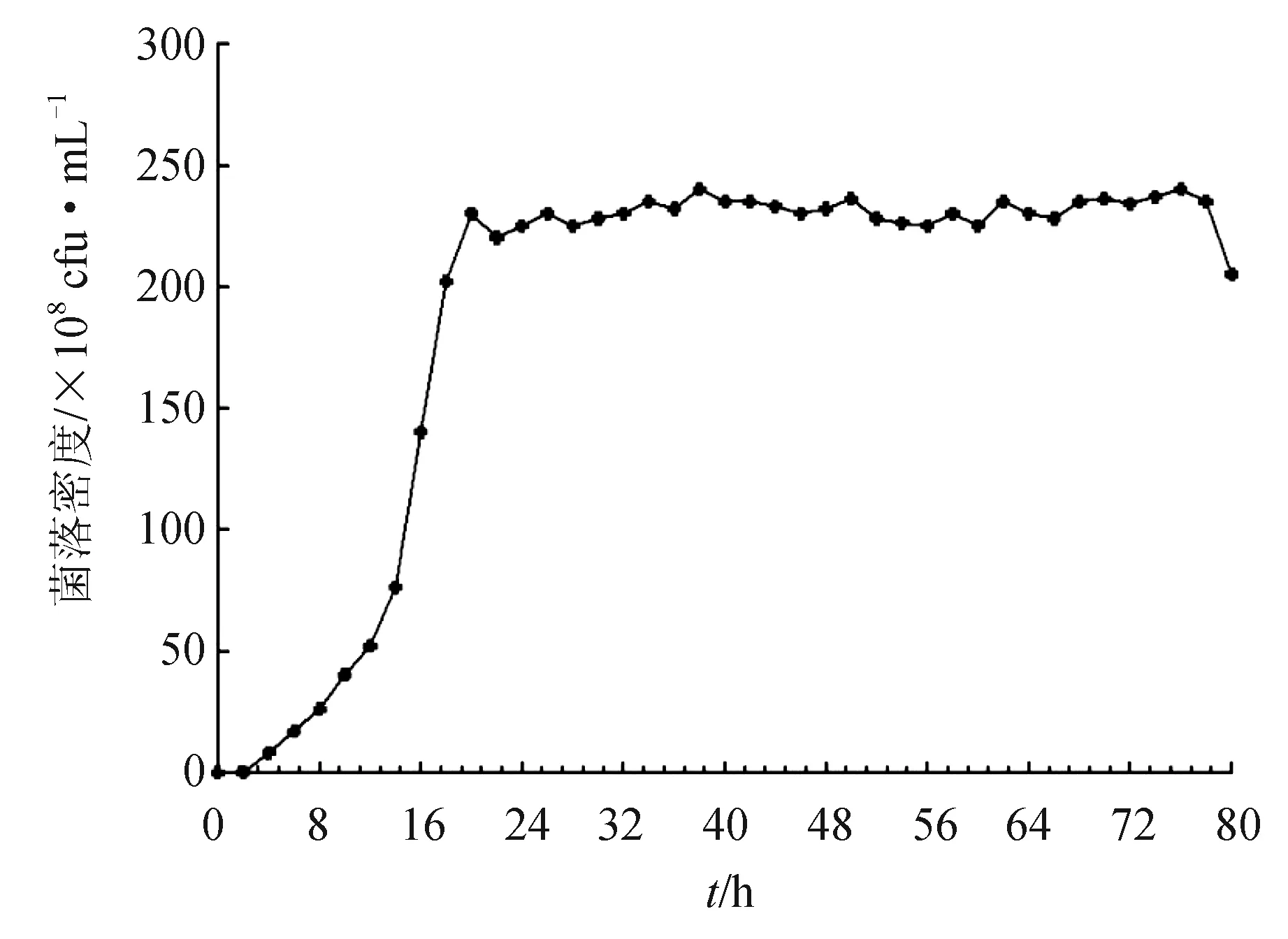
圖5 普羅威登斯菌 H0011的生長曲線
3 討 論
3.1 拮抗菌在水產界的應用
生物間的拮抗關系普遍存在于自然界中,許多海洋細菌對水產養殖中的病原微生物可產生拮抗作用。以拮抗菌為主的微生物制劑可以減少抗生素的使用,抑制病原菌的生長,達到良好的生物防控效果[10]。海洋細菌作為益生菌的研究是當前一個熱點,1966年,Burkholder等[11]發現了第一株有抑菌活性的海洋細菌,隨后越來越多的病原菌拮抗細菌被篩選出。Tanasomwang等[12]自斑節對蝦(Penaeusmonodon)幼體分離篩選出可產生胞外抑菌物質的海洋細菌,對魚類、貝類的致病弧菌有良好的抑制作用。這些菌株作為益生菌被應用于水產養殖病原菌的防治中,均獲得良好的抑制效果。
應用于水產疾病控制且常見的拮抗菌有乳酸桿菌(Lactobacillus)、芽孢桿菌(Bacillus)、雙歧桿菌(Bifidobacterium)和假單胞菌(Pseudomonas)等[13-16],然而針對特定病原的拮抗菌研究相對較少,因此加強病原拮抗菌理論研究和應用開發有助于服務水產養殖業[17]。本研究從江蘇南部灘涂泥樣中篩選到一株對對蝦急性肝胰壞死綜合征弧菌有良好拮抗效果的菌株H0011,經16S rDNA鑒定為普羅威登斯菌,而生理生化鑒定為居幼蟲普羅威登斯菌,但結果可信度為81.5%。由于16S rDNA鑒定可信度可達99%,因此本研究最后將該菌定為普羅威登斯菌,僅鑒定到屬。普羅威登斯菌是腸桿菌科中常見的革蘭氏陰性菌,常被用來作為農業生產中的有益細菌。
3.2 普羅威登斯菌的應用
對于普羅威登斯菌開發利用的有關研究報道較多。普羅威登斯菌可以用來作為植物害蟲的抑制劑,周峰等[18]利用雷氏普羅威登斯菌(P.rettgeri)與營養物質尿素混合后制成 UN06顆粒劑,對番茄根結線蟲(Meloidogyne)、黃瓜根結線蟲、煙草根結線蟲的防效達到90.17%、88.66%和85.98%。Surany[19]發現,在昆蟲的幼蟲到達蛹前階段時,普羅威登斯菌可產生與昆蟲自身的神經分泌調節系統相互作用的物質,抑制或干擾甲殼素的合成,使昆蟲無法完成生命周期并在未成熟階段死亡。普羅威登斯菌在環境保護上的應用也有報道。雷氏普羅威登斯菌可用于含氮有機廢水的處理,有效去除水體中的有機氮、氨氮、亞硝氮及硝氮,并同時實現對有機碳的去除[20]。Mukherjee等[21]自受污染的地下水中分離出一種居幼蟲普羅威登斯菌氏菌(KX926492),對氟的最大去除率達82%。吳小毛等[22]發明了一種利用斯氏普羅威登斯菌(P.stuartii)修復核凈污染的土壤和水體的方法,可解決農產品生產中部分農藥殘留超標問題及環境污染問題。
在水產養殖病害防控領域,陳償等[23]用普羅威登斯菌22號制備了一種防控溶藻弧菌(V.alginolyticus)或副溶血弧菌微生物制劑,用于改善養殖水質,清除養殖系統中的溶藻弧菌或副溶血弧菌,預防養殖疾病的發生。曲凌云等[24]發現了一株雷氏普羅威登斯菌,其在與海水魚類盾纖毛蟲病原共同培養時,能在24 h內殺滅共培養體系中的盾纖毛蟲,為防治海水魚類盾纖毛蟲病的防控提供了新方法。
普羅威登斯菌同時又是一種人類或者動物致病菌,可導致人類下呼吸道或尿路感染[25-27]。有研究發現,雷氏普羅威登斯菌可導致揚子鱷(Alligatorsinensis)發病及大量死亡[28],中越邊境猝死水牛體內也曾分離獲得過拉氏普羅威登斯菌(P.rustigianii)[29]。說明普羅威登斯菌雖在一些方面對人類、動物界、環境等是有益菌,但同時也存在安全隱患。本研究結果表明,所分離獲得的高效拮抗作用普羅威登斯菌H0011在108cfu/mL浸浴組和108cfu/mL投喂組試驗處理過程中,組內對蝦健康,活力良好,未發現死亡現象,該菌株在常規用量內對對蝦是安全的。
3.3 本試驗拮抗菌的優化及應用
一般認為,細菌產生抗菌物質的含量與其生長條件密切相關,如pH、培養溫度等[30],菌體的最適溫度亦是其產生拮抗效果的最適溫度,且pH與拮抗物質的產生也有很大關系,不同抗菌物質在不同pH中產生,其pH活性范圍不同[31]。本研究優化了普羅威登斯菌H0011的生長條件,其最適溫度為30 ℃,最適初始pH為8,最適生長鹽度為10,說明其發酵條件溫和,適合擴大培養,且適合對其做進一步深入的研究,這將為對蝦急性肝胰腺壞死綜合征的防控提供新的思路。
目前,我國凡納濱對蝦養殖生產中急性肝胰腺壞死綜合征病情十分嚴峻,利用拮抗機理進行以菌抗菌防治有顯著效果,未來應用前景可觀。本試驗針對凡納濱對蝦急性肝胰腺壞死綜合征所獲得的益生菌普羅威登斯菌H0011,可以作為拮抗作用菌在對蝦養殖生產中進行應用,在當前凡納濱對蝦急性肝胰腺壞死綜合征的防控應具有較好的應用價值。

