一株虹鱒源烏爾新不動桿菌的分離鑒定與其感染的病理損傷
吳春艷,任思宇,汪開毓,蒲華靖
( 1.重慶三峽職業學院,重慶 萬州 404155; 2.四川農業大學動物醫學院,四川 成都 611130; 3.重慶市開州區水產技術推廣站,重慶 開州 405400 )
不動桿菌(Acinetobacter)是一類短棒狀的革蘭氏陰性短桿菌,屬奈瑟氏菌科,廣泛分布于自然環境中[1]。此前,該菌通常被認為是一類低毒力的條件性致病菌,主要引起人類的皮膚組織感染與尿路感染;近年來,人們發現它們具有多重藥物抗藥性和強烈的宿主抵抗力,常在醫院內,尤其是在重癥監護病房中導致獲得性肺炎、腦膜炎及敗血癥的發生,成為了醫療過程中難以解決的難題[2]。目前,在醫療領域不動桿菌的研究集中在毒力因子與耐藥性機理上;在水生動物中,人們重在關注該菌感染后的臨床癥狀與治療時的藥物選擇,如王世震等[3]進行了短須裂腹魚(Schizothoraxwangchiachii)感染不動桿菌后的診斷與防治研究,毛芝娟等[4]進行了匙吻鱘(Polyodomspathula)不動桿菌感染的耐藥性分析,陸文浩等[5]進行了銀鯽(Carassiusauratusgibelio)不動桿菌感染的分離鑒定與藥物敏感性分析,丁利等[6]進行了烏龜(Mauremysnigricans)不動桿菌感染的分離鑒定與藥敏分析。而對養殖的虹鱒(Oncorhynchusmykiss)因不動桿菌感染發病的案例卻鮮有報道。
近幾年,虹鱒已成為我國冷水魚養殖的重要種類,尤其在冷水資源豐富的西南地區,該魚的養殖發展迅速。在重慶,虹鱒的養殖集中在渝東北及渝東南片區,尤其以彭水、石柱及開縣、城口的養殖最成規模,養殖模式為集約化的流水養殖。因該魚對水溫與水質環境要求苛刻,養殖中疾病頻發,給從業者造成了嚴重的困擾[7]。筆者在進行重慶地區名特優魚類疾病調查的過程中發現,開州區譚家鎮的泰旭農業有限公司虹鱒養殖基地,于2016—2018年期間發生持續性的虹鱒死亡,臨床表現為,食欲下降,離群獨游,鰓有大量的黏液及附著物,鰭條蛀蝕脫落,尾鰭基部充血、出血,并伴有嚴重的腸道炎癥。筆者對此次發病進行了病原的分離,并對病原菌進行了生理生化鑒定,16S rRNA及rpoB基因的序列測定與系統發育分析,及耐藥性的觀察與組織病理損傷的研究,以助于探明病因及病程發展規律,為防治虹鱒不動桿菌病積累基礎資料。
1 材料與方法
1.1 材料
病魚取自重慶市開州區譚家鎮泰旭農業冷水魚養殖基地,體質量為0.4~2.1 kg;健康魚購自重慶市萬州區漁灃生態漁業有限公司,體質量為80~120 g。藥敏紙片購自杭州天和微生物試劑有限公司;綿羊血采自重慶三峽職業學院竹園農場經檢疫合格的健康綿羊;細菌生化微量鑒定管購自杭州微生物試劑有限公司。
1.2 病原菌分離純化
無菌條件下,用接種環挑取發病虹鱒的肝、腎與潰爛處的組織,劃線接種于LB平板上,20 ℃恒溫培養24 h后,挑取單一的優勢菌落進行純化培養,獲得純化菌株K180411。
1.3 回歸感染試驗
選取暫養15 d后,健康無病癥的虹鱒進行浸泡感染,試驗分為正常組與處理組(處理組刮下魚體尾柄處的部分鱗片)。正常組100尾,共設4個小組(Z1、Z2、Z3與對照組),除對照組不設平行外,每個小組為30尾,分成3個平行組。處理組與正常組的設置一致,編號為C1、C2、C3與對照組。處理組中C1、C2、C3試驗組菌液密度依次為8×106、4×106、1×106cfu/mL,正常組中Z1、Z2、Z3試驗組菌液密度與處理組一致,也依次為8×106、4×106、1×106cfu/mL,對照組均為曝氣后的自來水。養殖水體控制為溫度20 ℃,pH 7.0~7.5,溶解氧>5 mg/L。試驗過程中禁止投喂飼料,觀察并記錄虹鱒的健康狀況,對發病及死亡個體進行細菌分離鑒定。
1.4 病原菌的生理生化特性鑒定和基因序列測定及系統發育分析
參照《伯杰氏細菌鑒定手冊》與文獻[8],對菌株K180411進行生化鑒定。將菌株K180411接種于用綿羊血細胞制作的血平板上,觀察菌株的溶血特性。用LB液體培養基沖洗收集純化的菌株K180411,提交至生工生物工程(上海)股份有限公司進行PCR擴增和16S rRNA與rpoB測定,序列結果在GenBank中進行Blast比對分析,并采用MEGA 7.0進行系統發育樹的構建與分析。16S rRNA、rpoB基因的擴增引物分別為5′-AGAGTTT GATCCTGGCTCAG-3′/3′-TACGGCTACCTTG TTACGAC-5′[9]、5′-CCTTCATGACCTGGAAYG GNTA-3′/3′-TCCAGGATCTGNCCNACRTTC AT-5[10]。
1.5 自然發病魚類臨床癥狀與病理損傷研究
取發病魚類鰓絲、潰瘍組織、及體表黏液附著物進行壓片觀察,并采集自然發病虹鱒的肝、腸、脾與鰓等組織,固定于4%的中性福爾馬林溶液中,采用蘇木精—伊紅染色法進行組織病理學研究。
1.6 藥敏試驗
采用比濁法將菌株K180411制成密度為1.0×107cfu/mL的菌液,涂布接種于LB平板上,用滅菌后的鑷子將藥敏紙片粘貼于平板表面,20 ℃恒溫培養36 h,測量平板上的抑菌圈,判斷該細菌的藥物敏感性。
2 結果與分析
2.1 病原菌分離與回歸感染
從自然發病虹鱒的肝、腎及體表潰爛處均分離到了一株優勢菌株,編號為K180411。20 ℃培養24 h后,可見菌落在LB平板上形成直徑約為1 mm的半透明菌落;鏡下觀察,菌體呈雙球狀,革蘭氏染色陰性,細菌大小為(0.9~1.6) μm×(1.3~2.2) μm。
回歸感染中,C1處理組在第10 d開始發病,C2、C3處理組分別在13、17 d表現出癥狀,對照組未出現變化,感染及死亡情況見表1。病檢結果顯示,回歸感染發病魚類癥狀與自然發病魚類一致。在回歸感染的虹鱒肝與體表潰爛處分離到與菌株K180411理化性質一致的菌株,表明該菌對虹鱒具有致病性。Z3正常組在第9 d有1尾魚表現出癥狀,其余各組均未出現病變,可能是在試驗魚轉運、處理過程中因操作的原因導致損傷而引起的。
2.2 病原菌生化特性鑒定系統發育分析
將菌株K180411接種于5%的脫纖維綿羊血平板,24 h后菌落周圍形成典型的β溶血環(圖1)。生化特性檢測顯示,菌株枸櫞酸鹽反應陽性,無法水解七葉苷,不能利用麥芽糖、葡萄糖、精氨酸,硝酸鹽還原反應為陰性等。除溶血特性外,其余指標與Laurent等[8]報道的的烏爾新不動桿菌(A.ursingii)一致(表2)。
圖1 菌株K180411的溶血特性觀察
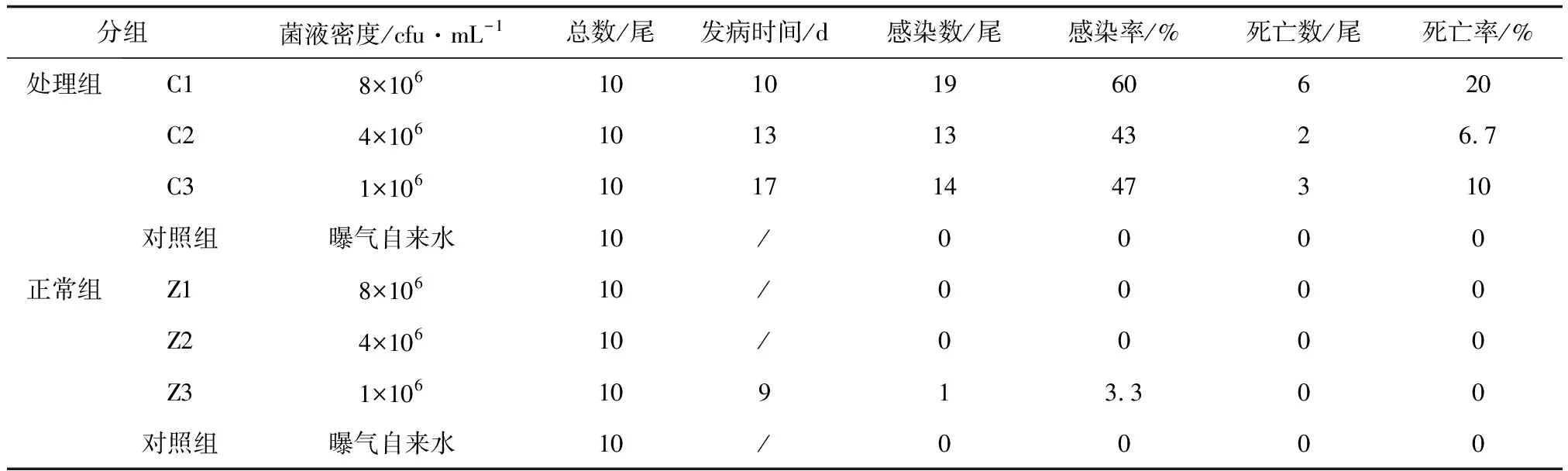
表1 K180411回歸感染試驗結果
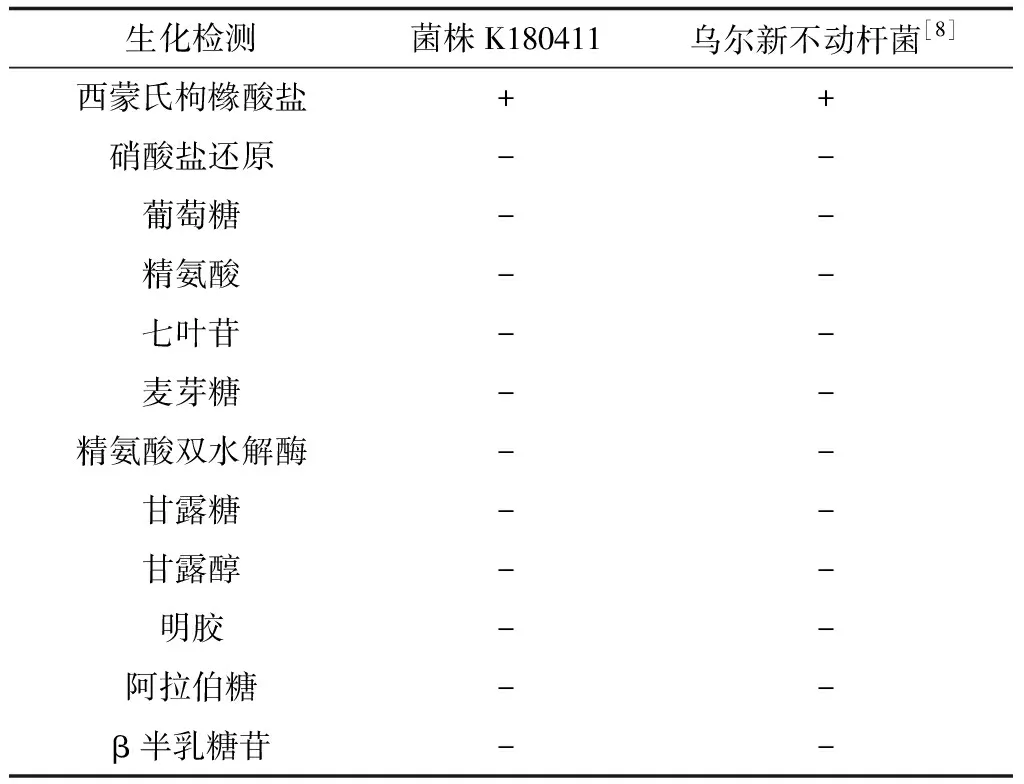
表2 K180411表型特征與已報道的烏爾新不動桿菌的比較
16S rRNA與rpoB基因擴增,分別得到1468 bp與921 bp的PCR產物(圖2),將生工生物工程(上海)股份有限公司測序的結果在GenBank中進行Blast比對分析,用Mega 7.0進行系統發育樹的構建。16S rRNA結果顯示,菌株K180411與新生兒重癥病房中分離的不動桿菌屬未命名菌株NR116070同源關系最近,與已命名的烏爾新不動桿菌MH113156親緣關系最近(圖3)。rpoB的結果顯示菌株K180411與烏爾新不動桿菌KJ789099的親緣關系最近(圖4)。據此,綜合生化特性鑒定、16S rRNA及rpoB基因的系統發育分析結果,鑒定此次發病病原菌為烏爾新不動桿菌。
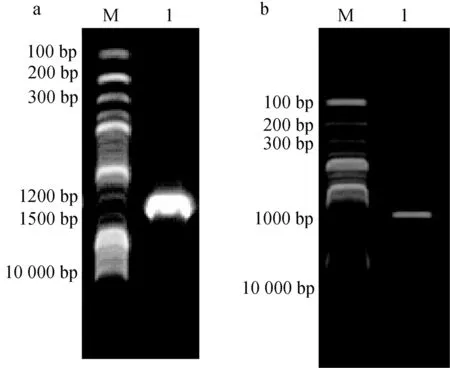
圖2 菌株K180411的16S rRNA與rpoB基因PCR擴增a.16S RNA; b.ropB基因; M.Marker
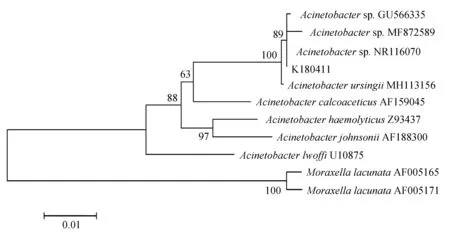
圖3 菌株K180411的16S rRNA序列系統發育樹
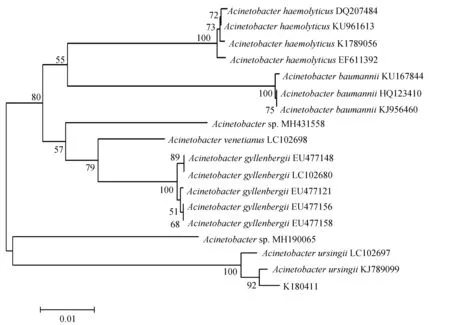
圖4 菌株K180411的rpoB基因系統發育樹
2.3 自然發病虹鱒的病理學檢查與病理損傷研究
發病虹鱒精神沉郁,游動遲緩,漂浮于水面。體表出現大量的褪色斑(圖5a),胸鰭基部及尾鰭基部肌肉出血明顯,尾鰭腐爛嚴重,肉眼可見骨條(圖5b);脾發黑腫大(圖5c);腸道嚴重充血,腸壁組織炎癥明顯,呈半透明狀(圖5d)。顯微鏡下檢查自然發病魚類的鰓絲、黏液及潰瘍灶組織,未見寄生蟲和真菌。組織學觀察發現鰓組織損傷明顯,鰓小片上皮細胞腫脹脫落,甚至出現鰓小片斷裂,暴露出鰓絲軟骨(圖5e);腸腔中可見壞死脫落的腸道組織,黏膜層結構大面積缺失,僅局部可見殘余的腸絨毛,黏膜下層水腫、裸露,組織間隙增寬,結締組織變性紅染呈均質無結構狀(圖5f);肝細胞脂肪變性嚴重,局灶性壞死明顯(圖5g);脾竇內充滿紅細胞(圖5h)。
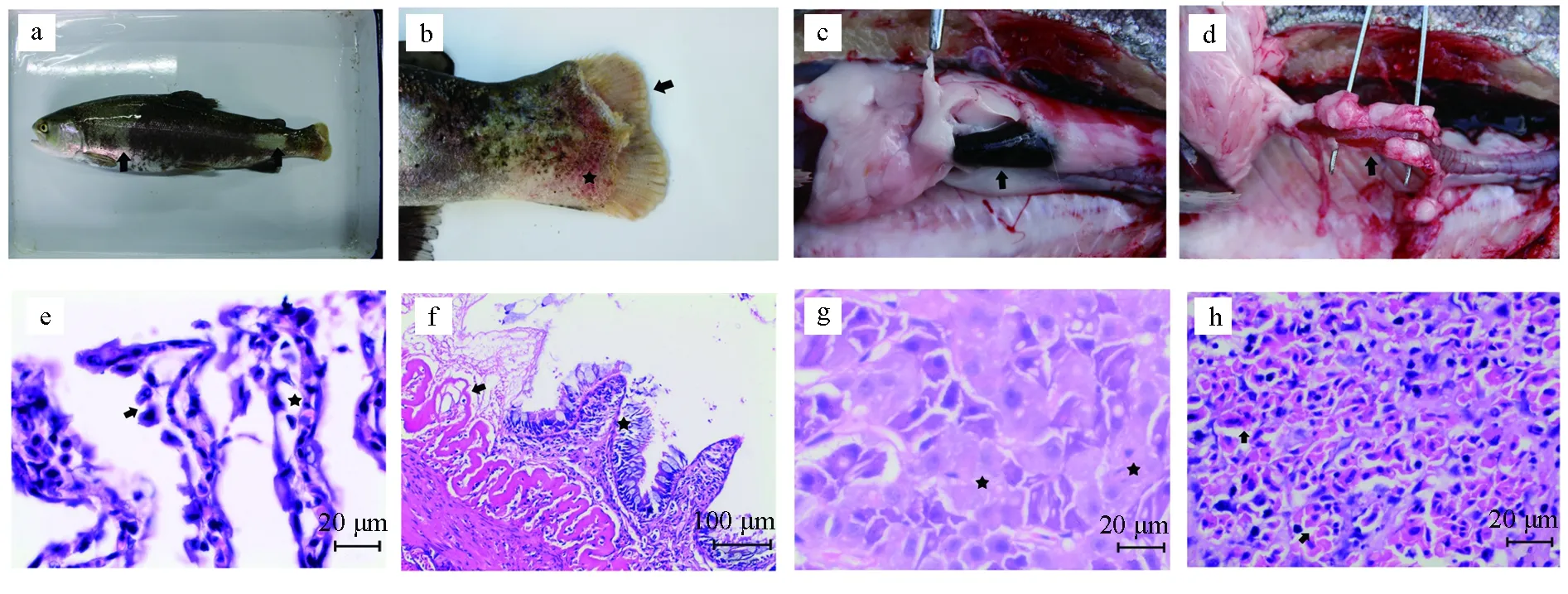
圖5 自然發病虹鱒病理學檢查與組織學研究a.病魚體表出現褪色斑(箭頭);b.尾鰭蛀蝕,尾柄處糜爛(箭頭),基部充血(星標);c.脾發黑腫大(箭頭);d.腸炎明顯,腸組織充血,變薄呈半透明狀(箭頭);e.鰓小片上皮細胞腫脹脫落(箭頭),組織間隙增寬(星標);f.柱狀上皮細胞腫脹脫落(星標),腸絨毛斷裂、黏膜下層裸露(箭頭);g.肝細胞局灶性壞死(星標);h.脾竇充血,脾組織水腫(箭頭).
2.4 藥敏試驗
藥物敏感性試驗結果表明(表3),烏爾新不動桿菌K180411對環丙沙星、頭孢噻肟、左氧氟沙星、恩諾沙星及卡那霉素敏感,對磺胺異噁唑、鏈霉素、青霉素、阿莫西林、氨芐西林、氟苯尼考、多西環素耐藥。
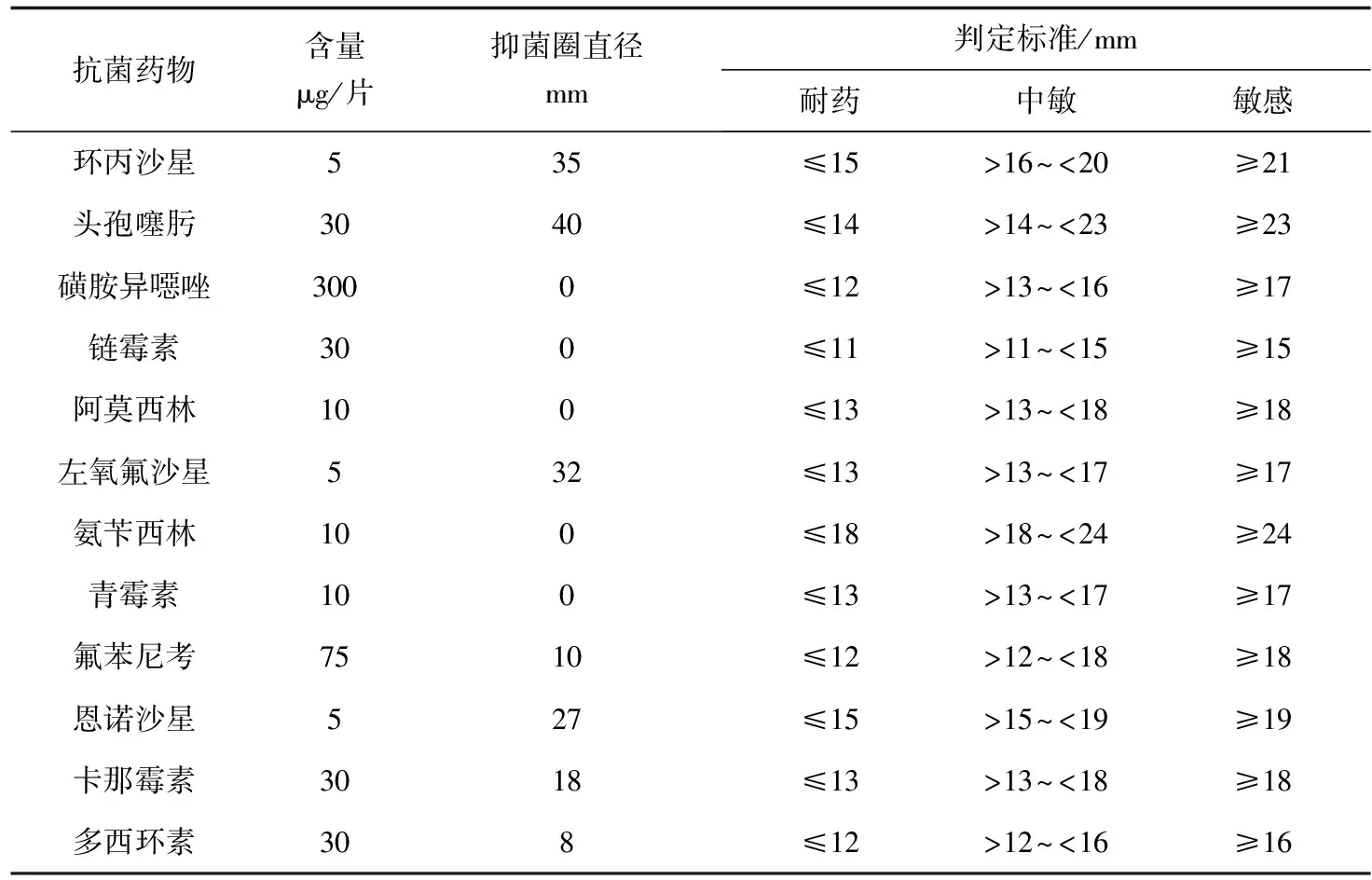
表3 烏爾新不動桿菌K180411藥物敏感性試驗結果
3 討 論
不動桿菌是一大類的細菌種屬,被報道的已超過50種,且種間的生化特性差異巨大[11],近幾年在水產上研究與報道的均為鮑曼不動桿菌引起的疾病,而一些小眾的不動桿菌感染卻未有報道。目前人們常使用Vitek 2 system、API與Phoenix等方法通過表型的差別以進行不動桿菌種間的鑒別,但效果大多不能令人滿意[12],甚至出現不動桿菌與產堿桿菌(Alcaligenesfaecalis)之間的混淆[1,13],因此分子手段的鑒別至關重要。16S rRNA的比對分析是目前分類鑒定常用的依據之一, Chiu等[1,14]的研究證明,16S rRNA的比對分析在屬的層面上鑒定不動桿菌具有可靠的正確率,但由于過于保守而無法進行準確的種間鑒別[15],因此rpoB、gyrB與recA基因常被用作種間的鑒別,尤其是rpoB基因,因其高度的可變性,被學界推薦為不動桿菌種間鑒別最值得參考的基因[10,16-18]。本研究中,16S rRNA的系統發育分析顯示,菌株K180411與未命名的不動桿菌NR116070的同緣關系最近。盡管菌株NR116070未被命名,但Alexandr Nemec等[19]認為,菌株NR116070應該被認定為烏爾新不動桿菌。rpoB基因的分析也表明,菌株K180411與已報道的烏爾新不動桿菌在一個譜系。因此,綜合生化特性鑒定、16S rRNA及rpoB基因的系統發育分析結果,鑒定此次發病病原菌為一株烏爾新不動桿菌。根據資料顯示,本研究為國內外首次對烏爾新不動桿菌引起水產動物感染發病的報道。另外,此次研究發現烏爾新不動桿菌K180411與文獻[19]報道的烏爾新不動桿菌在溶血特性上有差別,說明在烏爾新不動桿菌種內也存在著理化性質的差異,這與Alexandr Nemec等[19]的研究結果一致。
研究表明,不動桿菌是健康三角帆蚌(Hyriopsiscumingii)與銀鯽腸道中常駐的優勢菌群[20],Omoloma等[21]也證實,在健康虹鱒腸道中不動桿菌是常駐菌之一。這說明當水生動物處于健康狀態時,大多數不動桿菌不具致病性。其他領域的研究也發現,該菌的感染主要繼發于外傷、慢性疾病或免疫系統受損之后[22]。回歸試驗的結果也表明,烏爾新不動桿菌K180411可在魚體損傷之后引起發病,說明對水產養殖動物而言,體表損傷是該菌感染的一個重要途徑,這可能與不動桿菌在外膜蛋白A等毒力因子的幫助下形成生物膜,增強了病菌的黏附力有關[23-25]。組織學研究發現,發病虹鱒腸道上皮組織大面積壞死脫落,鰓上皮組織嚴重損傷,并伴有肝組織彌漫性腫脹壞死,這與斑點叉尾(Ictaluruspunctatus)[26]感染不動桿菌后肝臟受到嚴重損傷的結果相符。但遺憾的是,在已報道的不動桿菌引起水產動物疾病的資料中,均只進行了臨床癥狀的描述,而未作組織病理學的研究[3-4,27];因此,該病的發病機制與病理損傷過程尚需進一步的探索。
近幾年,世界衛生組織糾正了以前對不動桿菌低毒力、低危害的認知,而將其認定為最危險的致病菌之一[28],因其具有復雜的耐藥機制,如青霉素結合蛋白、泵出系統、氨基糖苷類修飾酶系統及膜通透性改變等,使之對大多數抗生素具有天然的抗性[29],且對很多敏感的藥物也能夠迅速的產生耐藥性[30],導致治療非常困難。本次藥敏試驗結果顯示,恩諾沙星等藥品對烏爾新不動桿菌K180411有效,但臨床治療期間,恩諾沙星的治療效果并不理想,這可能與其復雜的耐藥機制有關系。蔡香菊等[31]研究表明,黃芩、黃蓮與五倍子等中草藥及復方制劑對不動桿菌有較好的殺菌作用,或許中草藥將會成為防治不動桿菌疾病的重要途徑。

