應用磁共振T2弛豫自旋標記技術研究多巴胺D4受體-616位點單核苷酸多態性對原發性夜間遺尿癥患兒腦氧代謝的影響
肖珊珊,黃明珠,張 旭,侯 陽,于 兵
(中國醫科大學附屬盛京醫院放射科,遼寧 沈陽 110004)
原發性夜間遺尿癥(Primary nocturnal enuresis,PNE)在5歲以上的兒童中發病率高達15%[1],給患兒帶來長期持續性的心理創傷,嚴重影響患兒的身心發育和生活質量。近年來,針對PNE的家系研究表明,遺傳因素在PNE的發病中起著重要作用[2]。我們的研究發現多巴胺受體D4基因(Dopamine receptor D4,DRD4)啟動子區多態性位點-616C/G(rs747302)單核苷酸多態性(Single nucleotide polymorphism,SNP)可能與PNE的發病有相關性[3],但是rs747302基因型與PNE患兒腦氧攝取的相關性研究,截至目前未見報道。本研究擬應用T2弛豫自旋標記(T2-relaxation-under-spin-tagging,TRUST)技術[4],結合DRD4-616C/G基因型檢測,探索rs74-7302基因型對PNE患兒腦氧攝取率(Oxygen extraction fraction,OEF)以及腦氧代謝率(Cerebral metabolic rate of oxygen,CMRO2)[5]的影響。
1 資料與方法
1.1 研究對象
本研究選取2016年2月—2017年12月我院就診的60例PNE患兒,及60例在年齡、性別、受教育程度方面與PNE患兒組匹配的對照組正常兒童。本研究計劃獲得我院倫理委員會許可(批準號2013PS24K)并在其監督下進行,所有參加研究兒童的家屬或者其法定監護人簽署知情同意書后參與研究。
入組PNE患兒遺尿癥狀符合國際兒童排尿節制學會(ICCS)診斷標準:每周夜尿≥3次,持續6月以上,日間能夠控制排尿,而入睡后無法自主控制排尿,排除泌尿系統器質性疾病[6]。所有參加研究兒童智商(IQ)>85;無神經及精神疾病病史;無睡眠呼吸異常病史;無服用任何典型或非典型精神活性藥物史。
1.2 數據采集
1.2.1 DRD4-616C/G基因型分析
全體受試兒童采集外周靜脈血5 mL,采用EDTA抗凝,提取基因組DNA操作使用Biomiga公司生產的基因組DNA提取試劑盒(EZgene TM Blood gDNA Miniprep Kit,Biomiga Inc.,San Diego,CA,USA)。使用ABI 9700 PCR擴增儀(Perkin-Elmer,Norwalk,CT,USA),采用等位基因特異性擴增技術檢測DRD4基因上游5’端啟動子區-616 C/G多態性,基因擴增引物分別采用F:GAACCTACCCCGGCCTGTCGT、R:AGACGGGAATGAAGCGAGGTGG、C specific:TGGTCGCGGGGGCTGAGC、G specific:CCCCCCMGCAGCCTCTGGYC及其退火溫度均為69℃。PCR擴增C特異性產物片段長度415 bp,G特異性產物片段長度267bp,共有產物片段長度645bp。因為人群中CC基因型的頻率很低,因而將CC和CG基因型受試兒童合并為C等位基因攜帶組(C組),將G純合子(GG)受試兒童定為G組進行深入統計分析。
1.2.2 磁共振掃描數據處理
受試兒童脈搏血氧儀測定動脈血氧飽和度(SPO2)后,立即應用Philips Ingenia 3.0T超導型磁共振掃描系統及16通道SENSE頭線圈進行MRI掃描。應用TRUST序列測算被試兒童的靜息態OEF,參數如下:TR 1 978 ms,eTE 1,40,80,160 ms,FOV:220mm,矩陣:64×64,層數:1層,軸向層厚:5mm,掃描層面位于竇匯上方20 mm,平行于前后聯合連線(AC-PC),掃描時間72 s。
采用霍普金斯大學醫學院放射科陸漢璋教授團隊撰寫,基于Matlab平臺運行的軟件包,對TRUST圖像進行后處理,首先對數據進行運動校正,然后對標記圖像和未標記圖像進行配對相減以獲得上矢狀竇內的血液信號。之后對不同eTE的上矢狀竇內的血液信號進行指數擬合,換算出T2,R2(1/T2)以及R2的95%可信區間(圖1)。如果受試者R2的95%可信區間>10(說明原始數據受嚴重干擾,通常是頭動所致,所以R2計算結果不可信),則排除該患者的數據。之后,根據陸漢璋教授的血氧含量與T2的換算方法,得出靜脈血氧含量Yν[7]。根據公式OEF=(SPO2-Yν)/SPO2計算所有被試兒童的OEF。
相差法掃描來測算腦平均血流量(CBF)。具體步驟如下:首先通過3D時間飛躍法(TOF)頸部MRA掃描定位雙側頸內動脈和椎動脈;之后分別垂直上述4支血管進行相位對比法(PC)掃描,掃描層數為1層,像素大小=0.5 mm×0.5 mm×5 mm;FOV=200 mm×200 mm×5 mm;最大流速=40 cm/s;每支血管掃描時間15.2 s。
應用陸漢璋教授編寫的PC法掃描圖像后處理程序,對相位圖進行后處理,手工劃定所掃描的頸部血管作為感興趣區,計算頸部血管的血流速度及血管截面積,根據4支頸部血管的血流速度及血管截面積,計算全腦總血流量。應用VBM8軟件包,根據3D T1WI圖像,計算腦實質體積(灰質及白質);根據Herscovitch的研究結果,設定腦實質平均密度1.06。最后根據全腦總血流量,腦實質體積及腦實質密度,計算CBF(圖1)。
得出CBFmean和Yν之后,根據菲克原理(Fick principle)計 算CMRO2:CMRO2=CBF×(Yα-Yν)×Hct。Hct:紅細胞比容。
1.3 統計學分析
以分組(PNE/正常對照)和基因型(C/G)作為可能的影響因素,將年齡、接受教育時間和IQ作為協變量,對CBF,Yν及OEF數據進行協方差分析,計算分組及基因型這兩個影響因素的主效應及交互效應。如果交互效應顯著,則進一步進行Post-Hoc檢驗,檢驗PNE和對照組各自組內不同基因型被試兒童SPO2,Yν或OEF的差異,采用Bonferroni法對Post-Hoc檢驗進行多重比較校正,以校正后P<0.05作為具有顯著性差異。
2 結果
4例PNE患兒以及2例正常對照組兒童R2的95%可信區間>10,他們的基因型數據和影像數據均不被統計。列入統計的被試基因檢測結果見表1,他們的基本情況(年齡、接受教育時間和IQ)見表2。
協方差分析發現Yν、OEF以及CMRO2分組×基因型交互效應顯著(F1,110=6.513,P=0.012 1;F1,110=6.888,P<0.001;F1,110=13.01,P<0.001),Post-Hoc檢驗發現結果攜帶C等位基因的PNE患兒OEF以及CMRO2值顯著低于G純合子PNE患兒(t=-5.976,Padjusted<0.001;t=-5.594,Padjusted<0.001);Yν顯著高于G純合子PNE患兒(t=5.863,Padjusted<0.001),而不同基因型的正常對照組兒童之間無顯著差異(圖2,表3)。

表1 所有被試DRD4-616位點基因檢測結果
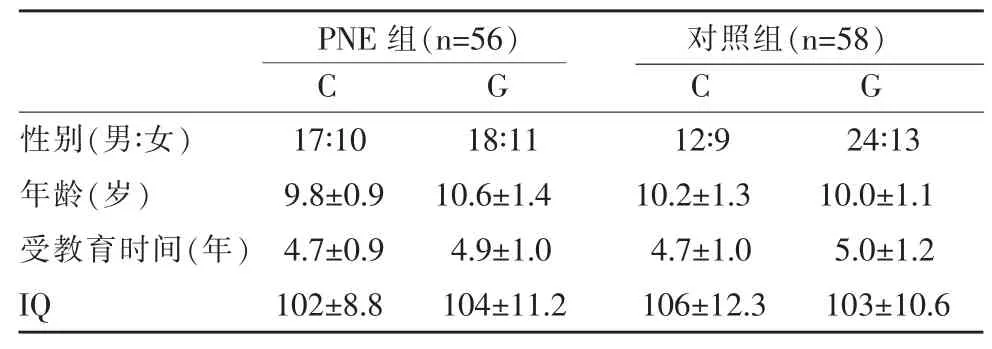
表2 所有被試基本情況
3 討論
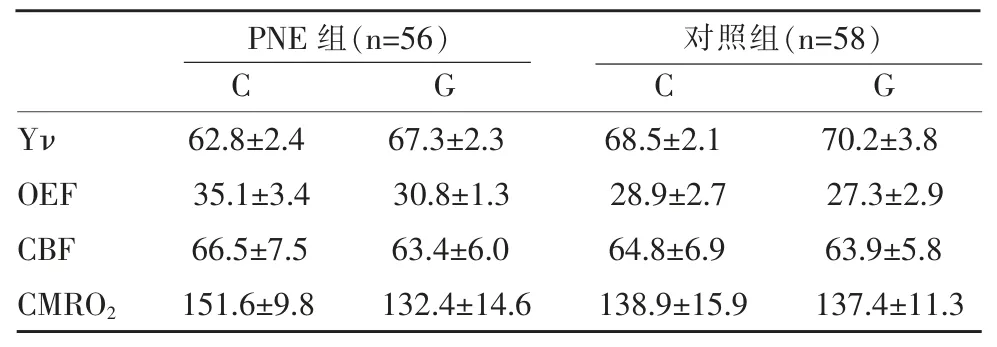
表3 所有被試腦氧代謝情況
近幾年發展起來的TRUST是一種有用的技術,通過測量靜脈血中T2獲得上矢狀竇中靜脈血氧含量的定量值,它對血氧的變化很敏感,并應用于各種生理及病理條件下。靜脈氧含量與動脈氧含量和腦血流結合時可以估計重要的生理參數,例如氧攝取分數和氧的腦代謝率,反映組織活力和功能。TRUST技術測量Yν結果的可重復性已經被多中心大樣本研究所驗證[8]。

圖1 TRUST掃描與圖像后處理。圖1a:TRUST的掃描定位。圖1b:TRUST數據后處理以后得到的上矢狀竇血液信號。圖1c:不同eTE的上矢狀竇內的血液信號進行指數擬合。圖1d:采用相位對比法(PC)進行雙側頸內動脈和椎動脈掃描。Figure 1.TRUST MRI scan and image post-processing.Figure 1a:The imaging slice of the TRUST MRI scan.Figure 1b:The blood signal in the superior sagittal sinus after the TRUST data post-processing.Figure 1c:Monoexponential fitting of blood signal in the superior sagittal sinus as a function of effective echo time(eTE)results in T2estimation.Figure 1d:Bilateral internal carotid artery and vertebral artery scan by phase-contrast MRI method.
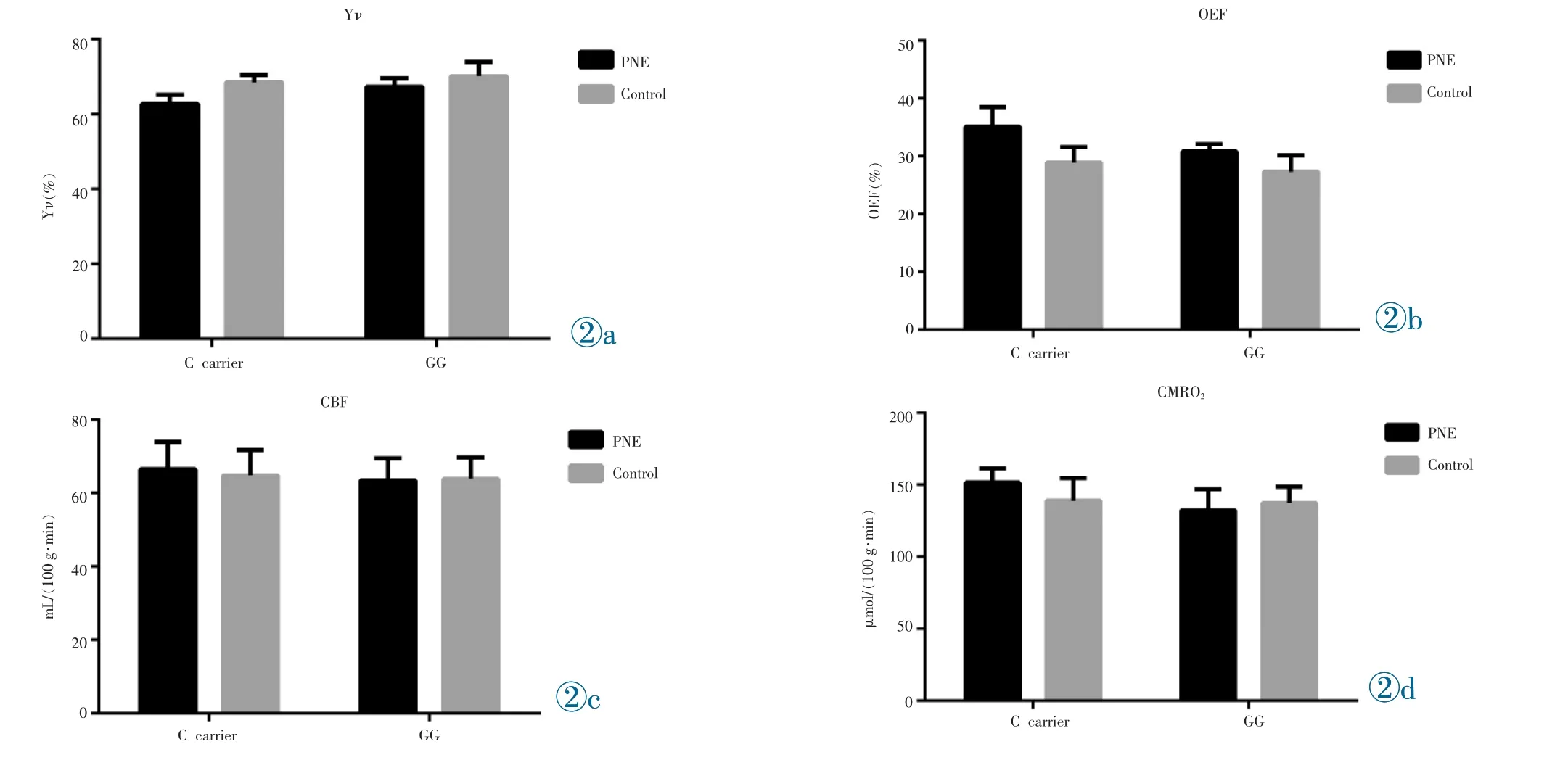
圖2 DRD4-616-C/G SNP對PNE患兒腦氧代謝的影響。圖2a:DRD4-616-C/G SNP對PNE患兒Yν的影響。圖2b:DRD4-616-C/G SNP對PNE患兒OEF的影響。圖2c:DRD4-616-C/G SNP對PNE患兒CBF的影響。圖2d:DRD4-616-C/G SNP對PNE患兒CMRO2的影響。Figure 2.The effect of DRD4-616-C/G SNP on brain oxygen metabolism in children with PNE.Figure 2a:The effect of DRD4-616-C/G SNP on Yνin children with PNE.Figure 2b:The effect of DRD4-616-C/G SNP on OEF in children with PNE.Figure 2c:The effect of DRD4-616-C/G SNP on CBF in children with PNE.Figure 2d:The effect of DRD4-616-C/G SNP on CMRO2in children with PNE.
我們的研究發現DRD4-616C等位基因攜帶的PNE患兒OEF和CMRO2都顯著升高,提示這些兒童氧耗量升高,而且相對缺氧。我們推測:DRD4啟動子區基因多態性影響了DRD4蛋白表達,進而影響DRD4蛋白的數量與功能[9],進而影響PNE患兒腦發育過程中對無效及低效突觸連接的修剪[10-11],這些冗余突觸致使C等位基因攜帶的PNE患兒腦氧耗量偏高及相對缺氧。而缺氧導致了PNE患兒在睡眠期間喚醒閾升高[12]。致使PNE患兒在睡眠期間對膀胱充盈的信號不能產生有效的覺醒反應,從而導致遺尿。
我們的研究同時發現DRD4-616C/G SNP僅僅影響了PNE患兒腦氧代謝。對正常對照組兒童沒有影響,這可能是由于突觸修剪受多種神經遞質和神經受體影響,雖然正常兒童中C等位基因攜帶者也存在DRD4蛋白的異常,但可能被別的神經遞質所代償;而PNE患兒中的C等位基因攜帶者卻缺乏相應代償機制,所以表現出了腦氧耗量以及缺氧。
我們的研究還存在較多局限性,首先,由于樣本數目有限,而且C等位基因純合子的頻率很低,因而我們在研究中將CC和CG合并為一組,這樣合并可能造成一定程度的遺傳效應混淆。其次,我們的腦氧代謝數據是在患兒靜息狀態下采集的,靜息狀態下發現的CBF異常,是否在睡眠狀態下依然存在,還需要應用同步EEG-PET或者EEG-MRI采集技術,深入進行睡眠狀態下的影像研究。再次,本研究測得的PNE患兒腦氧代謝參數只是全腦范圍的平均值,而無法精確地對不同腦區的腦氧代謝狀況進行詳細評估。為了深入研究PNE患兒的腦氧代謝異常,我們還需要結合睡眠監測及隨訪,進行深入、大樣本的隊列研究。

