72例通滯蘇潤江膠囊藥物不良反應報告分析
殷娜 張云芳 許蒙蒙 寧桃麗

摘要:目的 ?探索通滯蘇潤江膠囊所致藥物不良反應(ADR)的發生特點及規律,為臨床合理用藥提供參考。方法 ?回顧性調研河南省洛陽正骨醫院2009年1月-2018年3月72例通滯蘇潤江膠囊ADR發生情況,并對相關數據進行統計分析。結果 ?72例ADR病例中,40歲以上患者居多(79.17%);聯合用藥ADR發生率(58.33%)高于單用藥(41.67%);77.78%發生在用藥后24 h內;胃腸道損害發生率最高(55.91%),其次為神經系統損害(16.13%)和皮膚及附件損害(13.98%)。結論 ?臨床應加強通滯蘇潤江膠囊的用藥監測,積極開展用藥宣教,以保障患者用藥安全。
關鍵詞:通滯蘇潤江膠囊;不良反應;監測;分析
中圖分類號:R288 ???文獻標識碼:A ???文章編號:1005-5304(2019)11-0129-03
Abstract: Objective To explore the features and regularity of adverse drug reactions (ADR) induced by Tongzhi Surunjiang Capsules; To provide references for rational medication in clinical practice. Methods Retrospective survey for 72 cases of ADR occurred in Henan Luoyang Orthopedic Hospital caused by Tongzhi Surunjiang Capsules from January 2009 to March 2018 was conducted. The data were collected and analyzed. Results Among 72 cases, 79.17% of them were above 40 years old. The ADR induced by drug combination (58.33%) was higher than single drug (41.67%). ADR mostly occurred within 24 h (77.78%). The main clinical manifestations of these ADRs were digestive system damage (55.91%), followed by nervous system damage (16.13%) and skin and its accessories damage (13.98%). Conclusion Monitoring should be strengthened for Tongzhi Surunjiang Capsules in clinic and medication education should be actively carried out, in order to ensure the safety medication of patients.
Keywords: Tongzhi Surunjiang Capsules; adverse drug reactions; monitoring; analysis
通滯蘇潤江膠囊源于維醫經驗方,由番瀉葉、秋水仙、訶子、盒果藤、巴旦仁、西紅花、司卡摩尼亞脂等組成,具有開通阻滯、消腫止痛等作用,臨床主要用于治療關節骨痛、風濕病、類風濕關節炎、坐骨神經痛等。2018年,原國家食品藥品監督管理總局發布了“關于修訂通滯蘇潤江制劑說明書的公告”(2018年第33號),對通滯蘇潤江制劑說明書增加警示語,對【不良反應】【禁忌】【注意事項】及特殊人群用藥等項進行修訂,并要求生產企業對新增藥物不良反應(ADR)發生機制開展深入研究。為此,筆者對河南省洛陽正骨醫院(以下簡稱“本院”)2009年1月-2018年3月上報72例通滯蘇潤江膠囊涉及ADR報告進行回顧性分析,探究其涉及ADR發生規律及相關因素,為保證臨床用藥安全、防范用藥風險提供參考。
1 ?資料與方法
利用國家藥品不良反應監測系統網(http://www. adrs.org.cn/)提取2009年1月-2018年3月本院上報的72例通滯蘇潤江膠囊涉及ADR報告,作為研究對象。
參照國家ADR監測中心分類評價方法,運用Excel2003對患者性別、年齡、合并用藥、ADR發生時間、ADR累及器官/系統及臨床表現、結果及轉歸等數據進行匯總及統計。
2 ?結果
本次調研的72例報告中,新發生ADR為50例(69.44%),有既往ADR史或家族ADR史2例(2.78%)。給藥方式均為口服。
2.1 ?患者性別及年齡分布
72例ADR中,男性25例(34.72%),女性47例(65.28%);年齡最小16歲,最大87歲,平均年齡54歲,具體見表1。
2.2 ?聯合用藥
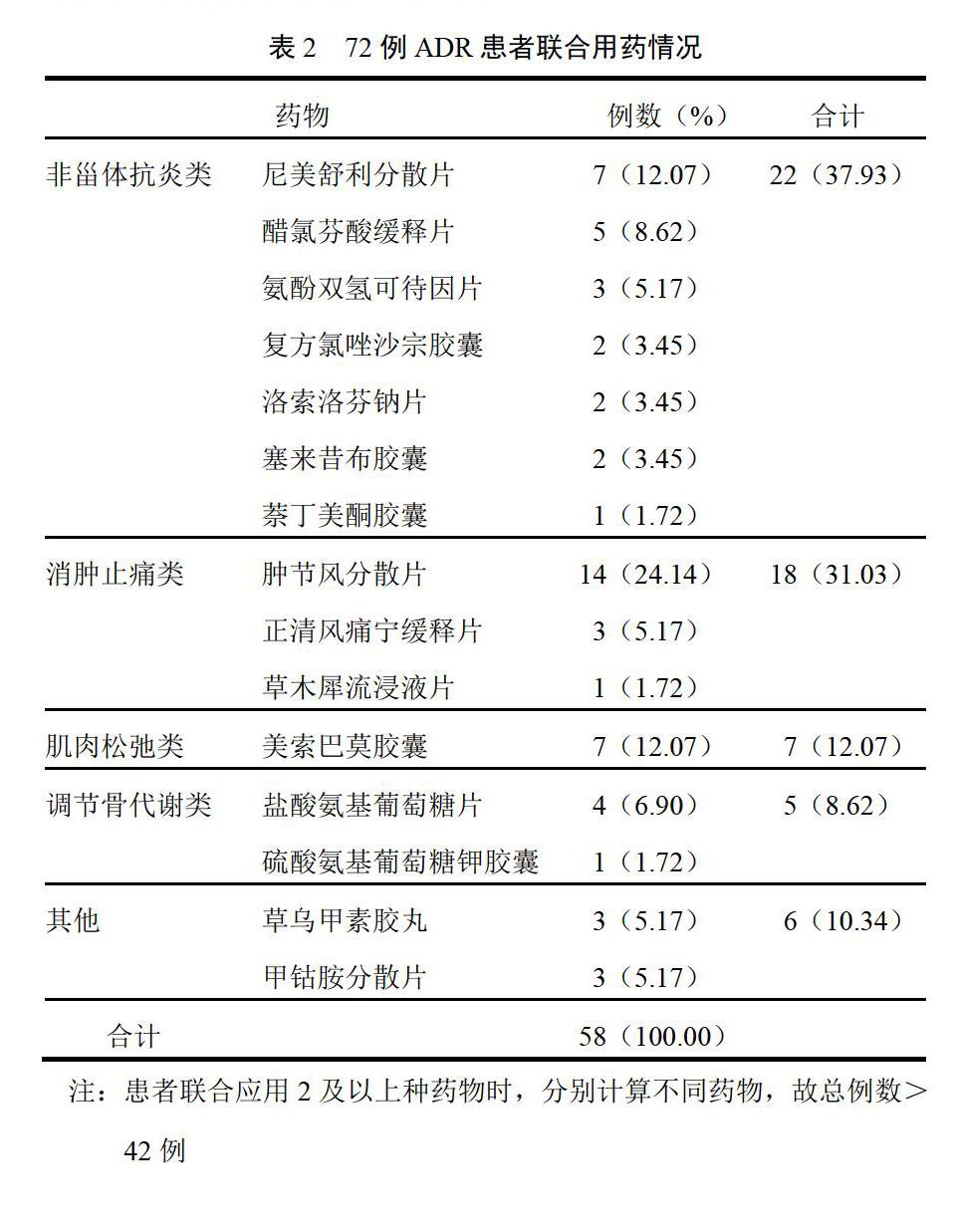
72例ADR中,42例(58.33%)聯合應用其他藥物,其中26例(61.90%)聯合應用1種藥物,16例(38.10%)聯合應用2種藥物。所涉及藥物種類包括非甾體抗炎藥、消腫止痛類、肌肉松弛類、調節骨代謝類及其他類藥物,詳見表2。
2.3 ?藥物不良反應發生時間分布
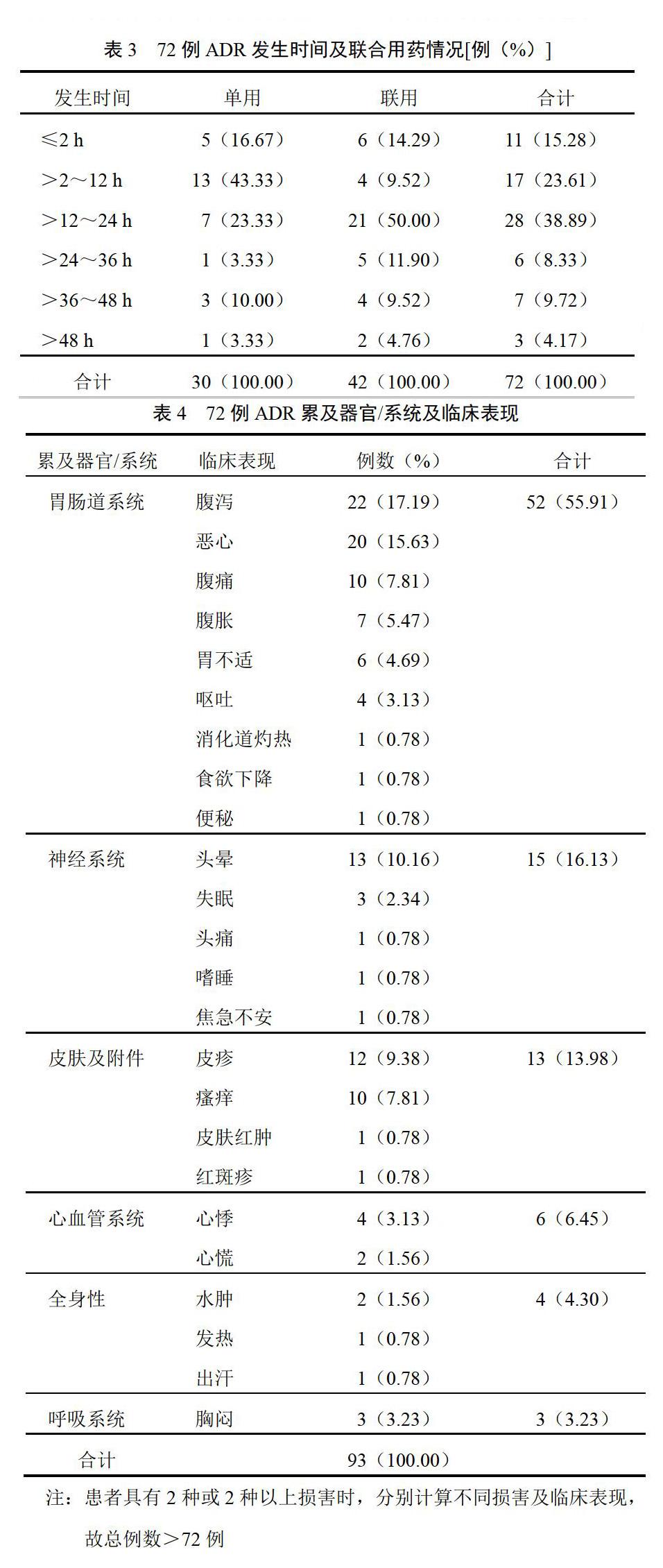
72例ADR中,16例(22.22%)于首次服藥后發生,用藥后各時間段發生ADR例數及構成比見表3。
2.4 ?藥物不良反應累及器官/系統及主要臨床表現
72例ADR報告中累及器官/系統6項,共發生93例(部分ADR涉及多個器官/系統,因而出現多種臨床表現),其對應例數及主要臨床表現詳見表4。
2.5 ?藥物不良反應關聯性及轉歸
72例ADR中,很可能的有23例(31.94%),可能的有49例(68.06%)。出現ADR后,31例(43.06%)患者給予停藥或相應處理后痊愈,41例(56.94%)患者癥狀有所好轉。
3 ?討論
3.1 ?藥物不良反應發生與性別、年齡關系
本次調研所統計的時間段內,女性ADR多于男性,男女比例約0.53∶1,其原因尚待進一步研究。通滯蘇潤江膠囊涉及ADR在各年齡段均有分布,但發生于40歲以上的中老年人群例數較多(79.17%),其原因可能與中老年患者肝腎功能減退,藥物的代謝、排泄速度相對遲緩,以及中老年患者基礎疾病較多,合并用藥情況較為復雜等因素有關。此外,老年人關節骨痛、風濕病、類風濕關節炎等患病率較高,用藥人數較其他年齡段多,因而出現ADR幾率也有所增加。因此,建議臨床醫生用藥前權衡用藥利弊,尤其女性與老年人,孕婦、哺乳期和經期婦女禁用;患有慢性腹瀉、痢疾者禁用;骨髓造血功能不全,嚴重心臟病,肝、腎功能不全及胃腸道疾病患者慎用。
3.2 ?藥物不良反應發生與聯合用藥關系
72例ADR中,58.33%患者聯合應用1種或1種以上藥物,其中聯合應用最多的品種為非甾體抗炎類(37.93%),其次為消腫止痛類(31.03%)及肌肉松弛類(12.07%)。由于非甾體抗炎藥可通過抑制環氧合酶-1活性、直接損傷胃黏膜、增加白三烯合成等途徑引起胃腸道損害。另外,通滯蘇潤江膠囊中的秋水仙也易引起胃腸道系統的不良反應[1]。因此建議醫生盡量精簡處方,如確需聯合用藥,則應綜合考慮藥物間相互作用及患者身體狀況,以防止ADR。
3.3 ?藥物不良反應發生時間
72例ADR中,77.78%發生在用藥后24 h內,其中22.22%發生在首次服藥后,說明通滯蘇潤江膠囊涉及ADR易發生在用藥起始階段。因此,藥師在工作中應做好用藥宣教、ADR收集及信息預警工作,提高醫護人員、患者對合理用藥及ADR的認識,加強患者自我用藥監測,用藥過程(尤其是用藥后24 h內)如有不適情況,應及時停藥并就醫,以避免ADR對患者造成進一步的傷害。
3.4 ?藥物不良反應累及器官/系統情況
通滯蘇潤江膠囊涉及ADR臨床表現多樣,涉及多個器官/系統,其中52例(55.91%)涉及胃腸道系統損害,15例(16.13%)涉及神經系統損害,13例(13.98%)涉及皮膚及附件損害。這與藥品說明書所記載“偶見發燒、心悸、無力、食欲減退、惡心、嘔吐或腹脹”及文獻報道具有一致性[2-3],但也有未記載的頭暈、失眠等神經系統損害,以及皮疹、瘙癢等皮膚系統損害等,因而醫生開具處方時應嚴格按照藥品說明書所記載的適應證及用法用量,避免患者長期連續用藥;藥師應協助積極開展用藥宣教、ADR監測及ADR信息反饋工作,促進臨床合理用藥,避免出現嚴重ADR的重復發生。同時生產企業應加強藥物追蹤監測,不斷深入研究、改進工藝、提高質量,有效保障臨床安全用藥。
4 ?小結
作為骨傷科常用品種,通滯蘇潤江膠囊在本院使用量較大,因缺乏用藥人次及用藥例次的相關數據,故本次調研未能對其引發ADR比率作出評估,有待今后研究完善。此外,對于2018年原國家食品藥品監督管理總局發布的“關于修訂通滯蘇潤江制劑說明書的公告”中警示語項下列出的“本品含秋水仙、司卡摩尼亞脂”,筆者檢索相關文獻資料,尚未發現有關司卡摩尼亞脂的ADR、副作用或用藥警示,有待進一步研究。
參考文獻:
[1] 陶曉璇,李剛,張增珠,等.秋水仙堿致不良反應的文獻分析[J].中國藥業,2016,25(2):84-85,86.
[2] 周俊,肖微,吳銳,等.通滯蘇潤江膠囊治療急性痛風性關節炎有效性與安全性的系統評價[J].風濕病與關節炎,2016,5(2):21-27.
[3] 潘旭,王培,許保海.通滯蘇潤江膠囊不良反應分析[C]//北京積水潭醫院.北京中醫藥學會2015年度學術年會論文集.北京:北京中醫藥學會,2016:347-348.
(收稿日期:2018-05-25)
(修回日期:2019-01-27;編輯:梅智勝)

