CT聯合實時超聲引導經皮穿刺活檢胸膜或胸膜下結節
劉 君,趙艷軍,張 雷,劉 妍,李 薇
(南京醫科大學附屬無錫第二醫院影像科,江蘇 無錫 214002)
胸膜或胸膜下結節(small pleural or peripleural nodule, SPPN)常表現為平行于胸膜的扁平增厚,其臨床及影像學表現均缺乏特異性,常需進行病理組織活檢才能明確診斷[1]。CT已廣泛用于引導經皮胸部穿刺,但傳統CT引導不能實時監視穿刺過程、顯示病灶隨呼吸運動的位置變化,使得活檢SPPN的技術難度較活檢肺深部病灶更高[2-4]。超聲具有可實時引導、無電離輻射損傷及多方位成像的優點,已用于活檢胸膜或胸膜下腫塊[5-6];但超聲探頭的窗口一般較窄,常不能同時兼顧穿刺點及病灶,且易受鄰近肋骨和含氣肺組織的干擾,故較少用于單獨引導活檢SPPN。本研究探討CT聯合實時超聲引導穿刺活檢SPPN的可行性。
1 資料與方法
1.1 一般資料 回顧性分析2016年1月—2019年3月于我院接受經皮穿刺活檢的38例SPPN患者的臨床及影像學資料,男30例,女8例,年齡26~85歲,平均(65.3±13.4)歲。納入標準:胸膜病灶或肺內病灶緊貼胸膜,與胸膜接觸面長度>1 cm;結節最大徑<3 cm或彌漫胸膜增厚>5 mm;術前胸部CT增強掃描排除血管性病變及病灶內動靜脈瘺;能夠配合檢查。對其中17例行CT聯合超聲引導下活檢(CT+US組),男14例,女3例,平均年齡(67.2±13.6)歲;21例行單純CT引導活檢(CT組),男16例,女5例,平均年齡(63.5±13.1)歲。
1.2 儀器與方法 采用Philips Precedence 16排螺旋CT機及FUJIFILM SonoSite便攜式超聲診斷儀為引導設備。活檢術前均行胸部CT掃描,定位病灶后確定皮膚穿刺點及穿刺角度和深度,并標記皮膚進針點。由2名高年資放射科醫師完成所有操作。CT掃描參數:管電壓120 kV,管電流100 mA,層厚 5 mm,間隔5 mm,準直器寬度5 mm。
CT+US組:利用便攜式超聲診斷儀(低頻探頭頻率3.5~5.0 MHz,高頻探頭頻率4~13 MHz)在穿刺點周圍探測病灶位置。將探頭固定在計劃穿刺路徑上,按照CT預設的穿刺角度進行穿刺。根據穿刺針的延長線實時調整探頭角度,待穿刺針進入超聲視野后,針對聲像圖所示病灶進行實時引導,直到穿刺針針尖抵達病灶邊緣(圖1、2)。CT掃描確認穿刺針位置后,以18G全自動活檢槍在實時超聲監視下切割,取得1~2條長度為13~23 mm的組織。
CT組:以5 ml 1%利多卡因浸潤麻醉穿刺點和穿刺路徑后,采用16G外引導針逐步進針,進行常規經皮穿刺;再以穿刺層面為中心進行小范圍CT掃描,引導調整穿刺深度和角度,重復上述操作,直至針尖抵達病灶邊緣(圖3)。采用18G全自動活檢槍切割長度為13~23 mm的組織1~2條。
取樣后拔出穿刺針,囑患者仰臥、雙手上舉,復查胸部CT,觀察有無氣胸及出血。手術結束后,囑患者以穿刺點向下的壓迫體位臥床休息至少2 h,避免大聲講話及劇烈咳嗽。術后3~6 h拍攝常規立位胸片,以排除遲發性氣胸。

圖1 患者男,61歲,右側胸膜下結節,CT聯合超聲引導穿刺,病理提示為腺癌 A.術前CT定位掃描確定穿刺路徑; B.超聲探測到CT標記的病灶(*); C.穿刺針按計劃路徑進入超聲視野(白箭),直接經肋骨(△)后緣進入病灶; D.CT掃描確認針尖位置; E.超聲監視下切割組織; F.術后復查,病灶內見少量氣體
1.3 相關指標觀察 測量病灶厚度、病灶與胸膜的接觸面長度、穿刺深度(皮膚進針點到設定靶區的距離)、CT引導次數、手術時間(局部麻醉開始到確認針尖抵達設計靶區的時間)、占機時間(患者進入CT掃描室至離開的總時間)、CT掃描產生的有效輻射劑量以及術后并發癥。以每次掃描的劑量長度乘積(dose-length product, DLP)累加表示CT劑量,分別計算引導掃描和圍術期(術前定位和術后復查掃描的劑量之和)CT產生的有效輻射劑量,并計算總輻射劑量。有效輻射劑量=DLP×權重因子k,胸部k為 0.017 mSv/(mGy·cm)。
1.4 統計學分析 采用SPSS 10.0統計分析軟件。計量資料以±s表示,組間比較采用t檢驗;采用χ2檢驗比較計數資料。P<0.05為差異有統計學意義。
2 結果
2組患者性別、年齡及病灶數、厚度、與胸膜接觸面長度及穿刺深度差異均無統計學意義(P均>0.05),見表1。CT+US組引導CT掃描次數、手術時間、占機時間及引導掃描時的有效輻射劑量和總劑量均低于CT組(P均<0.01),2組圍手術期有效輻射劑量及術后發生氣胸、出血差異均無統計學意義(P均>0.05),見表2。
3 討論
穿刺SPPN可以采用經皮垂直于胸膜病灶的直接進針法,或平行于胸膜沿病灶長軸的切線進針法[1]。由于SPPN多表現為平行于胸膜的扁平增厚,故垂直進針法能夠獲取的樣本長度不及切線進針法;且經由皮膚垂直進入病灶,缺乏正常肺組織“橋”,更易發生皮下針道轉移;能夠獲得的支撐穿刺針的軟組織較薄,尤其對于前胸壁病灶,可致CT引導掃描時穿刺針不能牢固錨定而影響后續的方向調整[2]。切線進針法有助于克服垂直進針法的不足,但其穿刺路徑過長,加上常規CT引導不能實時監測進針,因此其技術難度比穿刺深中超聲較少用于引導活檢SPPN,主要原因在于超聲視野窄,且易受鄰近肋骨和含氣肺組織的干擾,單獨超聲常不能規劃出最佳穿刺路徑部肺病灶更高。使用CT透視功能可克服傳統CT引導穿刺不能實時監控的不足,但亦使患者和操作者受到更大劑量的電離輻射[7]。超聲具有可實時引導、無電離輻射損傷及多方位成像的優點。臨床實踐,且單純超聲定位SPPN非常耗時。

表1 2組患者一般資料和病灶特征比較
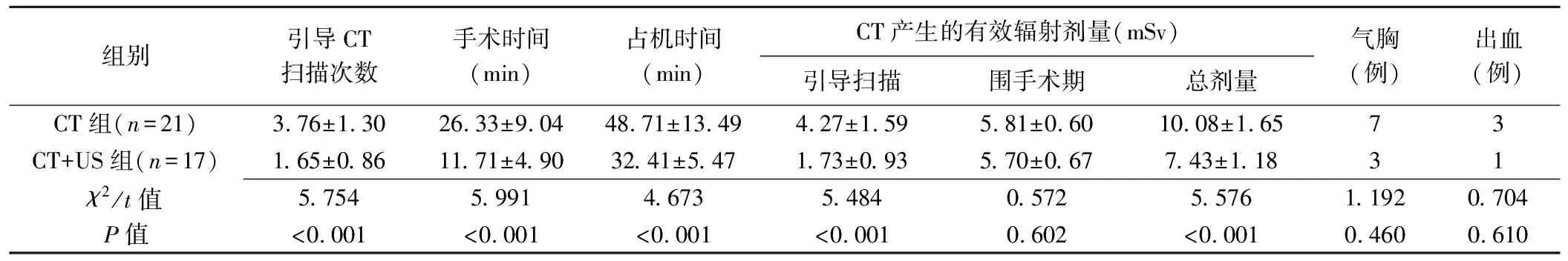
表2 2組穿刺相關指標和術后并發癥比較

圖2 患者男,73歲,胸膜多發鈣化增厚,CT聯合超聲引導穿刺,病理提示纖維結締組織 A.術前CT定位掃描確定皮膚進針點和穿刺路徑; B.聲像圖示病灶,按CT所示穿刺路徑進針,穿刺針(白箭)進入超聲視野后,繼續在超聲監視下經肋骨(Rib)間隙進入病灶邊緣(*); C.CT掃描確認針尖位置; D.術后復查CT未見氣胸及出血

圖3 患者男,45歲,右側胸壁多發胸膜增厚,常規CT引導穿刺,病理提示轉移性腺癌 A.術前CT定位掃描確定穿刺路徑; B.以局部麻醉針頭作為標記,再次掃描確認位置; C~E.反復CT掃描引導逐步進針; F.穿刺針針尖抵達病灶邊緣后切割組織
本研究中,與常規CT引導穿刺SPPN相比,采用CT定位規劃穿刺路徑,聯合超聲按規劃路徑實時引導穿刺,可顯著縮短手術操作時間和CT占機時間。實時超聲引導能夠在患者一次屏氣內完成穿刺和組織切割,這對于小的可移動病灶尤為重要,尤其是那些僅附著于臟層胸膜的病灶。由于穿刺針針尖存在坡面,采用平行于胸膜的切線位進針,穿刺針坡面接觸肋骨凸面時易偏離穿刺方向。單純CT引導往往需多次掃描,以調整進針角度;聯合超聲監視可使穿刺針順利通過肋骨凸面,即使對于那些完全位于肋骨下的病灶(超聲探測病灶本身困難),超聲亦有益于穿刺針順利通過肋骨。
本研究結果顯示,單純CT引導組術后氣胸(無癥狀)和肺內出血發生率分別為33.33%(7/21)和14.29%(3/21),而CT聯合超聲組分別為17.65%(3/17)和5.88%(1/17),2組差異無統計學意義,可能與樣本量小有關。反復多次穿刺胸膜或針尖在胸膜處停留可能是導致氣胸發生的主要原因[8]。常規CT不能動態監測、實時顯示針尖與胸膜的位置關系以及病灶位置隨呼吸運動的變化,需要頻繁調整穿刺方向。本組中常規CT組引導CT平均掃描次數為(3.76±1.30)次(2~6次),而聯合超聲后下降至平均(1.65±0.86)次(1~3次),其中10例為1次穿刺成功。穿刺胸膜過程中,超聲直視可減少反復損傷胸膜的機會,也有利于避免穿刺針在胸膜區停留導致的胸膜撕裂;活檢針抵達設定靶區后,超聲監視能夠直接顯示切割組織的深度,把握切割深度、掌握病灶隨呼吸運動的位置變化能夠減少盲切胸膜和肺組織的可能,這可能是CT聯合超聲組術后氣胸和肺內出血率相對較低的主要原因。CT聯合超聲組患者輻射劑量較單純CT組下降約60%,有效輻射劑量下降約27%。近期研究[9]表明,經胸超聲可用于檢測氣胸、監測胸部穿刺后并發癥,有助于進一步降低有效輻射劑量。
本研究的主要局限性:為回顧性研究,受CT和超聲設備協調以及介入和超聲醫生工作日程等影響,未進行隨機分組;未設立單獨超聲引導SPPN活檢組,原因在于盡管對部分與胸膜有較大接觸面的病灶可采用超聲引導[10],但受病灶相對較小及呼吸運動和肋骨阻擋等因素影響,超聲檢查存在一定失敗率。
總之,CT聯合實時超聲引導穿刺活檢SPPN可實現CT精確定位制定手術路徑與實時超聲引導和監測優勢互補,顯著縮短穿刺操作時間,降低穿刺操作難度,減少輻射劑量。

