碳源對杜氏鹽藻株生長的影響及其培養基的優化
王玲玲,李兆河,馬貴范,王吝安
(1.威海海洋職業學院,威海市微藻種質資源開發工程技術研究中心,山東 榮成 264300;2.山東大學(威海)海洋學院,山東 威海 266071)
杜氏鹽藻Dunaliella salina 富含蛋白質、β-胡蘿卜素和特殊生物活性物質,在食品、醫療保健、化工和養殖業中具有公認的獨特經濟價值[1]。筆者由山東榮成桑溝灣分離得到一株具有優良性狀的鹽藻,用混合營養培養方法研究了碳酸氫鈉、葡萄糖、蔗糖和乙酸鈉等碳源和濃度對其生長的影響;采用正交設計試驗方法優化了其培養基中C、N、P 的濃度水平,為鹽藻大規模生產應用提供理論依據。
1 材料與方法
1.1 材料
實驗用鹽藻分離于山東省榮成桑溝灣自然水域,經分子鑒定為杜氏鹽藻。
葡萄糖、蔗糖、乙酸鈉、碳酸氫鈉、硝酸鈉、磷酸二氫鈉和硅酸鈉等為分析純試劑。
培養用水為取自山東榮成桑溝灣海區鹽度31.5 的自然海水,0.45μm 微孔濾膜抽濾,用氯化鈉調整海水鹽度至60;培養基采用f/2 培養基[2]。培養基經高壓滅菌后冷卻曝氣,調pH 至8.0;鹽藻置于光照培養箱中培養,溫度26℃,光暗比12h∶12h,光照強度3 000~4 000Lux,每8h 振蕩1 次。
1.2 方法
1.2.1 碳源的篩選
將無機碳源(碳酸氫鈉)、有機碳源(葡萄糖、蔗糖和乙酸鈉)分別加入f/2 培養基中,每種碳源設4個碳素濃度梯度,分別為0.00 mol·L-1(對照組)、0.05 mol·L-1、0.10 mol·L-1和0.15mol·L-1。實驗采用一次性培養方式,在250mL 三角瓶中裝入150mL培養液,取對數生長期藻種接種,接種密度為0.61×106ind.·mL-1,培養12d,每24h 定時采樣記錄鹽藻的細胞密度。
1.2.2 鹽藻培養基的優化
根據碳源篩選結果和f/2 培養基配方,以葡萄糖、硝酸鈉和磷酸二氫鈉為碳、氮和磷源,設計三因素三水平L9(34)正交試驗[3],優化鹽藻培養基中C、N、P 營養鹽濃度,各因素水平如表1 所示。培養12d,每24h 定時采樣記錄鹽藻的細胞密度。
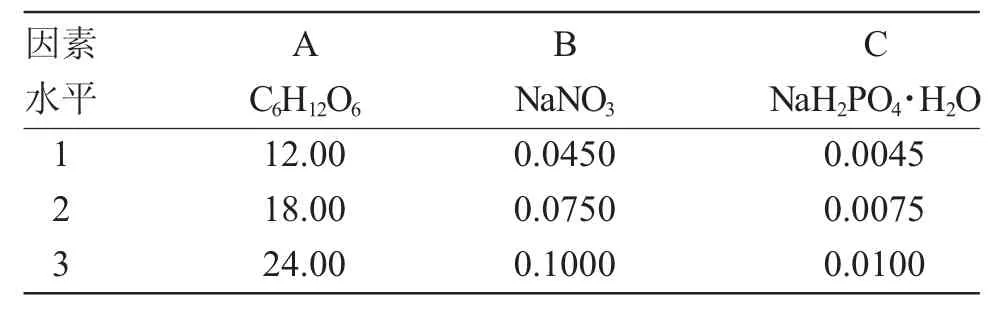
表1 三種營養鹽因素水平表Tab.1 Levels of three nutrients(g·L-1)
1.3 鹽藻細胞密度的測定
用血球計數板計數鹽藻的細胞密度,用V-2000 分光光度計測定相應細胞密度下藻液的OD630,每隔24h 測定一次,繪制吸光度與藻細胞濃度的標準曲線,根據標準曲線計算出鹽藻細胞密度[4]。
1.4 數據分析
實驗重復三次,運用SPSS 軟件進行數據分析。選擇單因變量多因素方差法分析碳源形式和濃度的主效應和二者的交互效應;對方差分析結果顯著的因素,利用最小顯著差數法(LSD)進行多重比較[5]。正交試驗采用直觀分析和單因變量多因素方差法分析C、N、P 的主效應。差異顯著性水平為P<0.050。
2 結果和分析
2.1 不同碳源對鹽藻生長的影響
如圖1~4 所示,培養1~3d 為延緩期,第4d 進入指數生長期,第10~12d 細胞密度最高。如圖1 所示,第12d 空白對照組鹽藻細胞密度為(5.40±0.42)×106ind.·mL-1,葡萄糖組0.05mol·L-1、0.10mol·L-1和0.15mol·L-1濃度下鹽藻細胞的密度高于空白對照組,且0.10mol·L-1濃度下細胞密度為(12.56±0.44)×106mL-1,較0.05mol·L-1和0.15 mol·L-1濃度下細胞密度高;如圖2 所示,第12d 蔗糖組0.05mol·L-1、0.10mol·L-1和0.15mol·L-1濃度下鹽藻細胞密度高于空白對照組,且0.05mol·L-1濃度下細胞密度為(9.29±0.21)×106ind.·mL-1,較0.10mol·L-1和0.15mol·L-1濃度下細胞密度高;如圖3 所示,第12d乙酸鈉組0.05mol·L-1、0.10mol·L-1和0.15mol·L-1濃度下鹽藻細胞密度低于空白對照組,0.05mol·L-1濃度下細胞密度為(4.89±0.22)×106ind.·mL-1,較0.10mol·L-1和0.15mol·L-1濃度下細胞密度高;如圖4 所示,第12d 碳酸氫鈉組0.05mol·L-1、0.10mol·L-1和0.15mol·L-1濃度下的鹽藻細胞密度高于空白對照組,且0.15 mol·L-1濃度下細胞密度為(8.04±0.22)×106ind.·mL-1,較0.05mol·L-1和0.10mol·L-1濃度下細胞密度高。結果顯示,各試驗濃度葡萄糖、蔗糖和碳酸鈉均可促進鹽藻的生長,乙酸鈉抑制鹽藻的生長。
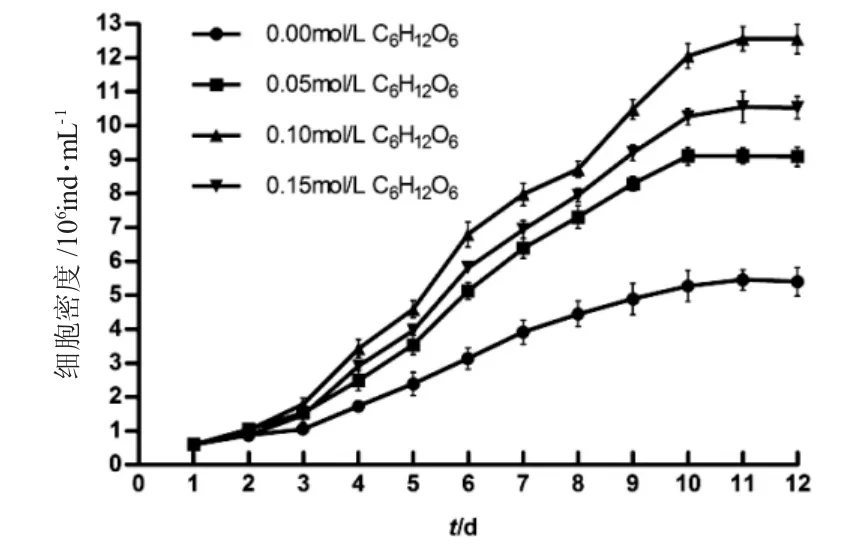
圖1 不同的葡萄糖濃度下鹽藻的生長曲線(n=3)Fig.1 The growth curves of green alga Dunaliella salina at different concentrations of glucose C6H12O6
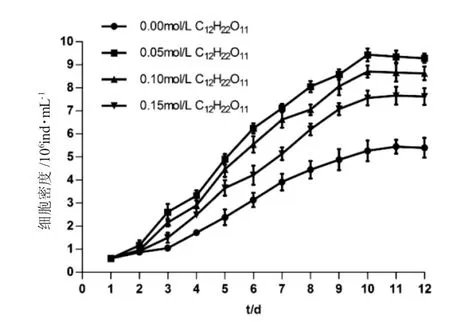
圖2 不同的蔗糖濃度下鹽藻的生長曲線(n=3)Fig.2 The growth curves of green alga Dunaliella salina at different concentrations of sucrose C12H22O11
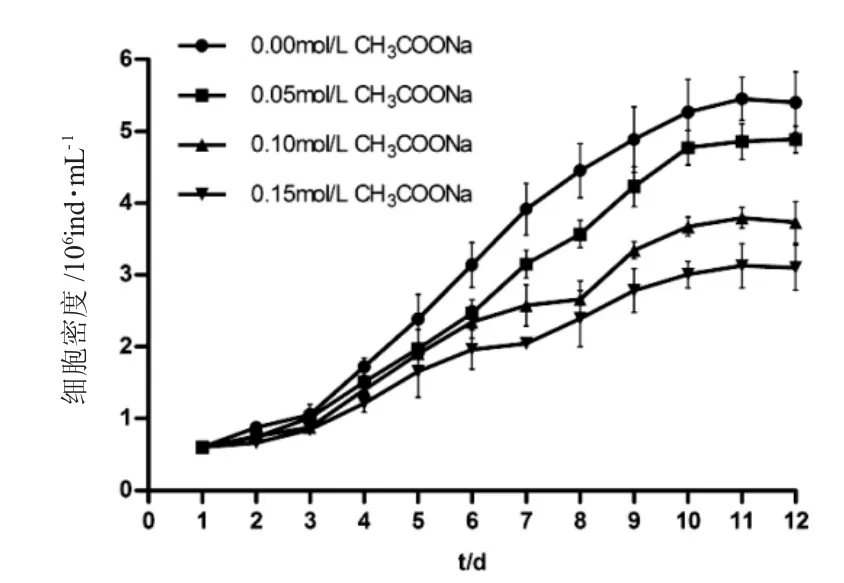
圖3 不同的乙酸鈉濃度下鹽藻的生長曲線(n=3)Fig.3 The growth curves of green alga Dunaliella salina with Different concentrations of CH3COONa
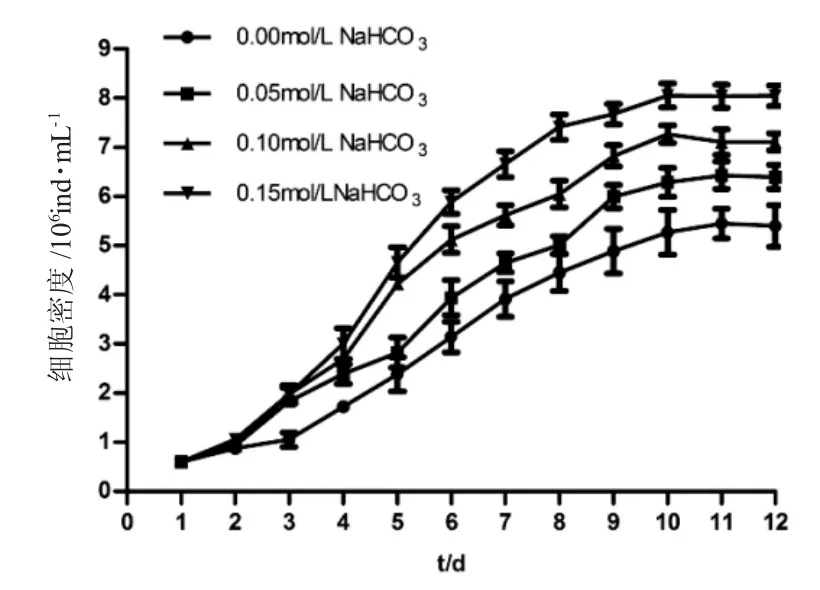
圖4 不同的碳酸氫鈉濃度下鹽藻的生長曲線(n=3)Fig.4 The growth curves of green alga Dunaliella salina at different concentrations of NaHCO3
由圖5 可知,第12d,0.05mol·L-1濃度下葡萄糖組與蔗糖組的細胞密度相差不大,且明顯高于碳酸鈉和乙酸鈉組;0.10mol·L-1與0.15mol·L-1濃度下,鹽藻的細胞密度由高至低為:葡萄糖組>蔗糖組>碳酸鈉組>乙酸鈉組。
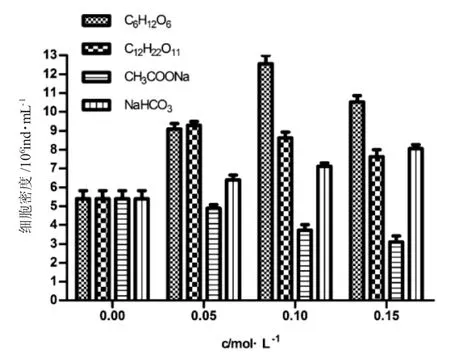
圖5 不同碳源條件下鹽藻生長的細胞密度Fig.5 The cell density of green alga Dunaliella salina with different carbon sources
SPSS 的一般線性模型方差分析結果顯示:碳源和濃度都對鹽藻生長的細胞密度有極顯著影響(P=0.000)(表2)。多重比較結果顯示,有利于鹽藻細胞密度增加的碳源形式表現為:葡萄糖>蔗糖>碳酸鈉>乙酸鈉,四者之間差異極顯著;有利于鹽藻細胞密度增加的碳濃度表現為:0.10mol·L-1>0.05 mol·L-1≥0.15mol·L-1>0.00mol·L-1,其中0.05mol·L-1和0.15mol·L-1組別差異不顯著(P=0.502)。有利于鹽藻細胞密度增加,優選葡萄糖做碳源,適宜濃度為0.10mol·L-1。
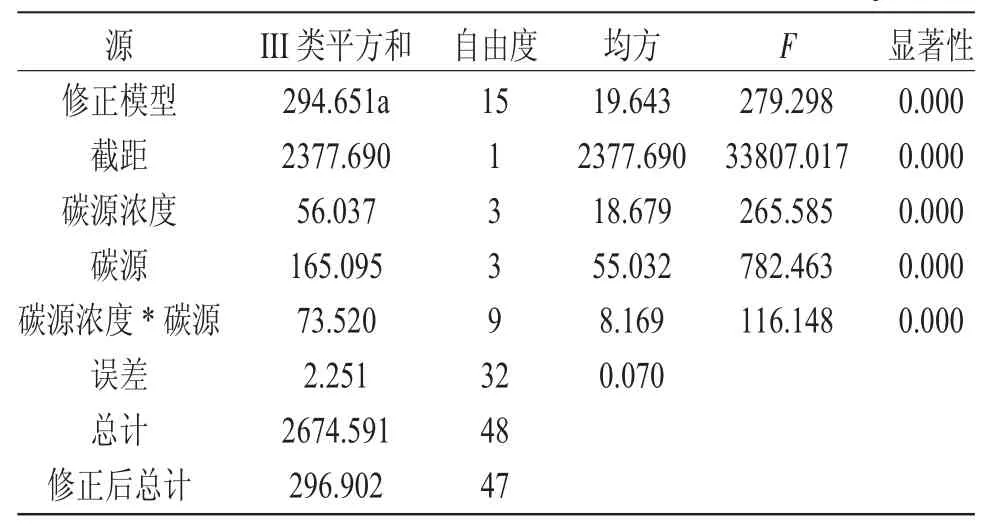
表2 碳源形式和濃度對鹽藻的細胞密度的主效應和交互效應檢驗Tab.2 Analysis of main and interaction effects of carbon sources and concentration on final cell density
2.2 鹽藻培養基的優化
2.2.1 極差分析
如表3 正交試驗分析所示,經12d 培養,各營養鹽極差分析結果為:N 源>C 源>P 源,各營養鹽對鹽藻細胞密度增加的影響由大到小依次為:N源、C 源、P 源;C 源各水平的影響由大到小依次為:K2>K3>K1;N 源各水平的影響由大到小依次為:K3>K2>K1;P 源各水平的影響由大到小依次為:K3>K2>K1。直觀分析鹽藻優化后的培養基成分為:葡萄糖(C 源)18.00g·L-1、硝酸鈉(N 源)0.1000g·L-1和磷酸二氫鈉(P 源)0.0075g·L-1。
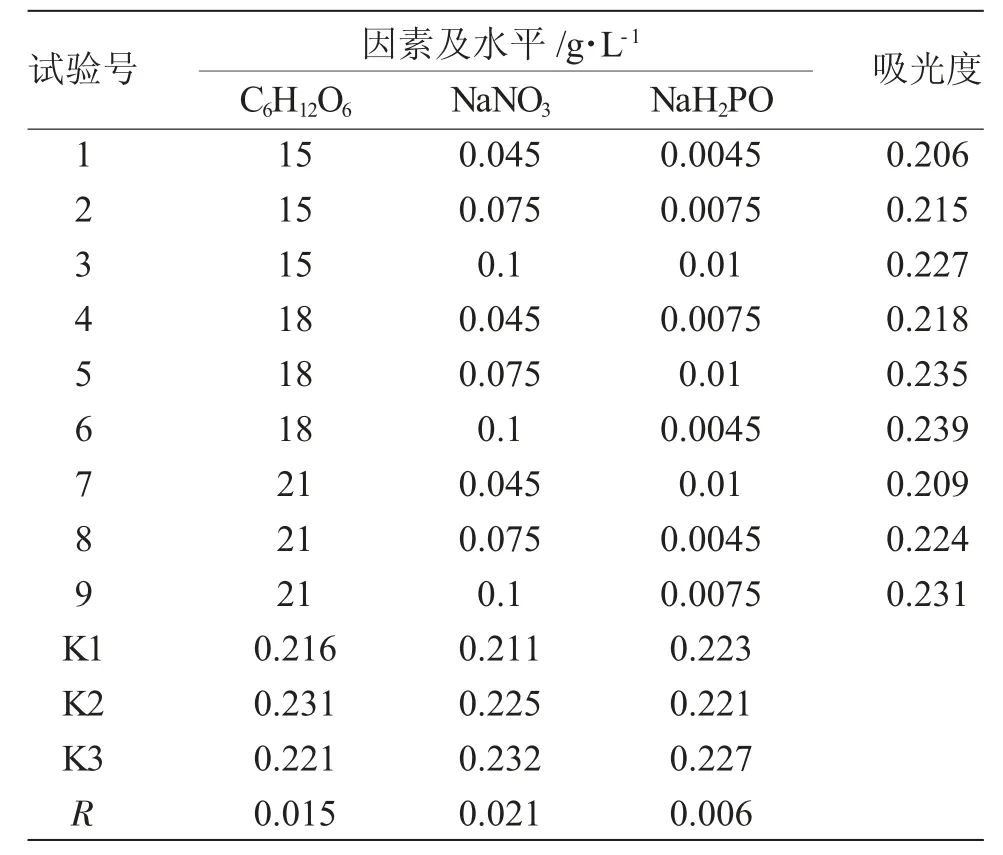
表3 營養鹽對鹽藻細胞密度增加的影響正交試驗結果分析Tab.3 Result analysis of the orthogonal tests on effects of nutrients on cell density of green alga Dunaliella salina
2.2.2 方差分析
由表4 可知,氮源、碳源對鹽藻細胞密度增加的影響顯著(P<0.050),磷源的影響不顯著(P>0.050)。各營養鹽對鹽藻細胞密度增加的影響顯著性由大到小依次為:氮源、碳源、磷源。方差分析的結果與直觀分析的結果一致。
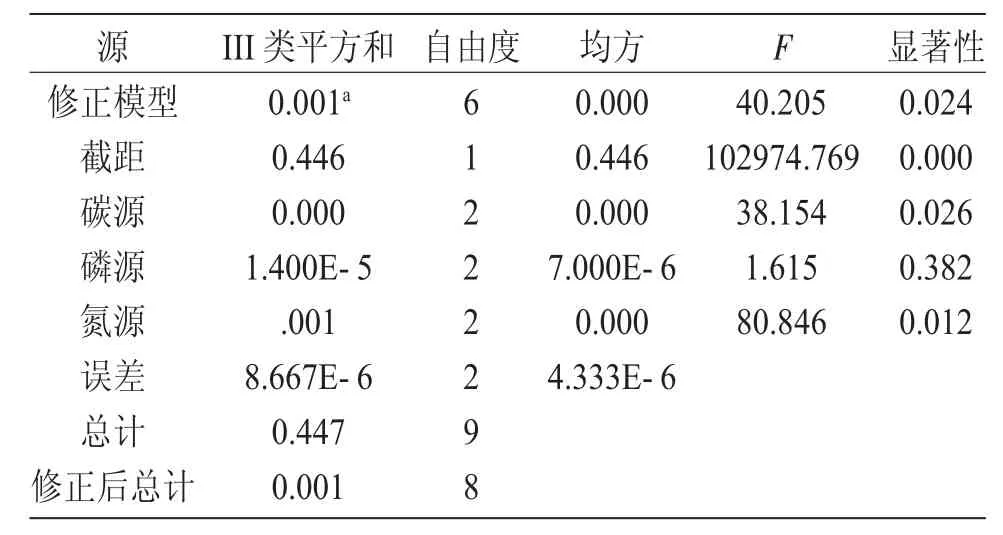
表4 方差分析結果Tab.4 Results of variance analysis
3 討論
微藻富含脂類、蛋白質和多糖,光合作用效率高、生長周期短、可再生,在食品、醫藥、保健品及生物能源領域廣泛應用[6,7]。人工大規模高效培養是微藻資源開發利用的關鍵。近年來,隨著許多藻類利用碳源的研究不斷深化,圍繞微藻異養或混養的研究逐漸展開[8]。研究表明:混合營養(Mixo-trophism)(同時進行無機營養光合作用與有機營養的培養方式)可以大規模高密度生產微藻[9]。微藻可以吸收利用水體中的HCO3-[10]。White 等[11]發現,添加1g/L 碳酸氫鈉可以提高四爿藻Tetraselmis suecica 和微綠球Nannochloropsis salina 的細胞密度;戴玉蓉和盧敬讓[12]在培養液中添加1g/L NaHCO3,明顯促進了綠色巴夫藻3012 Pavlova viridis、亞心扁藻Platymonas subcordiformis、海水小球藻Chlorella pacifica、等鞭金藻8701 和等鞭金藻3011 的生長;王星宇等[13]研究發現,培養液中添加碳酸氫鈉顯著影響球等鞭金藻的生長。
微藻細胞對有機碳化合物及其利用程度也具有偏愛性[14]。Pruvost 等[15]報道,某些微藻具有特殊的運送系統,可主動吸收培養基中的有機化合物,這為微藻異養或混合培養提供了依據。目前藍藻門、隱藻門、甲藻門、金藻門、黃藻門、硅藻門、裸藻門和綠藻門等8 門60 多屬的近百種微藻可以進行異養或混合營養生長[16],其中某些微藻經過優化培養后,生物量或有用生化產物大幅提高。吳慶余等[17]用批式流加葡萄糖培養原始小球藻Eprotothecoides,生物量超過了100g·L-1。降低鹽藻培養液中可溶性無機碳源含量,增加葡萄糖混合培養基顯著影響杜氏鹽藻的生長[18];葡萄糖濃度為30 mmol·L-1時,微綠球藻Nannochloropsis sp 的生長明顯增長[19]。田華等[20]研究葡萄糖碳源對螺旋藻Spirulinaplatensis 的混合營養,發現葡萄糖濃度為3.0g·L-1時,干重是對照的1.29 倍。這些異養微藻已用于產業化生產,其應用價值主要表現在作為水產餌料和提取生化產物[21]。
本試驗明確了培養液中適合鹽藻混合培養的最優碳源為葡萄糖,與孫俊楠等[18]的研究結果相似;優化后的培養基中C、N、P 營養鹽濃度為:葡萄糖18.00g·L-1,硝酸鈉0.1000g·L-1,磷酸二氫鈉0.0075 g·L-1,優化的培養基明顯提高了鹽藻的生長量,可為鹽藻的工業化生產提供理論依據。為擴大應用范圍,在本研究的基礎上,未來將進一步探討不同碳源、濃度與鹽藻的細胞化學組成的關系及其影響機制等。

