腹腔鏡下微波消融治療肝癌的療效及并發癥分析
王衛兵, 盧朝德, 毛 毳
(江蘇省南通市第三人民醫院 普外科, 江蘇 南通, 226000)
原發性肝癌的特點是發現晚、惡性程度高、病情進展迅速[1]。與傳統治療手段比較,微波消融治療具有定位準確、安全有效、創傷小、恢復快等優勢,已成為目前治療肝癌的重要手段[2]。本院將腹腔鏡與微波消融技術相結合,取得良好的療效,現報告如下。
1 資料與方法
選取2014年1月—2018年12月在本院普外科行腹腔鏡下微波消融治療的35例患者作為研究對象,其中男27例,女8例,年齡44~78歲,平均(57.0±2.3)歲,術前均診斷為原發性肝癌。
術前完善血常規、肝腎功能、凝血功能、甲胎蛋白(AFP)、異常凝血酶原測定等實驗室檢查,同時進行腹部增強CT、腹部MRI(普美顯造影劑)、B超等影像學檢查,目的主要是明確診斷,了解病灶所在位置、數量,判定是否具有手術指征,評估手術風險。同時提交多學科診療模式(MDT)討論結果,確定具體手術方式。術前準備好腔鏡器械、微波消融儀器及術中B超儀器。
手術治療方法: 患者全身麻醉后采取仰臥位。結合術前影像學資料,分別選取臍下10 mm、右上腹肋緣下5 mm、劍突下10 mm穿刺孔。臍下為觀察孔,劍突下放置超聲刀,肋緣下放置分離鉗。以超聲刀適當游離肝周韌帶及粘連處,充分暴露病灶區域。常規再次行術中B超檢查(部分行超聲造影),進一步評估病灶位置及所剩肝臟體積。確定病灶可行微波消融治療后,經超聲引導,經皮將14G微波消融針插入病灶。每個部位每次治療量50~60 W, 冷循環時間為3~5 min。根據腫瘤大小及部位進行個性化治療。治療期間,根據腫瘤回聲變強的范圍和程度從遠到近邊治療、邊退針。繼續經術中B超觀察,確認瘤體全部有強回聲覆蓋即可退出消融針。在消融針退出腫瘤及肝臟過程中,先關停冷卻水10~15 s, 然后再將儀器電源關閉,拔出消融針,目的是凝結針道,防止針道出血及針道種植。
影像學檢查結果是一個重要的參考指標,影像學檢查顯示消融區域為低密度且在動脈期無強化者,為完全消融(CA)。有局部增強者,為局部殘余(IA)。患者隨訪期間影像學檢查提示原腫瘤內部或者周邊有強化,考慮為腫瘤復發。對發生在肝臟其他部位的腫瘤,為新發病灶。出現肝外轉移灶,則為遠處轉移[3]。
2 結 果
2.1 微波消融術后影像學檢查顯示腫瘤清除水平
本組35例患者于術后第1個月常規隨訪,行腹部增強CT檢查或腹部MRI(普美顯造影劑)檢查。影像學檢查結果顯示, 35例患者49枚病灶的CA率為95.9%(47/49), IA率為4.1%(2/49)。對于IA者,安排1周內進行補充治療,術式采用B超引導下經皮微波消融術(PNWA)。
2.2 術后1個月內肝功能指標變化結果
術后復查肝功能,術后1 d時35例患者的轉氨酶指標水平不同程度升高,經護肝治療后,患者的轉氨酶水平進行性下降,逐漸恢復至正常水平,不同時點的轉氨酶水平比較,差異有統計學意義(P<0.05), 見表1。
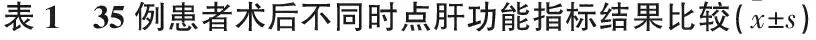

指標n術后1 d術后3 d術后6 d術后1個月谷丙轉氨酶35150.2±13.580.1±10.5?65.3±11.4?#45.1±9.8?#△谷草轉氨酶35160.8±10.390.5±11.1?78.7±11.5?#55.9±10.2?#△
與術后1 d比較, *P<0.05; 與術后3 d比較, #P<0.05; 與術后6 d比較, △P<0.05。
2.3 術后1周AFP及異常凝血酶原變化結果
35例患者術后1周AFP復查結果顯示: 術前8例AFP≥400 μg/L的患者中, 3例(37.5%)患者AFP數值降至正常(<20 μg/L), 3例(37.5%)患者AFP數值降為20~<400 μg/L, 2例(25%)患者仍AFP≥400 μg/L, 但水平較術前下降; 術前AFP為20~<400 μg/L的17例患者中, 7例(41.2%)患者數值降至正常(<20 μg/L), 10例(58.8%)患者AFP仍為20~<400 μg/L, 但水平較術前下降。術前異常凝血酶原≥20 μg/L的31例患者中,術后1周復查,有14例(45.2%)降至正常(<20 μg/L), 另外17例(54.8%)患者雖然異常凝血酶原水平仍然≥20 μg/L, 但水平均較術前下降。
2.4 復發與生存情況
35例患者均完成至少1年的隨訪,半年、1年、2年腫瘤局部復發率分別為0%、2.8%(1/35)、5.7%(2/35); 肝內出現新發病灶4例; 遠處轉移1例(為肺轉移)。對于局部復發、肝內新發病灶患者均再次行PNWA, 術后均完全消融。1例發生肺轉移的患者行胸腔鏡下轉移病灶切除術。本組患者半年、1年、2年的總生存率分別為100.0%、100.0%、94.3%。
2.5 并發癥
35例患者均行腹腔鏡下肝癌微波消融治療,術后穿刺部位有不同程度的疼痛不適,經對癥治療后緩解。術后有29例患者出現低熱,最高體溫38.5 ℃, 予物理降溫或口服新癀片后體溫逐漸下降。1例患者出現反應性胸腔積液; 2例患者出現膈下包裹性積液。術后復查肝功能, 35例患者轉氨酶水平均有不同程度升高,經護肝治療后,轉氨酶進行性下降,逐漸恢復至正常水平。本組患者均未出現肝衰竭、膽汁滲漏、消化道穿孔等與治療相關的嚴重并發癥。
3 討 論
原發性肝癌臨床上較多患者在就醫時就已錯過了最佳手術治療時機[4]。能接受手術治療者僅占原發性肝癌患者的10%~15%[5-6], 因此尋找一種安全有效的手段來治療失去手術切除指征的原發性肝癌患者顯得尤為重要。1994年日本學者[7]首次報道應用微波凝固法治療了18例肝癌患者,結果顯示, 17例患者無局部復發,無嚴重并發癥發生。隨著微波消融技術的不斷發展,其臨床應用也越來越廣泛,特別是治療小肝癌的療效得到國內多個肝癌診療中心的肯定[8]。研究[9-10]認為,微波消融對于直徑小于5.0 cm的小肝癌療效確切,可完全滅活腫瘤組織,取得與手術相同的效果。本研究中,患者隨訪期間僅有1例發生肺轉移,其余患者均未發現遠處轉移,療效確切。
微波消融治療肝癌的作用原理基于微波的熱效應及肝臟腫瘤組織對熱量的敏感反應[11]。將微波輻射電極插入肝腫瘤組織內,輻射微波,高頻交變的微波使肝組織內的離子和極性分子高速旋轉、相互碰撞,在短時間內產生65~100 ℃的局部高溫; 因肝腫瘤組織內血管豐富,含水量高,對熱的調節能力差,所以當溫度達到60~100 ℃時腫瘤組織可即刻產生蛋白質凝固、變性、壞死,腫瘤細胞壞死后導致周圍血管發生栓塞,從而抑制腫瘤的擴散及轉移[12]。微波輻射對癌結節凝固范圍控制好,對于相鄰正常肝組織影響小,所以嚴重并發癥罕見,且對肝功能影響輕微[13]。既往臨床多采用B超或者CT引導下的經皮肝穿刺微波消融技術(PMCT)。PMCT對于原發性肝癌具有良好的局部控制率,能夠延長患者生存期,提高患者的生活質量,同時具有創傷小、并發癥少、副作用低等優點。

