小鼠胚胎移植技術優化及對巨細胞病毒凈化研究
杜 凱 李文光 吳德國 趙德明
(1.中國科學院遺傳與發育生物學研究所,北京 100101)(2.中國農業大學,北京 100094)
實驗動物是相關科學研究重要的、不可或缺的實驗材料,動物的質量可直接反映出科研水平的高低[1]。小鼠巨細胞病毒可導致小鼠肺炎,感覺神經性耳聾,眼內感染,心臟感染(心包心肌炎、營養不良性心臟鈣化,皮膚感染皰疹),腦炎,肝炎等[2-4],對毒理學、免疫學、藥理學、腫瘤學等試驗會產生影響。因此,從事相關試驗研究使用的小鼠需要排除小鼠巨細胞病毒的感染。
1 材料與方法
1.1 小鼠來源
結扎鼠、供體鼠、受體鼠來源于遺傳發育所動物中心。待凈化鼠:C57小鼠,經檢測種群感染小鼠巨細胞病毒。
1.2 實驗藥品
PMSG、hCG分別購自寧波第二激素廠和SIGMA公司,M2操作液、M16培養液和二甲基亞砜(DMSO)購自SIGMA公司。
1.3 方法
1.3.1結扎雄鼠的準備:雙側輸精管結扎雄鼠。手術1周后,與雌鼠交配,見到陰道栓的雌鼠未懷孕,證明雄鼠結扎成功,可使用。使用時,做好見栓記錄,連續4~6次不見栓的結扎鼠以二氧化碳吸入法[5]淘汰處死。
1.3.2供體鼠的超排處理:雌鼠在實驗第1天下午16時腹腔注射PMSG,第3天下午16時腹腔注射hCG。注射hCG后,1只雌鼠與1只雄鼠進行合籠。第4天上午8時檢查雌鼠陰道是否有栓塞,見栓的鼠作為供體。
1.3.3受體的同期發情處理:假孕雌鼠是通過用結扎雄鼠與受體鼠交配得到的。第3天下午16時,結扎雄鼠與受體鼠合籠交配。
1.3.4胚胎采集、沖洗:在實驗的第5天,通過脫頸法處死供體雌鼠,用70%的酒精噴灑腹部,使用眼科剪在腹部中間剪開一個小口。眼科鑷夾住剪開的皮膚,向頭尾部拉伸使毛發脫離腹腔.。眼科剪剪開腹膜,取出輸卵管、子宮,轉移到裝有M2的平皿上。注射器吸取沖胚液,將胚胎沖出。使用移卵管將胚胎收集起來,轉移到含新鮮M2的培養液中,反復洗幾次。將胚胎轉移至微滴培養皿中,培養液清洗,37 ℃、5%二氧化碳的條件培養暫存。
1.3.5品質鑒定:在胚胎保存液中將胚胎清洗2~3次后,放于顯微鏡下觀察,品質鑒定分為優良胚胎、普通胚胎、不良胚胎和不可用胚胎,其中優良胚胎和普通胚胎為可用胚胎。
1.3.6胚胎移植:交配后0.5~3.5 d的單細胞發育到囊胚階段的胚胎,可以移植到假孕雌鼠的生殖道內使其繼續發育。1.5 d的胚胎可以移植到假孕1.5 d小鼠的輸卵管壺腹部,而3.5 d的胚胎可以移植到2.5 d或3.5 d假孕雌鼠的子宮內。
1.3.7檢測:受體鼠產仔后,利用已報道的小鼠巨細胞病毒PCR檢測方法[6]進行檢測。
1.4 試驗
1.4.1不同廠商激素的對比試驗:按照1.3.2介紹的超排方法進行,使用不同廠商、不同劑量的激素進行超排處理,對比得到的胚胎數量,以及優良胚胎和正常胚胎占到總胚胎數量的比率。選取的兩家PMSG、HCG廠家為:SIGMA、寧波第二激素廠。劑量分別選取5、7.5、10IU。
1.4.2小鼠不同發情周期注射激素的對比試驗:選取不同發情周期的供體小鼠注射PMSG,后續超排按照1.3.2方法進行,對比超排出受精卵的數量,用以確定選取哪個發情周期的小鼠進行超排處理。
1.4.3受體鼠品系的對比試驗:選取C57、ICR、C57雄性與ICR雌性交配的子一代(CIF1代)以及C57雌性與ICR雄性交配的子一代(ICF1代)作為受體鼠,利用輸卵管移植法移植C57小鼠2細胞的胚胎,雙側輸卵管移植,移植相同數量的胚胎,對比仔鼠出生后的移植率。
1.4.4輸卵管移植與子宮移植產仔率的對比試驗:選取C57小鼠,隨機分成兩組。分別進行輸卵管移植和子宮移植,均進行雙側移植。產仔后計算產仔數量,得出產仔率。
1.4.5不同時期胚胎通過輸卵管移植的成功率試驗:采集的C57小鼠的單細胞、2細胞和8細胞胚胎,進行輸卵管移植,移植到ICR母鼠的輸卵管內,觀察受體鼠的妊娠率,用以評價不同時期的胚胎對輸卵管移植成功率的影響。
1.4.6輸卵管移植移植胚胎數量的對比試驗:選取品質在優良、正常的2細胞胚胎,移植到受體鼠的輸卵管內,每只小鼠移植12、24、32枚胚胎,觀察受體鼠的產仔率,用以評價移植胚胎數目的不同對輸卵管移植效果的影響。
2 結果
2.1 不同廠商激素的對比試驗結果
按照1.3.2介紹的方法分別對8周C57小鼠60只使用不同廠商、不同劑量的激素進行超排處理,對比得到的胚胎數量,以及優良胚胎和正常胚胎占到總胚胎數量的比率。由表1可知,使用SIGMA生產的激素超排效果無論從可用胚胎數和可用胚胎比率看,均明顯優于寧波第二激素廠。SIGMA產激素超排不同劑量間可用胚胎比率差別不大,使用10IU劑量超排C57小鼠的優良、正常胚胎數約17枚/只。
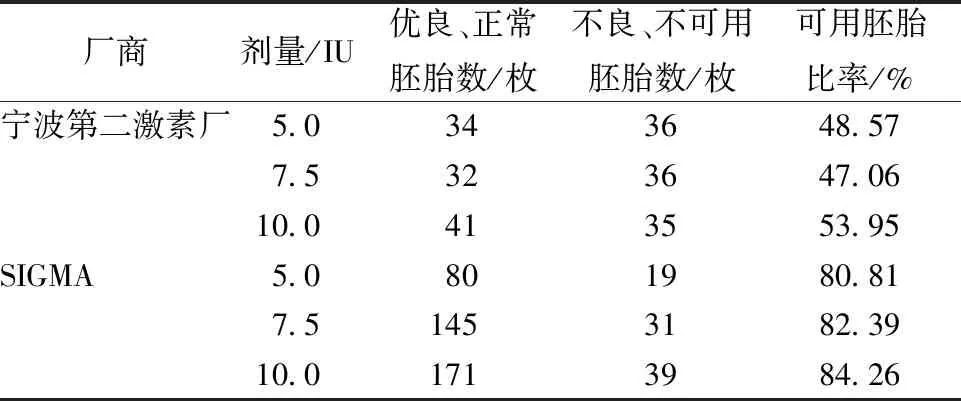
表1 不同廠商不同劑量的激素對比試驗結果Table 1 Results of different hormones in different manufacturers
2.2 小鼠不同發情周期注射激素的對比試驗結果
每組分別選取10只發情間期、發情前期、發情期、發情后期8周的C57小鼠,按照1.3.2介紹的方法進行超排處理,SIGMA產激素使用10IU,對比得到的胚胎數量,以及優良胚胎和正常胚胎占總胚胎數量的比率。由表2可知,在小鼠的發情間期超排,得到的優良、正常胚胎數量最多,平均每只小鼠獲得約23枚胚胎。
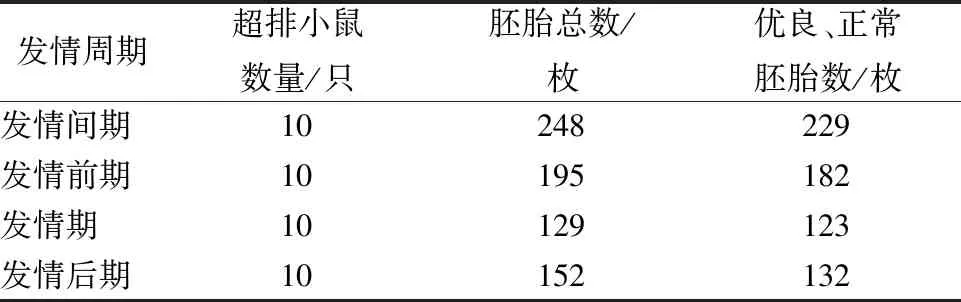
表2 不同發情周期注射激素的對比結果Table 2 Results of injection hormones in different estrous cycles
2.3 受體鼠品系的對比試驗結果
選取8周的C57、ICR、CIF1代和ICF1代的受體鼠,采用輸卵管移植方法,雙側輸卵管移植,移植25枚2細胞胚胎,待仔鼠出生后計算產仔數量,得出4種不同品系的小鼠的產仔率分別為37.5%、42%、44.5%和43.5%。由表3可知,CIF1代小鼠作為受體產仔率較高。

表3 受體鼠品系的對比結果Table 3 Results of recipient mouse strains
2.4 輸卵管移植與子宮移植產仔率對比試驗結果
選取17只ICR小鼠,隨機分成兩組,分別進行輸卵管移植和子宮移植,均進行雙側移植,其中輸卵管移植ICR母鼠10只共移植251枚優良、正常胚胎,子宮移植受體母鼠7只共移植211枚C57小鼠胚胎。由表4可知,輸卵管移植和子宮移植分別產仔102只、58只,產仔率分別為40.64%、27.49%。

表4 不同移植方法產仔率對比試驗結果Table 4 Results of different transplantation methods in birth rate
2.5 不同時期胚胎通過輸卵管移植的成功率試驗結果
采集C57小鼠的單細胞、2細胞和8細胞胚胎,進行輸卵管移植,移植到ICR母鼠的輸卵管內,觀察受體鼠的妊娠率,由表5可知,移植2細胞胚胎的妊娠率最高,達到了80%,而移植單細胞和8細胞的妊娠率分別為50%和40%。
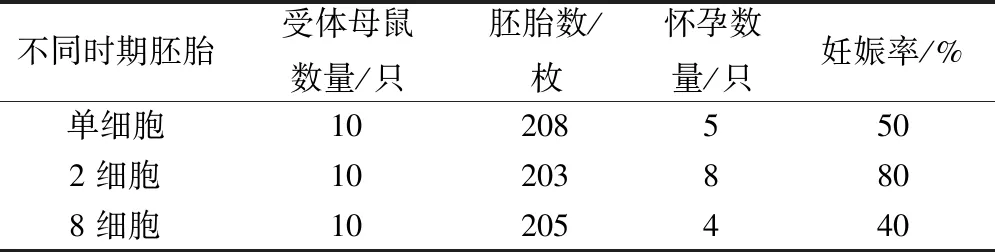
表5 移植不同時期胚胎的對比試驗結果Table 5 Results of embryo transfer in different periods
2.6 輸卵管移植移植胚胎數量的對比試驗結果
選取品質在優良、正常的2細胞胚胎,移植到受體鼠的輸卵管內,每只小鼠移植12、24、32枚胚胎,以觀察受體鼠的產仔率。由表6可知:當受體鼠移植24枚胚胎時,產仔率最高達到了43.75%,而移植12、32枚胚胎的產仔率分別為37.5%和34.38%。

表6 移植數量的對比試驗結果Table 6 Results of different numbers of embryo transfer
2.7 仔鼠的檢測結果
仔鼠出生后,眼角靜脈叢采集抗凝血。利用小鼠巨細胞病毒PCR檢測方法進行檢測,結果顯示均為陰性,見圖1。說明感染小鼠巨細胞病毒的SPF級小鼠,經過建立優化的胚胎移植凈化方法,成功排除了小鼠巨細胞病毒的感染。
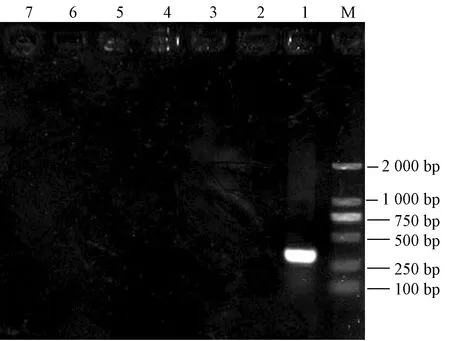
圖1 PCR檢測結果注:M:D2000 Marker;1:陽性對照;2:陰性對照;3:樣品1;4:樣品2;5:樣品3;6:樣品4;7:樣品5Fig.1 Results of PCRNote:M:D2000 Marker;1:Positive control;2:Negative control;3:Sample1;4:Sample2;5:Sample3;6:Sample4;7:Sample5
3 討論
用于小鼠凈化的方法主要為藥物凈化、剖腹產凈化和胚胎移植凈化[7-9]。藥物凈化有一定的作用[10],凈化不理想,難以達到目的。剖腹產凈化主要難點在于較難判斷母鼠的妊娠期,而且仔鼠的氣味會影響其代乳過程中的存活和育成,有的病毒(如淋巴細胞脈絡叢腦膜炎病毒)可通過胎盤造成凈化的失敗。胚胎移植技術逐漸受到試驗人員的重視。小鼠的胚胎透明帶可形成一道天然的屏障,能有效地抵御細菌、病毒的侵入[11],能通過胎盤屏障的病原體也不能穿透透明帶,且胚胎在供體鼠體內時間很短,也有效降低了母子間垂直傳播的可能性,同時在胚胎移植過程中的沖洗步驟還能有效減弱或消除病原體的活力[12],這些極大地增加了對病原體凈化的有效性,為排除小鼠巨細胞病毒奠定了堅實的基礎[13]。
本文利用優化的胚胎移植凈化技術對感染了小鼠巨細胞病毒的SPF級小鼠進行了胚胎移植凈化,獲得了無小鼠巨細胞病毒感染的SPF級小鼠。

