芬必得對大鼠腰椎間盤突出癥模型的療效評價*
陳迪新 李瑞鵬 歐慧瑜 邵珍怡 郭秋平
(1.廣州醫藥研究總院有限公司藥物非臨床安全評價研究中心,廣州 510240)(2.中國中醫科學院博士后科研流動站,北京 100700)(3.廣州醫藥集團有限公司博士后科研工作站,廣州 510130)
椎間盤由纖維環、髓核和軟骨終板構成一個無血管、低氧、低營養、低細胞結構和酸性的環境[1]。遺傳易感性、不適當的負重、營養缺失、肥胖或者其他疾病導致了髓核細胞凋亡、纖維環破裂,炎性因子和基質金屬蛋白酶(Matrix metalloproteinases,MMPs)增多,免疫細胞浸潤,神經增生和血管增生,最終造成腰椎間盤的退化。其中,髓核細胞凋亡、髓核細胞和纖維環炎性因子和基質金屬蛋白酶表達上調,免疫細胞浸潤是病變的關鍵進程。臨床研究標明,腰椎間盤突出癥(Lumbar Disc Herniation,LDH)神經根癥狀不僅與椎間盤突出的位置、大小有關,也和炎癥反應程度密切相關[2]。炎癥被認為是誘發神經根癥狀的重要因素,炎癥因子的增加,COX-2/PGE2(cyclooxygenase-2/Prostaglandin E2)通路的激活,增加了神經的敏感性,從而導致過敏性疼痛[3-4]。病人椎間盤組織PGE2含量明顯升高,與LDH神經根癥狀呈正相關。在臨床中使用COX抑制劑通過抑制COX活性減少前列腺素的合成,起到緩解疼痛,改善椎間盤退化作用,被較多地用于椎間盤突出癥患者的保守治療[5]。目前LDH患者治療情況常常比較復雜,臨床干預研究方法難以準確反應COX抑制劑對LDH的影響。因此選取合適的腰椎間盤突出癥動物模型,用于評價COX抑制劑對疾病的療效,對臨床COX抑制劑的選用有指導性意義[6-8]。本模型使用的是壓迫與炎性刺激共存型,即使用壓迫與炎性刺激共存的方法對大鼠進行建模,能夠較貼切地模擬人類腰椎間盤突出癥的發病機制[9-11]。此類模型可以較好地誘導出大鼠神經行為的改變,對大鼠損傷小,更加接近于臨床。
1 材料與方法
1.1 材料及試劑
0.5%羧甲基纖維素鈉(CMC-Na)(分析純),生產廠家為天津市大茂化學試劑廠。芬必得,生產廠家為中美天津史克制藥有限公司。PGE2、COX-2、IL-1、IL-6、NO試劑盒,購買自武漢伊萊瑞特生物科技股份有限公司。戊巴比妥鈉:規格為25 g/瓶,德國默克公司(北京華美生物科技技術有限公司分裝)。
1.2 方法
1.2.1大鼠腰椎間盤突出癥模型構建:實驗選用雄性、體質量為(180±20)g的SPF級SD大鼠60只(購于湖南斯萊克景達實驗動物有限公司),SPF級動物房常規飼養3 d后,分為3組(20只/組),分別為假手術組、模型組、模型加芬必得給藥組(簡稱芬必得組)。模型組與芬必得組分組后,大鼠腹腔注射2%戊巴比妥鈉(3 mL/kg)麻醉,俯臥固定,碘酒、酒精依次消毒,以L5/L6棘突間隙為中心,取后背正中切口約4 cm,逐層切開皮膚及皮下組織,分離腰椎旁肌,深達椎板,暴露L5的橫突和椎間孔[12-13]。將直徑為0.8 mm,長度為4 mm的L形鈦棒在L5椎間孔以背中線約30°~40°和-10低于椎體水平線15°角度約4 mm進入椎間孔。當鋼棒壓迫神經節,同側后肢肌肉通常表現出一、兩次輕微的抽搐。另在大鼠背正中以腰椎L5~L6為中心切口,以手術刀做一長約2 cm 縱形切口,組織鉗向切口兩側牽開皮膚及皮下組織,以血管鉗分離顯露鼠尾2個節段的椎間纖維環。以手術刀尖于纖維環上做一切口,擠壓鼠尾椎間,可見清亮膠凍狀髓核組織于纖維環切口處突出。用刮匙刮出2節段髓核,移除大鼠背部傷口覆蓋物,以鑷子夾持髓核組織小心移植于L5椎間孔內。放置后,對背部肌肉和皮膚逐層進行縫合,且對尾部切口也進行縫合。假手術組動物僅不取出、放置尾部椎間盤髓核及不放置L型鋼棒,其余操作與模型組與芬必得組相同。造模完成,每只動物的右側肌肉均連續注射3 d青霉素,以防感染。造模期間(T1~T7),對每只動物的左下肢進行運動功能評分;造模第8天(T8),選用運動功能評分≥1的動物進行灌胃給藥(每組選擇16只動物);否則剔除。試驗期間,對每只動物的左下肢定期進行運動功能評分、機械刺激回縮反應測定、大腿周徑測量。連續給藥28 d,末次給藥后1 h全部麻醉后放血處死,取L4~L6腰椎及其神經、用4%甲醛溶液進行固定后進行病理組織學檢查或進行組織炎性細胞因子檢測。
1.2.2運動功能評分觀察:按表1,對造模動物的左后肢(造模足)的運動功能進行觀察并評分。
1.2.3機械性縮足反射閾值的測定:用von Frey細絲以up-and-down 法推算50%縮足閾值:將動物置于金屬篩網上,安靜5 min后使用不同克數的Von Frey 纖維細絲(1、1.4、2、4、6、8、10、15、60 g等)垂直刺激大鼠左后肢手術側足底中部,持續時間≤4 s,大鼠出現抬足或舔足行為視為陽性反應,反之為陰性反應。測定首先從2 g開始,當此力度的刺激不能引起陽性反應,則給予相鄰大一級力度的刺激;如出現陽性反應則給予相鄰小一級力度的刺激,如此連續進行,直至出現第1次陽性反應和陰性反應的交界值,再連續測定4次。若動物的足部反應>60 g,均以60 g計;若動物的足部反應<1 g,均以1 g計[14]。

表1 動物運動功能評分表Table 1 Animal motor function score sheet
1.2.4坐骨神經功能評價:
A.大腿關節周徑測定:采用游標卡尺,測量各組動物左右后肢的大腿關節周徑。
B.SFI(坐骨神經功能指數):先進行步態測量:自制大鼠足印行走箱[15]:選用一個規格為80 cm×12 cm×15 cm亞克力透明盒子(上部開放),然后選用一個規格為70 cm×20 cm的鏡子,傾斜45°放在中間。將大鼠放在行走箱一端,讓大鼠自行走向箱的另一端,若大鼠中途停止,重新放置起點讓其自行走。在上述自制裝置的正前方約1.5 cm處,調整好高度使鏡子反射出的圖像正好與高清數碼相機平行,然后拍攝大鼠的行走視頻。獲取SFI參數:將錄制的視頻用Photoshop軟件打開,然后緩慢拖動視頻時間軸直到出現清晰的大鼠后足底部時用軟件中“測量工具”測量其長度、足寬度和中間趾寬度,計算其SFI (Sciatic nerve function index)。
SFI=-38.3(EPL-NPL)/NPL+109.5(ETS-NTS)/NTS +13.3(EIT-NIT)/NIT-8.8(E:實驗側足;N:正常側足;PL(足趾長度):足跟到足尖的最長距離;TS(足趾寬度):第1~5趾連線的最長距離;IT(中間足趾距離):第2~4趾連線的最長距離。)
1.2.5血清PGE2、COX-2、IL-1β (Interleukin-1β)、IL-6 (Interleukin-6)、NO (Nitric oxide)檢測:腹主動脈取血。采血管的采血量應多于4 mL,血液在室溫存放30 min至1 h,將采血管用2 000 g相對離心力,20 ℃離心15 min取血清。采用ELISA進行濃度測量。
1.2.6椎間管神經根PGE2、COX-2、IL-1、NO檢測:取壓迫處椎間管神經根(約1 cm)進行組織勻漿,ELISA進行濃度檢測。
1.2.7對造模處神經根及椎間盤進行制片:組織標本經取材、固定、(椎間盤脫鈣)、修塊、流水沖洗、脫水、透明、浸蠟、石蠟包埋后,石蠟切片,HE染色、封片。鏡檢:采用BX43型OLYMPUS?生物顯微鏡觀察和記錄背根神經節及椎間盤組織結構及細胞形態(背根神經節×400,椎間盤×40)。
1.3 統計方法
2 結果
2.1 壓迫L5背根神經節及移植自體髓核誘導大鼠腰椎間盤突出癥相關癥狀
如圖1所示,用L型鋼棒壓迫大鼠L5背根神經節,并移植自體髓核至背根神經節進行造模,模型大鼠在術后表現出坐骨神經過敏性疼痛相似表現:造模側后爪經常從地板上抬起,在靜息狀態常見舔造模側后爪的行為,在行走時造模側后爪緩慢放置,移動緩慢。嚴重時造模側后爪外翻,可出現拖行及抬起造模側后爪跳走的行為。

圖1 壓迫與炎性刺激構建腰椎間盤突出癥大鼠模型注:A:腰椎間盤突出癥大鼠模型構建方法示意圖;B:假手術組(Sham)大鼠左后肢 vs.腰椎間盤突出癥模型組(LDH)大鼠左后肢Fig.1 Compression and inflammatory stimulation to construct a rat model of lumbar disc herniationNote:A,schematic diagram of the construction method of rat model of lumbar disc herniation;B,left hind limb of sham operation group (Sham)rat vs.lumbar disc herniation model group (LDH)
2.2 芬必得降低腰椎間盤突出癥大鼠的運動功能評分
運動功能評分用于描述模型大鼠的運動功能狀態,評分越高,動物運動功能狀態越差。如圖2所示:造模第8天(T8),假手術組、模型組、芬必得組的運動功能評分分別是0.00±0.00、1.69±0.70、1.63±0.81。與假手術組相比,造模動物的運動功能評分均明顯升高(P<0.05),造模動物各組運動功能評分無明顯差異。T22和T34,與模型組(T22和T34∶1.31±0.48、0.75±0.68)相比,芬必得(T22和T34∶0.75±0.86、0.31±0.48)顯著降低運動功能的評分(P<0.05)。
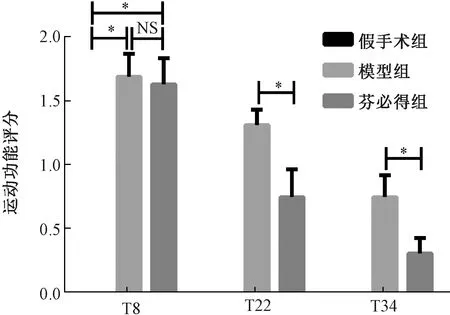
圖2 芬必得對腰椎間盤突出癥大鼠運動功能評分的影響注:Tn表示造模后第n天;n=16;*P<0.05Fig.2 Effect of Fenbid on motor function score in rats with lumbar disc herniationNote:Tn indicates the nth day after modeling;n=16;*P<0.05
2.3 芬必得提高腰椎間盤突出癥大鼠的機械性縮足反射閾值
機械性縮足反射閾值作為常用的神經病理性疼痛行為學的觀測指標,能夠反映動物機械性刺激誘發的過敏疼痛程度,閾值降低,說明動物產生機械性過敏性疼痛。如圖3所示:造模第8天,與假手術組(16.46±7.00 g)相比,造模動物(模型組、芬必得組)的機械性縮足反射閾值均明顯降低(P<0.05),分別是(5.02±2.00)g、(6.02±2.47)g,造模動物各組機械性縮足反射閾值無明顯差異。T34,與模型組(7.32±1.06)g相比,芬必得(8.98±2.68)g顯著升高模型動物的機械性縮足反射閾值(P<0.05)。
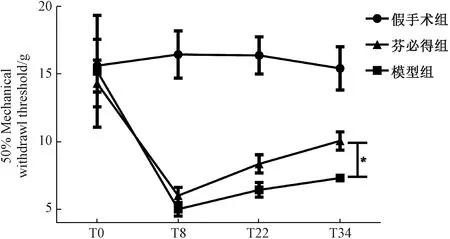
圖3 芬必得對腰椎間盤突出癥大鼠機械性縮足反射閾值的影響注:Tn表示造模后第n天;n=16;*P<0.05Fig.3 Effect of Fenbid on the mechanical paw withdrawal reflex threshold in rats with lumbar disc herniationNote:Tn indicates the nth day after modeling;n=16; *P<0.05
2.4 芬必得提高腰椎間盤突出癥大鼠的坐骨神經功能
壓迫型腰椎間盤突出癥模型通過壓迫背根神經節從而影響動物的坐骨神經功能。大腿周徑比值(造模側/對側)是評價坐骨神經功能的間接指標。大腿周徑比值(造模側/對側)下降,說明坐骨神經損傷,坐骨神經支配肌肉群萎縮。如圖4 A所示:造模第22天,與假手術組(0.99±0.0)相比,造模動物的大腿周徑比值(造模側/對側)明顯降低(P<0.05)。T34,與模型組(0.82±0.10)相比,芬必得(0.89±0.05)顯著升高模型動物的大腿周徑比值(造模側/對側)(P<0.05)。
步態測量實驗中坐骨神經功能指數(SFI)用于評價坐骨神經的損傷。SFI=0為正常,-100為完全損傷。如圖4B所示:造模第8天,與假手術組(-11.97±2.8)相比,造模動物的SFI值明顯降低(P<0.05)。T22和T34,與模型組(T22和T34:-43.20±10.80、-43.37±22.51)相比,陽性藥芬必得(T22和T34:-30.67±11.64、-20.33±29.30)顯著升高模型動物的SFI值(P<0.05)。
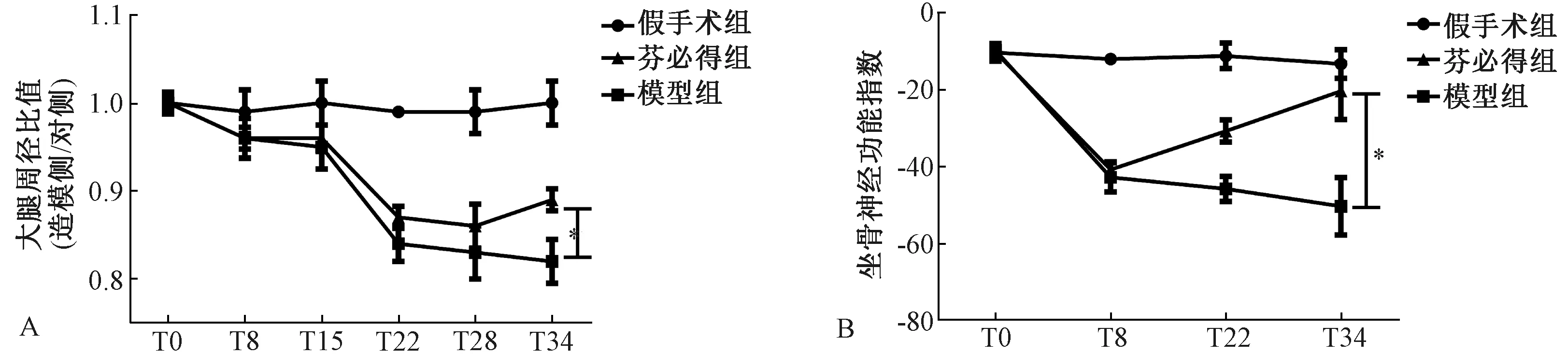
圖4 芬必得對腰椎間盤突出癥大鼠坐骨神經功能的影響注:Tn表示造模后第n天;n=16;*P<0.05Fig.4 Effect of Fenbid on the sciatic nerve function in rats with lumbar disc herniationNote:Tn indicates the nth day after modeling;n=16;*P<0.05
2.5 芬必得改善腰椎間盤突出癥大鼠的神經根病變及椎間盤病變
2.5.1背根神經節病理檢查結果;如圖5A所示,假手術組背根神經節結構完整,節細胞呈圓形或卵圓形,胞核大而圓、核仁清晰,胞漿內可見較多尼氏小體;節細胞周圍可見扁平或橢圓形衛星細胞環繞,節細胞間可見神經纖維及少量結締組織、小血管。模型組可見不同程度節細胞及軸突變性,主要表現為節細胞體積減小、嗜酸性增強、排列疏松,部分節細胞核膜模糊,尼氏小體細小、稀疏,個別節細胞胞質內見較大圓形空泡;節細胞周圍巨噬細胞數量增加,軸突嗜酸性增強、呈空泡狀、排列疏松。芬必得組可見節細胞及軸突變性,病變與模型組相似,但程度較輕。
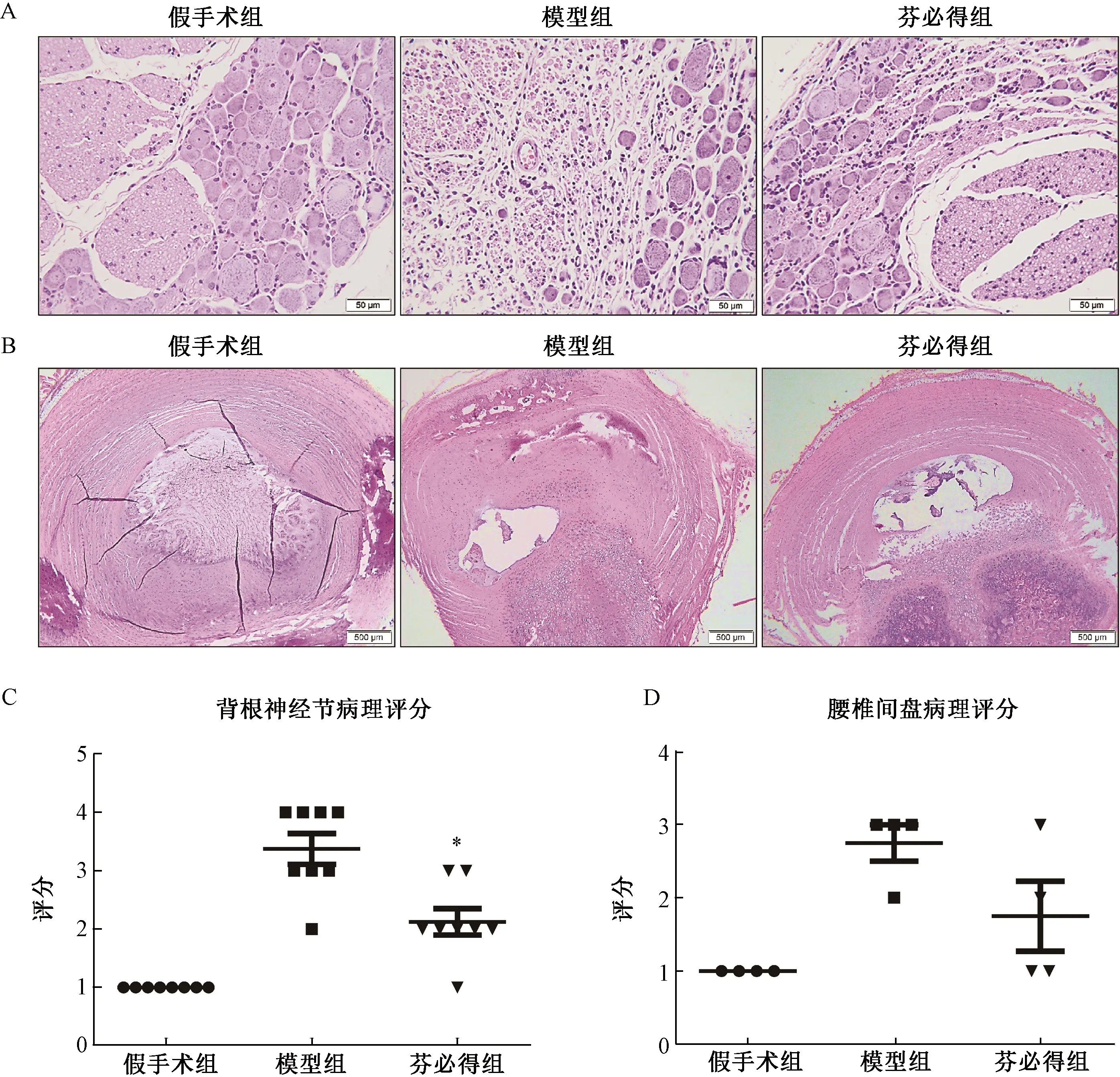
圖5 芬必得對腰椎間盤突出癥大鼠神經根及椎間盤病理變化的影響注:A:各組大鼠背根神經節組織HE染色結果;B:各組大鼠椎間盤組織HE染色結果;C:各組大鼠背根神經節組織病理評分,n=8;*P<0.05;D:各組大鼠椎間盤組織病理評分,n=4Fig.5 Effect of Fenbid on the pathological changes of nerve root and intervertebral disc in rats with lumbar disc herniationNote:A:HE staining results of dorsal root ganglion tissue in each group of rats;B:HE staining results of intervertebral disc tissue in each group of rats;C:Histopathological score of dorsal root ganglion in each group,n=8; *P<0.05;D:Histopathological score of intervertebral disc in each group,n=4
2.5.2椎間盤病理檢查結果:如圖5B所示,假手術組椎間盤結構完整,纖維環排列整齊、呈同心圓狀環繞于髓核外,兩者界線清晰;髓核內見大量黏液樣基質及脊索細胞、少量軟骨樣細胞。模型組可見不同程度退行性變化,主要表現為髓核體積減小、基質成分及脊索細胞減少、類軟骨細胞數量增加,部分動物可見髓核位置偏移、局部凸出、壓迫纖維環,被壓迫部位纖維環排列紊亂。芬必得組檢查可見不同程度退行性變化,病變與模型組相似,但程度較輕。
2.6 芬必得降低腰椎間盤突出癥大鼠的血清炎性相關因子
組織損傷及炎性反應可通過促炎因子等促進COX-2在損傷的局部組織和全身大量表達,誘導PGE2上調,相反COX-2/PGE2通路的激活也會導致炎性細胞因子IL-1β、IL-6等表達上調。如表2所示:與假手術組相比,模型組動物血清的COX-2、PGE2、IL-1β、IL-6、NO濃度明顯升高(P<0.05)。與模型組相比,陽性藥芬必得組動物血清的COX-2、PGE2、IL-1β、IL-6、NO濃度明顯降低(P<0.05)。
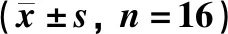
表2 芬必得對腰椎間盤突出癥大鼠的血清IL-1β、IL-6、NO、COX-2、PGE2的影響Table 2 Effect of Fenbid on serum IL-1β,IL-6,NO,COX-2 and PGE2 in rats with lumbar disc
注:與假手術組相比,*P<0.05,**P<0.01;與模型組相比,#P<0.05,##P<0.01
Note:compared with the sham operation group*P<0.05,**P<0.01;compared with the model group,#P<0.05,##P<0.01
2.7 芬必得降低腰椎間盤突出癥大鼠的背根神經節病變處炎性相關因子
如表3所示:與假手術組相比,模型組動物背根神經節病變處的COX-2、PGE2、IL-1β、NO濃度明顯升高(P<0.05)。與模型組相比,陽性藥芬必得動物背根神經節病變處的COX-2、PGE2、IL-1β、NO濃度明顯降低(P<0.05)。
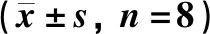
表3 芬必得對腰椎間盤突出癥大鼠的背根神經節病變處IL-1β、NO、COX-2、PGE-2的影響Table 3 Effects of Fenbid on IL-1β,NO,COX-2 and PGE2 in the dorsal root ganglion lesions of rats with lumbar disc n=8)
注:與假手術組相比,*P<0.05,**P<0.01;與模型組相比,#P<0.05,##P<0.01
Note:compared with the sham operation group*P<0.05,**P<0.01;compared with the model group,#P<0.05,##P<0.01
3 討論
腰椎間盤突出癥最基本的病因是腰椎間盤的退行性改變,在退行性改變的基礎上,由于勞累、外傷等因素使腰椎間盤發生結構等改變,纖維環破裂,髓核向外膨出或脫出,壓迫神經根或脊髓導致腰腿疼痛等癥狀。目前報道的LDH模型有多種,包括纖維環針刺損傷建模、手術損傷脊椎結構建模、化學損傷法、單純炎性刺激型模型、壓迫背根神經節模型、及壓迫與炎性刺激共存型。其中壓迫與炎性刺激共存型能夠較貼切地模擬人類腰椎間盤突出癥的發病機制。本實驗通過L型鋼棒經椎間孔對背根神經節進行壓迫,同時使用自體尾椎髓核移植到背根神經節處,成功構建了壓迫與炎性刺激共存型大鼠腰椎間盤突出癥模型。模型大鼠表現出行為學評分變化、過敏性疼痛、坐骨神經功能指數下降及椎間盤病理性變化。利用此模型可用于緩解疼痛及改善退行性變藥物的評價。
腰椎間盤突出癥(Lumbar Disc Herniation,LDH)所致坐骨神經痛等過敏性疼痛癥狀與炎癥反應程度密切相關。研究表明PGE2含量明顯升高,與LDH神經根癥狀呈正相關。前列腺素E2(PGE2)是一種主要的增強疼痛的炎癥介質,由花生四烯酸通過一系列酶包括環氧合酶(COX)產生。組織損傷和炎癥導致COX-2(誘導型COX誘導型異構體)局部大量誘導表達。另外,外周炎癥通過IL-1β誘導COX-2在脊髓背角神經元中的中樞作用。COX-2/PGE2通路的激活,增加了神經的敏感性,從而導致過敏性疼痛。臨床上NSAIDs (非甾體類抗炎藥,Non-Steroid Anti-Inflammtory Drugs)和COX-2抑制劑能減輕部分急性下腰痛患者的疼痛。另外COX-2也參與退化過程的PGE2的產生,該過程可能促進腰椎間盤退行性變。因此在臨床中使用COX抑制劑通過抑制COX活性減少前列腺素的合成,起到緩解疼痛,改善椎間盤退化作用,被較多地用于椎間盤突出癥患者的保守治療。本實驗對COX抑制劑芬必得治療腰椎間盤突出癥的療效進行了評價,結果顯示COX抑制劑可改善腰椎間盤突出癥模型大鼠的過敏性疼痛及椎間盤退行性變,與文獻報道一致。

