晚期胰腺癌超級伽瑪刀治療的臨床研究
宋長龍 汪金鋒 張 軍 羅曉蓉 李 勇 蔡永廣 黃瑞文 陳煥偉 李太東 康靜波
1 廣東省農墾中心醫院伽瑪刀治療區(湛江 524002)
2 廣東省農墾中心醫院腫瘤內科(湛江 524002)
3 解放軍總醫院第六醫學中心 放療科(湛江 524002)
胰腺癌因其解剖部位特點而難以在早期被發現和診斷,待晚期確診時,患者往往已經喪失手術機會。據文獻報道,能夠獲得根治性手術切除機會的患者僅占5%~10%[1]。國外大量研究認為,針對這類無法手術治療的晚期胰腺癌患者,探尋一種安全、有效的治療方法一直是該領域的研究熱點和難點[2]。目前臨床上主流的治療方法為內、外放療,但局限性較大[3]。超級伽瑪刀屬于全身伽瑪射線立體定向放射治療系統,不僅副作用較低,還能同時18個鈷源分上下兩排扇形分布,解決了入射角度調節的問題。但國內關于晚期胰腺癌患者應用超級伽馬刀治療的報到仍不多見。故本研究選取2015年1月—2019年1月我院收治的晚期胰腺癌患者46例,探討晚期胰腺癌超級伽瑪刀治療的臨床效果。
1 資料與方法
1.1 一般資料
選取2015年1月—2019年1月我院收治的晚期胰腺癌患者46例,其中男28例,女18例,年齡范圍40~80歲,平均(60.4±8.1)歲。納入標準:①符合晚期胰腺癌相關診斷標準[4];②能夠耐受本研究中超級伽馬刀或化療的治療方案;③簽署知情同意書。排除標準:①接受手術治療或其他照射、化療方案者;②合并其他重要臟器器質性病變;③合并精神類疾病無法配合完成治療者。根據TMN分期標準,III期者7例,IVa期者39例。32例患者腫瘤位于胰頭,8例位于胰體,6例位于胰尾。腫瘤直徑3.0~5.5 cm,有27例患者伴有不同程度的腹腔干、脾血管包繞或腹膜后淋巴結轉移。經醫院倫理委員會審批,將所有患者隨機分為對照組(23例)與觀察組(23例)。兩組患者各項基線數據差異無統計學意義,具有可比性(P>0.05)。
1.2 方法
對照組患者接受單純化療干預,具體為:根據NCCI相關推薦進行吉西他濱標準化療方案,劑量1 000 mg/m2,1次/d,通過外周靜脈進行滴注。對于治療過程中出現NCCI標準中2級以上化療不良反應的患者,將劑量降至800 mg/m2。若出現病情持續惡化、無法耐受化療等情況,則立刻停止化療。4周為1個療程,其中連續治療3周,休息1周。
觀察組患者接受超級伽馬刀治療,具體為:SGS-I設備行超級伽瑪刀治療,真空體模固定患者體位,進行CT增強掃描定位,病變部位層距5 mm掃描,范圍自膈頂上3~5 cm至右腎下極。由放射診斷科醫師和放射治療科醫師共同勾畫靶區。感興趣危及器官(organs at risk, OARs)包括肝臟、十二指腸、腎臟、胃和脊髓等,照射劑量不超過各自的耐受劑量。治療處方劑量為36~40 Gy, 割方式為 8~12 次, 等劑量曲線50%~60 %,GTV 覆蓋95 %以上,進行連續治療。通過劑量體積直方圖進行評估并優化放射治療方案。
1.3 評價標準
根據世界衛生組織(WHO)對腫瘤反映的評判標準,將本研究中研究對象的治療效果分為完全緩解(CR)、部分緩解(PR)、基本穩定(SD)以及疾病進展(PD),總有效率=(CR+PR)/n×100%[5]。臨床受益反應(CBR)包括疼痛強度、鎮痛藥物消耗量、KPS評分和體質量變化4個維度,分為陽性改善、陰性改善和穩定三級,記錄陽性指標例數。同時記錄兩組患者的無進展生存時間。
1.4 統計學分析
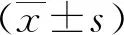
2 結 果
2.1 3比較
接受不同治療措施干預1個月后,對兩組患者治療總有效率進行比較。觀察組患者治療總有效率為60.87%,高于對照組患者治療總有效率13.04%(P<0.01),見表1。

表1 治療總有效率比較 n=38
2.2 臨床受益反應比較
接受不同治療措施干預1個月后,觀察組患者中疼痛程度改善陽性人數比例、KPS體力改善陽性人數比例和體質量改善陽性人數比例均高于對照組患者(P<0.05),但兩組患者鎮痛藥物消耗量改善陽性人數比例差異并無統計學意義(P>0.05)。見表2。

表2 臨床受益反應陽性例數比較 n=23
2.3 生存狀況比較
觀察組患者無進展生存期中位時間為4個月(95%CI,2.124±5.274),對照組患者無進展生存期中位時間為3個月(95%CI,1.804±4.851)。觀察組患者無進展生存期中位時間長于對照組患者(P=0.042)。
3 討 論
據臨床顯示,因胰腺癌放射敏感度低,局控需要較大劑量才有效果[6],但周圍器官的耐受量又相對偏低,所以常規放射治療很難提高劑量,預后改善有限[7]。而體部伽瑪刀、立體定向放療及適形放療等放射治療技術在治療中均能提高靶區劑量,降低正常組織劑量,在臨床應用中對局控率和生存率提高也有一定效果,因此實際中這三種技術被應用得越來越多[8]。
OUR體部伽瑪刀是最早采用的聚焦照射治療技術,副作用低,但缺點是只能垂直入射,會對周圍器官造成影響[9]。而超級伽瑪刀屬于全身伽瑪射線立體定向放射治療系統,特點是在扇形固定聚焦基礎上能包容旋轉360°拉弧聚焦,同時18個鈷源分上下兩排扇形分布。其優勢是弧段大小和入射角度可調,能根據實際位置選擇入射角度以避開某些重要器官,也可以根據病灶就近入射,更好地保護正常組織并完成靶區適型[10]。
臨床治療發現(結果見表1、2),立體定向放射治療在局部止痛上的效果較好,腸道反應輕,但生存期偏短,姑息治療效果不如高分割,因此,立體定向發射治療多采用大劑量小分割的劑量分割方案(單次36~40 Gy,8~12次)。靶區內劑量分布階梯由處方劑量的等劑量曲線決定,對治療有直接影響[11]。三維適形放療的靶區內劑量分布均勻,處方等劑量曲線一般在90%;而體部伽瑪刀的劑量分布極不均勻,類似高劑量率近距離放療,因此靶區平均劑量比三維適形放療更高,能有效提高控制概率,獲得更好的腫瘤局控[12]。
胰腺癌患者中,特別是無法手術的患者,局部復發嚴重影響了患者的生存。有學者在治療后復發的病例中發現:邊緣劑量在33~42 Gy之間的病例中8例腫瘤過大、6例侵犯十二指腸或胃壁,治療效果不佳;而另外7例腫瘤體積大,邊緣劑量在35~51 Gy之間都獲得療效,并未影響治療,由此可見可以提高計量促進此類較大體積的腫瘤治療。同時根據臨床病例調查統計,要獲得無復發的局控,必須提高到52 Gy(2.0 Gy/次5次/周)以上的邊緣劑量[13]。因此基于這樣的病例實際,超級伽瑪刀治療能有效做好局控,提高計量優化治療的效果得以充分展現。還有學者研究認為,單次劑量過大或靶區過大,都嚴重影響胰腺癌患者產生并發癥的概率,而在本研究中,超級伽瑪刀不僅能自主調節,獲得更好的適形度,甚至可以做到與靶區重合的適形,能更好地保護周圍正常組織。同時,其靶區劑量分布不均勻、極為分散,使正常組織受量低、副作用小,更適合于胰腺癌治療,安全系數高,療效強[14]。近期不良反應主要是上消化道反應及骨髓抑制反應,根據RTOG放射反應分級,均屬于1、2級,通過臨床對癥處理,均能順利完成治療,全部患者未出現3級以上不良反應。
綜上所述,基于立體定向伽馬射線全身治療系統的超級伽瑪刀采用中等劑量分割方法治療晚期胰腺癌,其臨床效果切實,副作用相對較低,對患者生存治療有明顯提升效果,值得臨床推廣。

